烟草幼苗对复合盐碱的生理响应
2020-04-01刘晓涵张晓帆李雪利王静姚鹏伟张胜徐亮叶协锋
刘晓涵,张晓帆,李雪利,王静,姚鹏伟,张胜,徐亮,叶协锋
1 河南农业大学烟草学院,国家烟草栽培生理生化研究基地,烟草行业烟草栽培重点实验室,郑州 450002;2 中国烟草总公司职工进修学院,郑州 450002;3 湘西自治州烟草公司,湖南吉首 416000
土壤盐渍化在世界范围内普遍存在,它已经成为人们不得不面对的生态问题[1]。据不完全统计,世界范围内的盐渍土壤面积约为9.54 亿公顷,我国盐渍土壤面积约3460 万公顷,占可耕地面积的1/3,且主要分布在东北、华北、西北内陆地区以及长江以北沿海地带[1]。土壤盐渍化是一个渐进的过程,化肥用量增加、不合理的灌溉,致使土壤次生盐渍化状况愈来愈重[2-3]。研究发现,河南12 个植烟区已经有部分出现次生盐渍化现象[4];赵莉[5]对比了2006 年和2009年湖南植烟土壤盐分含量,发现2009 年该地区植烟土壤出现盐分表聚现象;石红丽[6]也表示湖南植烟土壤盐分表聚现象严重。进一步分析发现,湖南植烟区SO42-、NO-3、Ca2+、K+和Na+在土壤表层积累较多[7];而在内陆盐碱地,特别是松嫩平原,碱性盐NaHCO3和Na2CO3大量存在[8]。
在盐渍土壤中,部分土壤由于存留较多的NaHCO3等碱性盐,导致土壤pH 升高,造成的土壤碱化问题比由NaCl 和Na2SO4等中性盐造成的土壤盐化问题更为严重[9]。在盐碱胁迫下,植物的吸水能力减弱,叶绿素含量降低,光合作用受到影响,且随着盐碱浓度增大和胁迫时间延长,抑制作用愈发明显[10],而抗氧化酶活性和根系活力在低浓度胁迫时有增高趋势,胁迫浓度升高,均表现降低趋势[11],此外,盐碱胁迫造成的高pH 会影响植物根系对矿质元素的吸收,阻碍离子稳态的重建[12]。
近些年人们对盐碱胁迫的研究越来越广泛,但多数仍集中于对盐胁迫或盐胁迫与碱胁迫的比较方面[13-15],关于烟草对复合盐碱的生理响应方面研究相对较少。因此本文以复合盐碱溶液模拟盐碱环境,探索不同盐碱胁迫下烟草幼苗的生理代谢反应机制,为今后相关方面研究提供理论依据。
1 材料与方法
1.1 试验方法
试验于2017 年5~7 月在河南农业大学国家烟草栽培生理生化研究基地进行。选取耐盐能力较弱的中烟100[16]进行漂浮育苗,按照正常育苗管理办法进行加肥(种子由青岛中烟种子有限责任公司提供;烟草漂浮育苗专用基质由山东数能信息科技有限公司提供;烟草漂浮育苗专用化肥由许昌科宏工贸有限公司提供),施加人工光源进行培养,光强为1500~1800 Lux,光照时长为13 h/d,相对湿度70%~75%。培育40 d 后选择长势均匀一致的烟苗,用蒸馏水培养3 d后,将装有烟苗的育苗盘放到不同质量浓度的复合盐碱溶液中进行处理(每个处理保留120 株烟苗,且在处理的16 d 内不加肥),复合盐碱为n(NaCl):n(Na2SO4):n(NaHCO3)=1 :1 : 1,共设CK(蒸馏水)、T1(0.3%)、T2(0.6%)、T3(0.9%)和T4(1.2%)五个处理,每天上午9:00 测定盐溶液电导率并补充蒸馏水以保证盐浓度稳定,4 d 换一次水,处理后0 d、4 d、8 d、12 d、16 d 取样,每个指标使用3 株烟苗,并重复3 次进行测定。各盐碱处理的盐分浓度与组成及对应的电导率值、pH 值见表1。
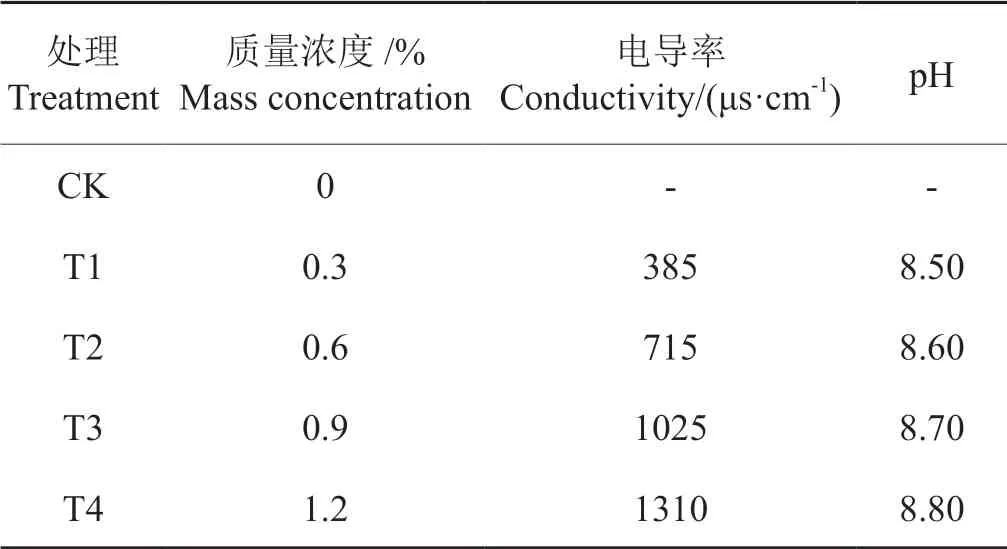
表1 复合盐碱处理的盐分组成与pHTab. 1 Salt composition and pH of compound saline-alkali treatment
1.2 测定项目及方法
每个处理选取具有长势均匀一致的烟苗,保留除心叶外自上而下数的第一片叶和第二片叶,剪碎混匀后测定以下指标。叶片相对含水率采用鲜重法[17],叶绿素采用乙醇提取研磨法[17],细胞膜透性采用Lutts 等[18]的方法,脱落酸(ABA)、和玉米素核苷(ZR)参照酶联免疫吸附法(ELISA)由中国农业大学测定[19],丙二醛(MDA)采用硫代巴比妥酸法[17],脯氨酸采用磺基水杨酸法[17],可溶性糖采用蒽酮法[17],超氧化物歧化酶(SOD)活性采用氮蓝四唑 (NBT)法[17],过氧化氢酶(CAT)活性采用高锰酸钾滴定法[17]。
处理后0 d、4 d、8 d、12 d、16 d,每个处理选取具有代表性的3 株烟苗,沿茎基部将根与茎分离,根系活力采用TTC 法[18];将根系清洗干净,尽量保证根系不断裂破损,利用扫描仪(V700 Epson)扫描根系图像,再用Win RHIZO PRO 2007 根系分析系统软件(Regent Instruments Inc8,Canada)分析根系形态学参数。
1.3 数据处理
数据采用SPSS 20.0 软件进行统计分析,使用Microsoft Excel 2010 作图。
2 结果与分析
2.1 复合盐碱处理对烟草幼苗根系的影响
从试验第8 d 各处理根系扫描图(图1)可以看到,处理间根系生长已表现出较明显差异,随复合盐碱浓度的增大,各处理根的数目逐渐减少,胁迫作用逐渐增强。
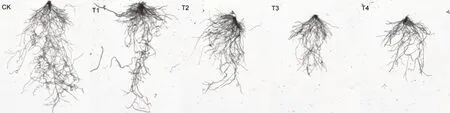
图1 复合盐碱处理对烟草幼苗根系形态的影响Fig. 1 Effects of compound saline-alkali treatment on root morphology of tobacco seedlings
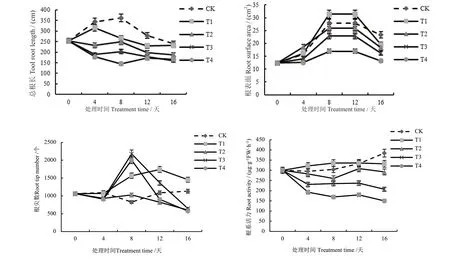
图2 复合盐碱处理对烟草幼苗根系指标的影响Fig. 2 Effect of compound saline-alkali treatment on root indicators of tobacco seedlings
由图2 可知,随着盐碱浓度的逐渐增大,烟苗总根长呈逐渐降低趋势,T4 烟苗根长在处理时间内均表现为最短。各处理根表面积呈先增后降趋势,低浓度处理(T1)在8~12 d 时表现出最大的根表面积,达31.18 cm2,浓度进一步增大抑制了根表面积的增加。根尖数的变化较为明显,T1 对根尖数有促进作用,T2 对根尖数有轻微抑制,而T3、T4 处理的根尖数随着处理时间延长先快速增加又快速下降,表明根尖对高盐碱处理较敏感。CK 和T1 处理根系活力随时间延长缓慢升高,T2、T3 和T4 处理的根系活力则呈缓慢下降趋势,且有较明显的差异,其中处理T1的根系活力在处理后12 d 达到最大值336.04 µg/(g·h),其他处理均低于CK,且始终保持T2>T3>T4 的状态;CK 的根系活力持续增大,在16 d 时达到最大值384.41 µg/(g·h)。
2.2 复合盐碱处理对烟草幼苗叶绿素含量的影响
从表2可知,各处理叶绿素含量随时间延长呈“∧”变化,且在16 d 时,CK 处理的各项叶绿素指标均为最高;其中各处理叶绿素a含量均在第8 d达到最大值,随后表现为盐碱浓度越大,叶绿素a 含量越低;而叶绿素b 含量表现与叶绿素a 略有不同,T1 处理叶绿素b 含量在0~4 d 时高于CK,在12 d~16 d,各处理叶绿素b 含量和叶绿素总量均表现为CK>T1>T2>T3>T4;对比各处理叶绿素a/b 发现,处理T1、T2 叶绿素a/b整体先升后降,且在处理12 d 前均高于CK,但差异不显著;其他处理叶绿素a/b 随时间延长呈逐渐下降趋势,处理16 d 时T4 叶绿素a/b 上升至1.85。
2.3 复合盐碱处理对烟草幼苗叶片相对含水率的影响
由图3 可知,T1、T2、T3 和T4 处理的相对含水率均随处理时间延长和处理浓度增加而降低,在第4 d 下降明显,T4 由85.67%降至72.56%;处理后第16 d,T1 的相对含水率为71.33%,较CK 下降16.71%,而此时T4 仅为54.64%,叶片不能维持正常的生理状态。

图3 复合盐碱处理对烟草幼苗叶片相对含水率的影响Fig. 3 Effects of compound saline-alkali treatment on relative moisture content of leaf of tobacco seedlings

表2 复合盐碱处理对烟草幼苗叶绿素含量的影响Tab. 2 Effects of compound saline-alkali treatment on chlorophyll content in tobacco seedlings
2.4 复合盐碱处理对烟草幼苗叶片细胞膜透性及抗氧化酶的影响
由图4a 可知,随着复合盐碱浓度的增大,烟草幼苗叶片细胞膜相对电导率不断增加,即细胞透性逐渐增大;在4 d 时处理T1 的相对电导率较CK 低,未达到显著水平,处理后8~12 d,各处理相对电导率逐渐上升且显著高于对照处理,T4 更是在12 d 达到了85.23%;处理16 d 时,各处理电导率变化趋于平缓,T4>T3>T2>T1>CK。MDA 含量变化与细胞膜透性大致相同,即处理浓度越大,时间越长,MDA 含量越高,处理后16 d 时,复合盐碱处理中T1 和T2 变化较慢,T3 和T4 持续增大,分别达到52.35 和59.24 nmol/g(图4b)。
由图4c-d 可知SOD 酶活表现为CK 和T1 变化波动相对较小,T2、T3 和T4 先升后降,在处理后第8 d,T4 处理SOD 酶活达到最高,为171.06 U/(g·h),其他盐碱处理呈下降趋势。CAT 活性的变化趋势与SOD 相似,但处理间差异变化更大且前期反应更为迅速,处理后0~8 d,各处理均呈上升趋势,第8 d各盐碱处理达到最大值,此时T4>T3>T2>T1>CK,随时间增加,盐碱处理的CAT 活力开始降低,第16 d 各处理间已无明显差异。
2.5 复合盐碱处理对烟草幼苗渗透调节物质的影响

图4 复合盐碱处理对烟草幼苗叶片细胞膜透性及抗氧化酶的影响Fig. 4 Effects of leaf saline-alkali treatment on cell membrane permeability and antioxidant enzymes of tobacco seedlings

图5 复合盐碱处理对烟草幼苗叶片可溶性糖和脯氨酸含量的影响Fig. 5 Effects of compound saline-alkali treatment on soluble sugar and proline contents in tobacco seedling leaves
由图5 可知,4 d 时随着复合盐碱浓度的增大,可溶性糖含量呈增加趋势;处理后4~8 d,处理T4 逐渐下降,其他处理逐渐升高;处理后第12 d,T4 快速下降至0.81%,其他处理缓慢上升;处理后12~16 d,各处理均有下降趋势,T3 和T4 均低于CK。脯氨酸含量的变化趋势,除CK 持续升高外,其他处理先升后降。复合盐碱胁迫4 d 后,各处理脯氨酸含量均有一定增长,且均高于对照;8 d 时,处理间脯氨酸含量为T4>T3>T2=T1>CK;处理后第12 d,除T4 外,其他处理持续升高;处理后12~16 d,除CK 略有上升外,其他均呈下降趋势。
2.6 复合盐碱处理对烟草幼苗根尖ABA 和ZR 含量的影响
由图6 可知,复合盐碱处理下根尖ABA 含量变化相对平缓,主要集中在20~40 ng/g。处理后第4 d,处理T1 和T2 有所下降,CK、T3 和T4 均随时间延长而升高;处理12~16 d,T1 和T2 根尖的ABA 含量有所下降,T3、T4 则急剧上升,第16 d 分别达到50.00 和57.29 ng/g,较对照增加71.35%和96.33%。盐碱处理下根尖ZR 含量变化波动较大,处理后第4 d,各盐碱处理根尖ZR 含量快速升高,且均高于CK;处理后第8 d,处理T1 根尖ZR 含量达到最高值,为9.75 ng/g,且各盐碱处理均高于CK;处理后8~12 d,处理T1 和T2 根尖ZR 含量逐渐下降;12 d 时处理T3 达到最大值,为12.56 ng/g;处理后16 d,CK 高于各盐碱处理。
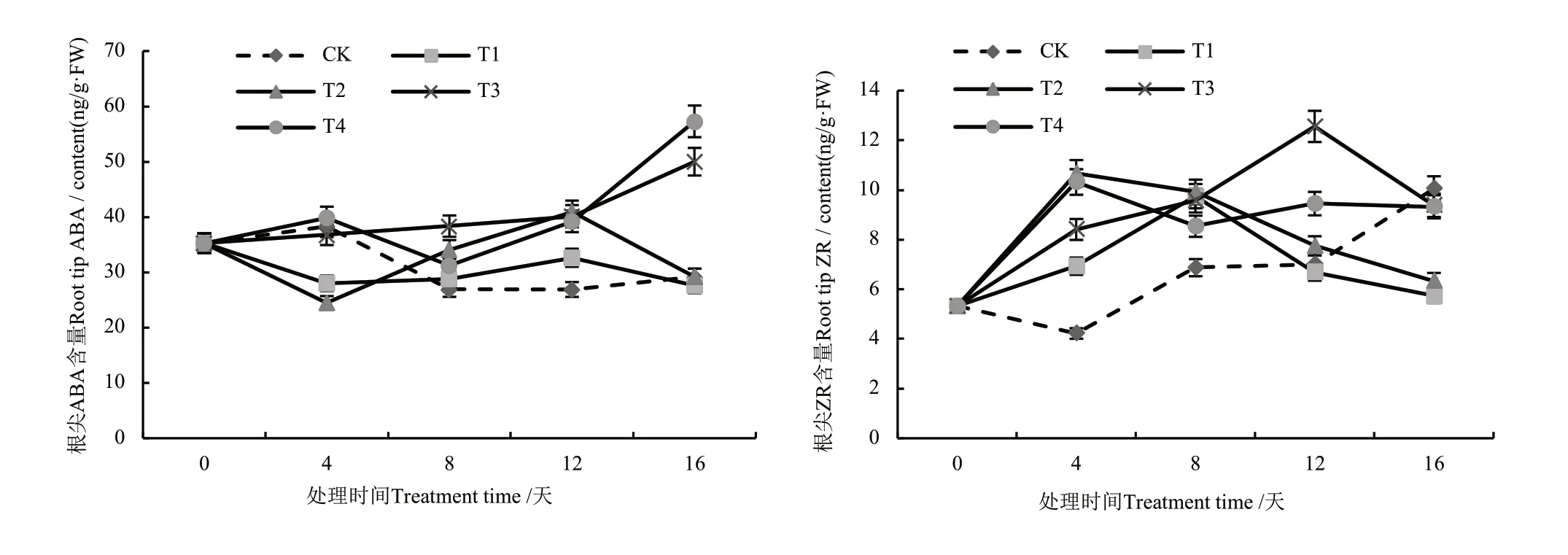
图6 复合盐碱处理对烟草幼苗根尖ABA 和ZR 含量的影响Fig. 6 Effects of compound saline-alkali treatment on ABA and ZR contents in root tip of tobacco seedlings
3 讨论
根系的生长存在很大的可塑性,它能够通过改变形态与分布来适应不利环境,在盐碱胁迫下根部是面对胁迫的首要部位。所以根的生长发育状况和活力对植物的耐盐能力至关重要[20]。本研究发现在轻度盐碱胁迫下,烟苗总根长相对CK 变短,可能是烟苗根系为减少Na+的吸收而做出的适应性变化[21],在盐碱处理12 d 时,特别是T3、T4 的许多根尖由白嫩变褐腐烂,16 d 时这种情况更加普遍,可能是长期高盐碱环境导致幼嫩的分生组织坏死,不能持续生长[22]。同时盐碱处理降低了烟苗的根系活力,这可能是盐碱环境中高pH 所产生的抑制作用,丁俊男等[23]试验也证明了根活与pH 呈极显著负相关。该处理根系的变化趋势与前期所做复合盐处理条件下变化趋势大致相似。盐分积聚造成根际的高渗透势,使得根系的矿质营养状况及氧气供应能力严重破坏,而较高的pH 又迫使根系合成并积累大量的有机酸,因此导致细胞内离子失衡、代谢紊乱,最终植物根系生长受到破坏[24]。
盐碱胁迫对根系的生长发育造成破坏,影响了营养物质向地上部的运输,进而造成地上部分生长受抑制,光合作用受到影响[25]。本文研究表明在0~8 d 时,T1 处理的叶绿素含量高于CK,这可能是在盐碱胁迫下叶绿素合成前体物δ-氨基酮戊酸(ALA)、胆色素原(PBG)和尿卟啉原Ⅲ(Uro Ⅲ)大量积累[26],促进了叶绿素的合成;而在8~12 d,随着盐碱浓度的增加,叶绿素a、叶绿素b 的含量和叶绿素a/b 逐渐下降,这可能是盐碱胁迫引起了叶绿素的降解[27],同时叶绿素比例发生变化[28]所致;薛延丰等[29]认为盐碱胁迫造成的叶绿素含量下降可能是碱性盐胁迫破坏了细胞微环境的酸碱平衡,影响叶绿体类囊体两侧H+浓度梯度的建立,从而降低了叶绿体中ATP 合成的动力。对于试验中处理后16 d 部分处理叶绿素升高的现象,这可能是因为胁迫时间越长,植株代谢紊乱越严重,导致叶片叶绿素与蛋白间的结合变得松弛,使得在测定中叶绿素更容易被提取,从而造成复合盐碱处理的叶绿素含量有升高趋势[30]。在复合盐胁迫与复合盐碱胁迫下,烟草幼苗的叶绿素含量均减少,与前期复合盐试验数据相比,在相同离子浓度情况下,复合盐碱胁迫处理的烟草幼苗叶绿素含量降幅更大。
本试验中盐碱处理的可溶性糖和脯氨酸含量的变化与叶绿素的变化规律相似,均呈现先升后降的趋势,这是由于脯氨酸的合成有赖于碳水化合物通过氧化磷酸化作用提供的氢和还原能力[31],长时间盐碱作用下导致光合能力受到抑制,提供还原能力减弱,导致后期脯氨酸含量下降;同时ABA 可以促进脯氨酸的合成,影响细胞内H+分泌,改变细胞液内酸碱平衡,这也是脯氨酸含量变化波动较大的原因[24,32]。同时与复合盐处理结果对比发现,复合盐碱伤害更大,在复合盐处理下,可溶性糖和脯氨酸含量呈上升趋势;在复合盐碱胁迫条件下随着浓度的增大,两种物质含量在某一浓度达到峰值后,呈现下降趋势,表明盐碱胁迫能使烟苗更早达到耐盐阈值,进而导致其渗透调节系统失衡。
周瑞莲等[33]指出植物细胞中水分状况与有机渗透调节物多少有关,水分状况良好时,将更多光合产物用于生长,限制有机渗透调节物的合成及可溶性糖向根输入;在细胞缺水时,则促使脯氨酸和可溶性糖等有机渗透调节物合成含量增加。本文研究结果显示,盐碱处理的烟苗叶片含水率随着时间延长逐渐降低,叶片缺水可能是有机渗透调节物合成的另一诱因。从这两种物质含量的变化可以看出短期胁迫下植物应激反应较强,而长时间处于胁迫状态,植物抗盐碱能力逐渐降低。
许多研究指出激素对植物抗逆性的调节不依赖于单一激素的绝对含量,是各类激素达到一个动态平衡状态[29]。本研究结果显示随着处理时间的延长,烟草幼苗体内ABA 含量呈波动式增长,这与前期复合盐处理试验结果变化趋势和刘磊[34]研究盐碱胁迫下甜菜苗期的结果相似,可能是胁迫条件下,植物体内维持ABA 与ZR 的平衡,控制气孔开闭,改变叶片气孔阻力,从而减少水分蒸发抵御高盐胁迫[35~36]。从结果来看,初期胁迫诱导植物产生应激反应,根部抗逆能力增强,合成ZR增多,与前期进行的盐胁迫相比,增幅更加明显。随胁迫时间的增长,分生组织细胞膜受到破坏,合成功能受阻[30]。
综上所述,烟草幼苗在低浓度的复合盐碱处理下根系发育状况良好,叶片合成叶绿素可维持正常代谢,自身的渗透调节、激素及相关酶系统仍处于动态平衡状态。随着胁迫程度的增加,根系发育迟缓,叶绿素含量和叶片含水率有降低趋势,而细胞膜不同程度受损,体内渗透调节物质合成增多,激素含量变化较大,烟苗生长受阻。然而在复合盐碱处理下,不同生育期的烟株生理代谢状况会有哪些变化,还有待进一步研究。
4 结论
低浓度的复合盐碱处理在一定程度上促进叶绿素合成,且短时低盐碱胁迫对根表面积及根活等有不同程度的促进;高浓度、长时间的复合盐碱胁迫会对烟草幼苗细胞膜、叶绿素及根系造成损伤,且浓度越大、时间越长抑制效果越明显。
遭受胁迫后,烟草幼苗的内源激素、有机渗透调节物质及抗氧化酶系统均在短期内做出了响应。随着处理浓度的增加和时间的延长,根系生长受阻,叶绿素含量逐渐下降,ABA、可溶性糖和脯氨酸含量均呈下降趋势,植物体内的代谢紊乱。
