斜坡恶性肿瘤个体化外科治疗
2020-04-01左赋兴刘昂斯胡珂孔建新李学记冯铭万经海
左赋兴 刘昂斯 胡珂 孔建新 李学记 冯铭 万经海
斜坡是颅底解剖结构最为复杂的区域之一,其位置深在、周围重要神经血管众多,手术难度和风险明显高于其他部位。由于斜坡解剖的特殊性,该部位的恶性肿瘤通常呈现体积巨大,广泛累及鼻窦、咽部、眶部、前颅底、鞍区、中颅底等结构甚至压迫脑干、脊髓的生物学特点,而上述区域的病变也常侵及斜坡,患者就诊时病情大多已进展至晚期阶段[1⁃2]。斜坡恶性肿瘤病理类型十分复杂,术前定性诊断困难,不同肿瘤治疗原则不尽相同,围手术期需神经外科、头颈外科、放疗科、肿瘤内科等多学科诊疗模式(MDT)进行综合评估,从而选择个体化手术入路和综合治疗方案[1,3]。本研究拟对中国医学科学院肿瘤医院近10 年收治的56 例斜坡恶性肿瘤患者的诊断与治疗经过进行回顾分析,以期提高术前定性诊断的准确性,并为合理选择手术入路、制定个体化综合治疗方案提供参考。
临床资料
一、病例选择
所纳入病例均需符合以下条件:(1)术前头部CT 和MRI 提示斜坡占位性改变且骨质广泛受累。(2)外科手术切除病变,并经术后病理证实为斜坡恶性肿瘤。(3)患者及其家属对病情及手术风险知情,并签署知情同意书。(4)本研究经中国医学科学院肿瘤医院道德伦理委员会审核批准。
二、临床资料
1.一般资料 选择2007 年7 月至2018 年12 月在我院神经外科行手术治疗并经术后病理证实的斜坡恶性肿瘤患者共56 例,男性35 例,女性21 例;年龄15 ~74 岁,平均为46.30 岁。其中,新发肿瘤46 例(82.14%)、复发肿瘤10 例(17.86%);复发者中5 例于外院手术切除后经病理证实为肌纤维母细胞瘤(2 例)或脊索瘤(3 例),5 例未行手术且无病理诊断直接于外院辅助立体定向放射治疗(SRT)。
2.症状与体征 顽固性头痛和渐进性脑神经麻痹为临床常见症状与体征,严重者可因压迫脑干而出现运动感觉障碍;病变累及口鼻咽或颈部等周围结构者,还可出现鼻塞、流涕、吞咽困难以及颈部包块等局部症状。本组患者主要表现为头痛(33 例次占58.93%),眼外肌麻痹(19 例次占33.93%),鼻塞(17 例次占30.36%),饮水呛咳、声音嘶哑、舌肌萎缩(13 例次占23.21%),吞咽有异物感(10 例次占17.86%),视力障碍和视野缺损(12 例次占21.43%)、肢体活动障碍(5 例次占8.93%)以及面部麻木疼痛(7 例次占12.50%)。
3.影像学表现 头部MRI 和CT 检查主要呈现斜坡占位效应,骨质广泛破坏,肿瘤形态各异,主要位于硬膜外(40 例占71.43%)或者硬膜内外相交通(16 例占28.57%);病灶直径3.00 ~7.50 cm,平均为5.15 cm。本组有24 例患者病灶位于斜坡中线,硬膜外15 例(62.50%)、硬膜内外相交通9 例(37.50%);向两侧呈对称侵袭性生长者高度怀疑脊索瘤,MRI表现为稍长T1、长T2信号,增强后病灶呈不同程度强化,CT 以等或低密度为主,斜坡呈溶骨样改变,可见散在高密度影;其余32 例影像学表现无典型特征,术前定性诊断困难。
三、治疗方法
1.多学科诊疗模式 经神经外科、头颈外科、放疗科、肿瘤内科、影像科共同组成的多学科诊疗模式对患者进行综合评估后,制定个体化治疗方案。其中,影像科提供详细的病灶定位信息,协助神经外科和头颈外科做出定性诊断;神经外科血管介入亚专科通过全脑血管造影判断肿瘤组织血供,以及周围血管走行,决定是否需行球囊闭塞试验(BOT)或肿瘤供血动脉栓塞治疗等;神经外科和头颈外科联合甄别手术适应证、选择手术入路,并在术中根据病理科提供的冰冻组织病理检查结果调整手术方案;肿瘤内科和放疗科评估辅助治疗适应证并制定相应治疗方案,并对经病理确诊的恶性肿瘤患者进行综合治疗。
2.手术方法与组织学类型 (1)麻醉方式:除经口腭入路需行经鼻气管插管全身麻醉外,其余手术入路均采用常规经口气管插管全身麻醉。(2)手术入路与方式:本组11 例(19.64%)通过组织活检术确诊的患者,选择经鼻入路;余45 例(80.36%)均按术前计划行肿瘤根治性切除术,根据病变部位、累及范围、微侵袭理念分别选择单纯经鼻入路(15 例占33.33%)、经口腭联合口鼻入路(7 例占15.56%)、上颌骨掀翻入路(9 例占20%)、Derome 入路(8 例占17.78%)、颞下入路(6 例占13.33%)。本组56 例患者中27 例行神经内镜手术,手术入路包括经口腭联合 口 鼻(5 例 占18.52%)和 单 纯 经 鼻(22 例 占81.48%)入路;余29 例均行显微镜手术,手术入路分别经口腭联合口鼻(2 例占6.90%)、单纯经鼻(4 例占13.79%)、上颌骨掀翻入路(9 例占31.03%)、Derome 入 路(8 例 占27.59%)、颞 下 入 路(6 例 占20.69%)。(3)肿瘤组织学类型:包括脊索瘤28 例(50%)、鼻 咽 鳞 癌6 例(10.71%)、转 移 瘤4 例(7.14%),浆细胞瘤、肌纤维母细胞瘤、骨肉瘤各3 例(各占5.36%),涎腺上皮肌上皮癌、软骨肉瘤和淋巴瘤各2 例(各占3.57%),骨巨细胞瘤、纤维肉瘤和横纹肌肉瘤各1 例(各占1.79%)。
3.围手术期辅助治疗 本组有31 例患者术后继续在我院接受放射治疗或药物化疗;其余25 例中16 例术后在当地医院接受辅助治疗(具体方案不详),9 例未行任何辅助治疗。(1)术前放射治疗:2 例(6.45%)肌纤维母细胞瘤残留患者在二次手术前接受适形调强放射治疗为2 Gy/次×15 次,总剂量为30 Gy。(2)术 后 适 形 调 强 放 射 治 疗:共21 例(67.74%)患者术后行适形调强放射治疗,包括脊索瘤(8 例 占25.81%)、肌 纤 维 母 细 胞 瘤(3 例 占9.68%)、软骨肉瘤(2 例占6.45%)、鼻咽鳞癌(5 例占16.13%)、浆细胞瘤(3 例占9.68%),靶剂量分别为脊索瘤和软骨肉瘤1.80 ~2.00 Gy/次×35 次,总剂量为55 ~75 Gy;肌纤维母细胞瘤2 Gy/次×33 次,总剂量66 Gy;鼻咽鳞癌2 Gy/次×35 次,总剂量70 Gy;浆细胞瘤2 Gy/次×28 次,总剂量56 Gy。(3)术后立体定向放射治疗:2 例(6.45%)脊索瘤患者于术后接受立体定向放射治疗,靶剂量为6 ~8 Gy/次×4 次(4 周),总剂量30 Gy。(4)同步放化疗:共6 例(19.35%)术后接受同步放化疗,2 例淋巴瘤照射剂量为2 Gy/次×25 次,总剂量50 Gy,化疗方案为依托泊苷100 mg(第2 ~5 天)联合吉西他滨1.60 g(第1 和8 天),21 天为1 个周期,共治疗8 个周期;4 例转移瘤根据原发肿瘤制定相应药物化疗方案。
四、转归与随访
1.影像学复查 根据术后CT 和MRI 检查结果,定义全切除、次全切除(肿瘤残留体积≤10%)和部分切除(肿瘤残留体积>10%),在45 例行根治性切除术患者中,全切除21 例(46.67%)、次全切除17 例(37.78%)、部分切除7 例(15.56%)。
2.并发症 本组术后并发症发生率为50%(28/56),包括神经功能障碍(13 例次占23.21%)、脑脊液鼻漏(14 例次占25%)、颅内感染(8 例次占14.29%)、肺部感染(2 例次占3.57%)、术区出血(2 例次占3.57%)、精神症状(1 例次占1.79%),均予对症支持治疗。(1)后组脑神经麻痹(7 例次占12.50%):采取鼻饲流食、气管切开辅以营养神经等治疗,术后1 周试饮水、术后2 周拔除气管插管;5 例术后1 个月可自主进食、咳痰有力,2 例随访期间仍遗留声音嘶哑、饮水呛咳。(2)非后组脑神经功能障碍(6 例次占10.71%):面神经功能障碍患者术后于外院行面部整形修复术(2 例次),眼外肌麻痹患者经神经营养药物治疗症状有所改善(4 例次)。(3)脑脊液鼻漏(14 例次占25%):均于术后行腰椎穿刺腰大池引流术,其中12 例(12/14)1 周后治愈、1 例(1/14)放弃治疗、1 例(1/14)死 亡。(4)颅 内 感 染(8 例 次 占14.29%):分别予以万古霉素(1 g/12 h)或美罗培南(2 g/8 h)抗感染治疗痊愈。(5)肺部感染(2 例次占3.57%):采取莫西沙星(0.40 g/d)抗感染,同时予以雾化吸入、平喘化痰、加强翻身拍背等辅助治疗,均治愈。(6)术区出血(2 例次占3.57%):静脉注射止血药、引流管内注射尿激酶使血肿液化排出。(7)精神症状(1 例占1.79%):经镇静、抗躁狂药物治疗后症状好转。
3.预后 (1)术后转归:本组术后恢复不良患者共3 例,1 例软骨肉瘤患者术后偏瘫长期卧床致肺栓塞、1 例(鼻咽鳞癌)组织活检术后因脑脊液鼻漏致颅内感染、1 例复发脊索瘤二次手术后脑脊液鼻漏致颅内感染,前两例因经济原因放弃治疗自动出院,后者死于重度休克;余53 例均顺利出院。(2)随访:术后随访12 ~137 个月,平均59.90 个月。56 例中8 例(14.29%)失访;16 例(28.57%)疾病无进展;13 例(23.21%)疾病进展,其中5 例再次于我院手术切除残留肿瘤灶、2 例再次行药物化疗、6 例目前仍密切随访;19 例(33.93%)死亡病例分别死于肿瘤复发或进展(9 例)、颅内感染(2 例)、肺栓塞(1 例)、放射性脑坏死(3 例)、骨髓抑制(4 例)。
典型病例
例1 男性,29 岁。主诉头痛、发热2 个月,加重伴复视10 天,于2014 年9 月28 日入院。患者2 个月前无明显诱因出现间断性头痛、发热,体温最高时可达38.5 ℃,休息后头痛症状可自行缓解。自发病以来上述症状呈进行性加重,10 天前出现视物成双,当地医院以“发热待查”予抗感染治疗(具体方案不详),疗效欠佳,此后仍持续发热,体温波动于38 ℃,视物成双,遂至我院就诊。既往史中2012 年曾行阑尾切除术。入院后体格检查:体温38.3 ℃,右眼外展受限,复视。实验室检查无特异性指标。头部CT 检查显示,包括斜坡、右侧咽旁、岩尖在内的中颅底混杂密度影伴广泛骨质破坏(图1a)。MRI增强扫描显示病灶呈明显均匀强化,边界不清(图1b)。临床诊断:斜坡右侧侧颅底占位性病变。2014 年11 月6 日全身麻醉后于显微镜下行经鼻蝶入路颅底占位性病变活检术,术中可见肿瘤侵犯蝶窦、斜坡至右侧咽旁,呈灰白色、质地脆软,血供一般,边界不清,斜坡骨质破坏明显,切取部分病变组织行术中冰冻病理学检查,提示淋巴瘤,终止手术。术后患者自觉右侧面部浅感觉减退,颜面部肿胀。术后组织学形态观察,肿瘤细胞胞核大且居中,异型性明显(图1c);免疫组化染色,肿瘤细胞白细胞共同抗原(LCA,图1d)、CD99 和CD30 呈强阳性,波形蛋白(Vim)和CD5 表达阳性,广谱细胞角蛋白(PCK)、细 胞角蛋 白7(CK7)、神 经 微丝蛋 白(NF)、CD20、CD3、间变性淋巴瘤激酶(ALK)、髓过氧化物酶(MPO)、MyoD1 和Myoglobin 表达均呈阴性,Ki⁃67 抗原标记指数高达95%,最终确诊为间变性大细胞淋巴瘤。后转入肿瘤内科接受药物化疗,治疗方案为依托泊苷100 mg(第2 ~5 天)联合吉西他滨1.60 g(第1 天)静脉滴注,21 天为1 个周期,共治疗3 个周期。3 个周期化疗结束后,患者体温逐渐恢复正常,颜面部肿胀明显减轻,CT 显示肿瘤体积明显缩小(图1e),共住院40 天。出院后在当地医院继续予以依托泊苷联合吉西他滨治疗,剂量为依托泊苷100 mg(第2 ~5 天)和吉西他滨1.60 g(第1和8 天),21 天为1 个周期,共治疗5 个周期,无明显不良反应。上述治疗结束后,于2015 年5 月13 日调整药物化疗方案为吉西他滨1.60 g(第1 和8 天)联合顺铂30 mg(第2 ~5 天),21 天为1 个周期,共持续治疗2 个周期;并同步行适形调强放射治疗,靶剂量为2 Gy/次×25 次,总剂量50 Gy。治疗后CT 检查显示肿瘤控制满意,右侧岩骨可见混杂密度影,大小约2.70 cm×2.00 cm(图1f),建议门诊随访。该例患者末次随访时间为2019 年6 月14 日,无发热、复视,眼球活动自如,可正常工作,CT 提示右侧岩骨病灶同前,大小约2.80 cm×2.20 cm(图1g),目前仍在随访中。
例2 男性,23 岁。因颈枕部疼痛1 年余、声音嘶哑伴呼吸困难1 个月,于2014 年6 月5 日入院。患者1 年前无明显诱因出现颈枕部间断性疼痛并呈进行性加重,休息后症状无缓解,发病时无明显感觉运动异常;1 个月前无明显诱因出现声音嘶哑伴呼吸困难,偶有饮水呛咳,但无吞咽困难。既往在2011 年曾罹患中耳炎并治愈。入院后体格检查:咽后壁隆起,右侧软腭抬举无力,转颈无力,四肢肌张力降低。实验室检查无特异性指标。术前头部MRI显示,颈枕交界区占位性病变,侵犯斜坡、寰枢椎,向前突入咽部、向后突入枕大孔,延髓、上颈髓受压(图2a),增强后病灶呈明显不均匀强化(图2b)。临床诊断:斜坡颈枕交界区占位性病变。2014 年6 月13 日全身麻醉后行神经内镜下单纯经口腭入路斜坡颈枕交界区占位性病变切除术,术中可见肿瘤广泛侵犯咽后壁、下斜坡、寰枢椎,呈灰红色、质地不均,伴假包膜形成、瘤内间杂骨质,血供丰富,分块切除肿瘤后可见斜坡和颈椎硬膜完整。手术切除标本免疫组化染色显示,肿瘤细胞PCK、CK8、上皮膜抗原(EMA)和S⁃100 蛋白(S⁃100)表达呈强阳性,确诊为脊索瘤。术后患者声音略嘶哑,咳痰有力,无明显吞咽困难,偶有饮水呛咳;CT 显示肿瘤次全切除(图2c)。患者共住院25 天,出院后至当地医院接受放射治疗(具体方案不详)。出院后4 年8 个月(2019 年3 月30 日)随访时MRI 显示下斜坡、椎前占位性病变,大小约3.50 cm×2.10 cm,提示肿瘤复发(图2d),考虑到患者无明显临床症状,继续随访观察。末次随访时(2019 年10 月16 日)偶感颈部疼痛、吞咽异物感,无明显饮水呛咳、声音嘶哑;MRI 显示肿瘤大小同前,目前仍在随访中。

图1 例1 患者综合治疗前后头部CT 和MRI 及病理学检查所见 1a 术前横断面CT 显示,斜坡、右侧咽旁、岩尖混杂密度影(箭头所示),颅底骨质广泛破坏 1b术前横断面增强T1WI 显示病灶呈明显均匀强化,边界不清(箭头所示) 1c 组织学形态可见肿瘤细胞胞核大、深染,异型性明显 HE 染色 ×400 1d 免疫组化染色可见肿瘤细胞LCA 呈强阳性 EnVision 二步法 ×200 1e 3 个周期的药物化疗后横断面CT 显示肿瘤体积明显缩小(箭头所示) 1f 放化疗后横断面CT 显示右侧岩骨病变较前无进展 1g 末次随访时横断面CT 显示肿瘤大小大致同前Figure 1 CT, MRI findings and pathological examination of pre ⁃ and post ⁃comprehensive therapy in Case 1 Preoperative axial CT showed a heterogeneous density lesion extending towards clivus, parapharyngeal space and petrous apex(arrow indicates) with bone destruction (Panel 1a). Preoperative axial enhanced T1WI showed enhancement of lesion without clear borders (arrow indicates, Panel 1b). HE staining depicted hypercellular tumor exhibiting characteristics of conspicuous atypia.Tumor cells were prominent in nucleoli (Panel 1c). × 400 Immunohistochemistry was extremely positive for LCA (Panel 1d). EnVision ×200 Axial CT scans after 3 cycles of chemotherapy showed the tumor size was reduced (arrow indicates, Panel 1e). Axial CT after comprehensive therapy showed no disease progression (Panel 1f).There was no progression of tumor at the latest followed⁃up (Panel 1g).
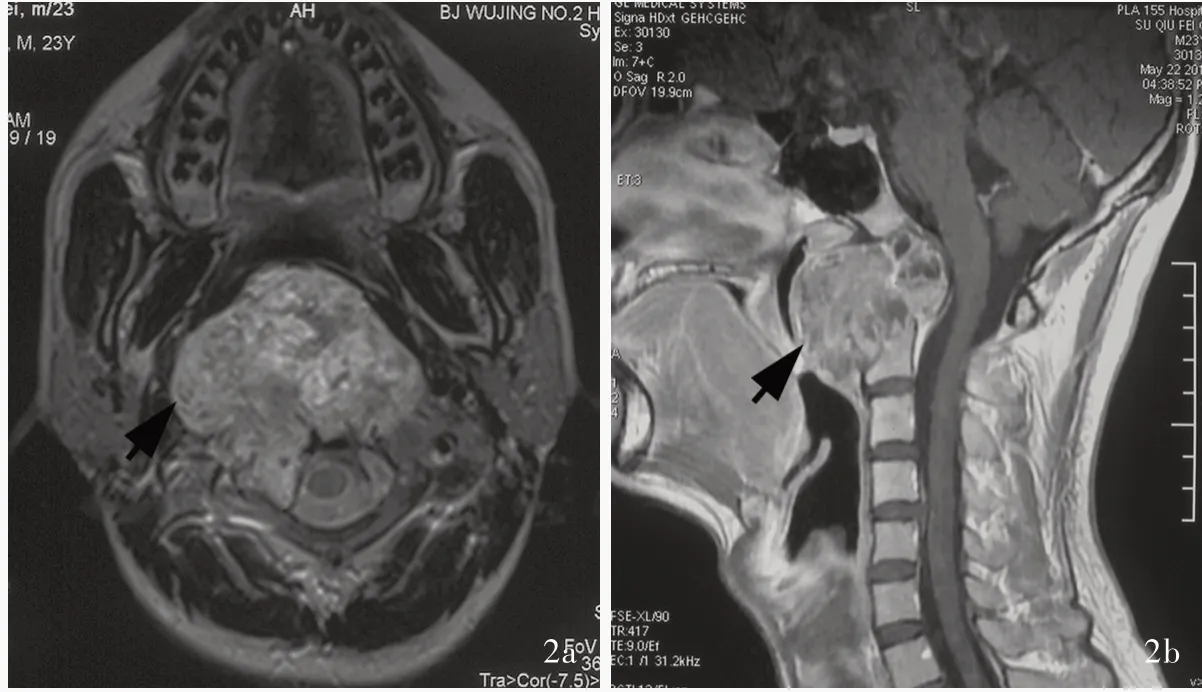

图2 例2 手术前后头部CT 和MRI 所见 2a 术前横断面T2WI 显示,下斜坡和颈枕交界区肿物,向外侧突至咽旁、向后突入椎管(箭头所示) 2b 矢状位增强T1WI 呈明显强化(箭头所示) 2c 术后CT 提示肿瘤次全切除(箭头所示,左图为横断面、右图为矢状位) 2d 出院后4 年余横断面增强T1WI 显示下斜坡占位性病变,提示局部复发(箭头所示)Figure 2 MRI and CT findings of pre ⁃ and post⁃operation in Case 2 Preoperative axial T2WI showed tumor occupied the craniocervical junction, invading lower clivus, parapharyngeal space, and grew into spinal canal (arrow indicates, Panel 2a). Sagittal enhanced T1WI showed lesion was intense enhanced (arrow indicates, Panel 2b). Postoperative axial and sagittal CT showed subtotal removal of tumor (arrows indicate,Panel 2c). Postoperative axial enhanced T1WI showed occupying lesion of lower clivus, and depicted a local recurrence(arrow indicates, Panel 2d).
例3 男性,22 岁。主因鼻腔肌纤维母细胞瘤术后20 天,于2011 年3 月4 日入院。患者3 个 月 前无明显诱因出现双眼视力急剧下降(具体视力不详),伴鼻塞,无鼻出血、头面部疼痛等症状,嗅觉改变不详等。当地医院经鼻内镜检查诊断为颅鼻交通性肿瘤,行鼻腔肿瘤切除术,术后病理诊断为肌纤维母细胞瘤。术后症状明显加重,遂予以适形调强放射治疗(2 Gy/次×15 次,总剂量30 Gy),肿瘤体积未见明显缩小,遂至我院就诊。1992 年曾有鼻部外伤史。入院后体格检查:嗅觉丧失;双眼失明,无光感,双侧瞳孔等大、等圆,直径约5 mm,对光反射消失,左眼内斜。实验室检查无特异性指标。头部MRI 显示呈鼻腔术后改变,肿瘤广泛侵犯前中颅底,向后破坏斜坡,增强后病灶呈明显均匀强化(图3a)。临床诊断为颅鼻交通性肌纤维母细胞瘤,遂于2011 年3 月14 日在全身麻醉下行Derome 入路颅鼻交通性肿瘤切除术,术中可见肿瘤呈灰红色、质地较韧,血供极为丰富,边界尚清晰,肿瘤大部可见假包膜形成,广泛侵犯鼻窦、眶内侧壁、前中颅底、鞍底,斜坡骨质破坏,前颅底嗅沟相邻硬脑膜受损,手术全切除肿瘤和受损的硬脑膜,切取颞肌筋膜修补硬脑膜缺损、切取带蒂额骨骨膜瓣翻转交叉贴覆于斜坡至前颅底术区(图3b,3c)。术后未发生并发症,组织形态学观察,肿瘤细胞呈明显多形性和瘤巨细胞,核分裂象多见,伴小灶坏死;免疫组化染色,肿瘤细胞CD68、平滑肌肌动蛋白(SMA)和Vim表 达 呈 强 阳 性,S⁃100 表 达 阳 性,PCK、CK18、Calponin、结蛋白(Des)、胶质纤维酸性蛋白(GFAP)和MyoD1 表达均呈阴性,Ki⁃67 抗原标记指数为40%,确诊为肌纤维母细胞瘤。MRI 显示肿瘤全切除(图3d)。患者共住院17 天,顺利出院。术后1 个月在我院放疗科行术区适形调强放射治疗,照射剂量为2 Gy/次×33 次,总剂量66 Gy。末次随访时(2015 年9 月24 日)生活能够自理,双眼视力明显恢复,眼球各向活动自如;MRI 和鼻内镜均未见肿瘤复发迹象。目前失访。
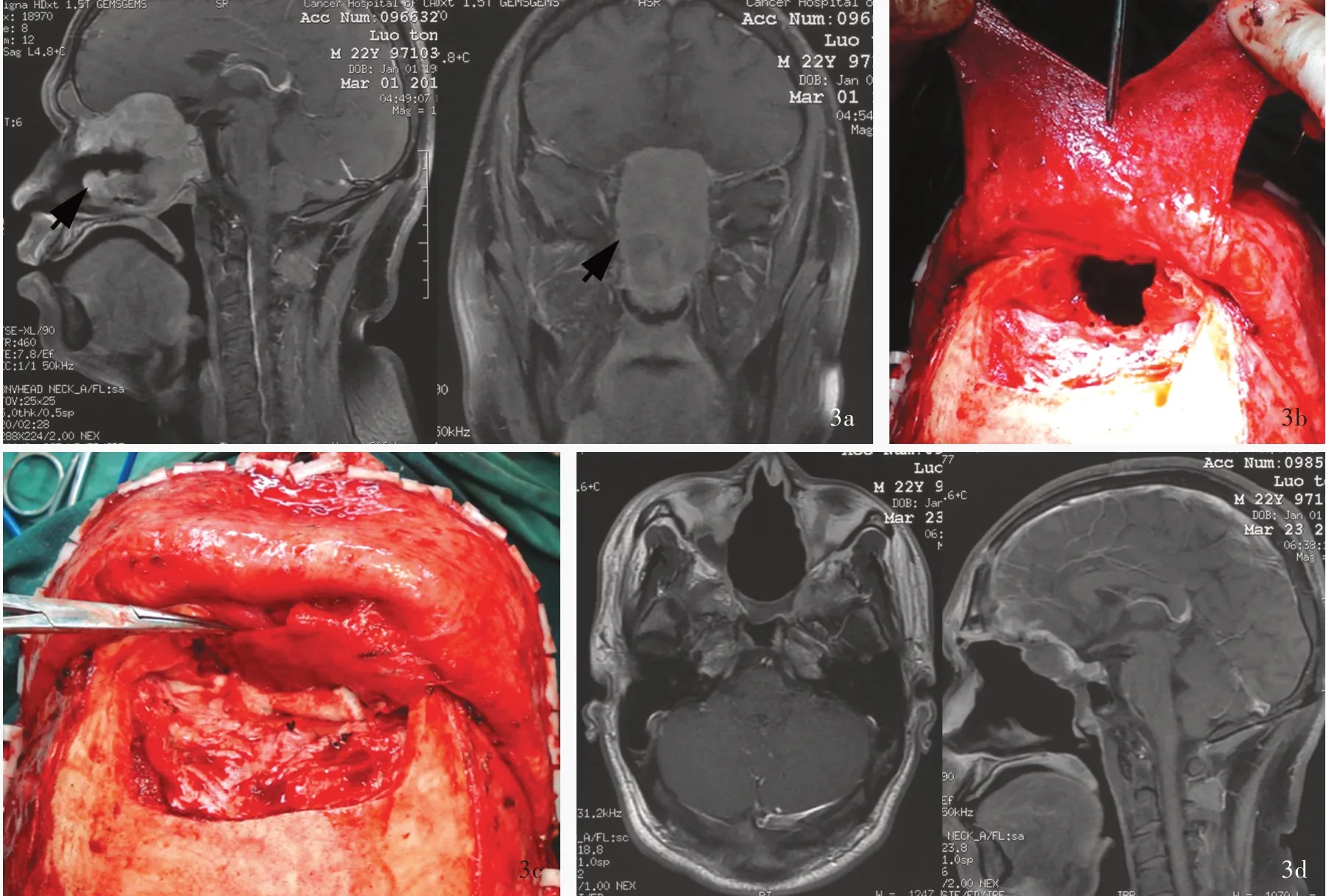
图3 例3 患者手术前后头部MRI 检查和术中所见 3a 术前增强T1WI 显示,鼻腔术后改变,肿瘤广泛侵犯前中颅底并破坏斜坡骨质,病灶呈明显均匀强化(箭头所示,左图为矢状位、右图为冠状位) 3b 手术全切除肿瘤后,制备带蒂额骨骨膜瓣并自中线剪开一分为二 3c 将带蒂额骨骨膜瓣交叉平铺贴覆于斜坡至前颅底术区,重建颅底 3d 术后增强T1WI显示肿瘤全切除(左图为横断面,右图为矢状位)Figure 3 MRI findings of pre⁃ and post⁃operation accompanied by intraoperative view in Case 3 Preoperative sagittal and coronal enhanced T1WI showed dense homogeneous enhancement of the lesion in the anterior and middle cranial fossa eroding the clivus (arrows indicate), accompanied by postoperative changes of nasal cavity (Panel 3a). Following radical resection of the tumor, the pedicled pericranial flap taken from the forehead was divided into two parts, one of which was reversed on top of the other (Panel 3b). The flaps were affixed to the anterior fossa to reconstruct the skull base (Panel 3c). Postoperative axial and sagittal enhanced T1WI showed total removal of tumor (Panel 3d).
例4 男性,40 岁。因鼻塞2 年,头痛伴左侧面部麻木1 个月,于2010 年11 月29 日入院。患 者2 年前无明显诱因出现双侧鼻塞,自觉鼻炎发作,无鼻出血、流涕等,1 个月前开始出现持续性头痛,发作时伴左侧面部麻木,口服镇痛药后症状可缓解,我院门诊行鼻咽镜组织活检术,组织形态学观察,纤维组织局部黏液样变性,其中可见胞质粉染和透亮细胞(图4a);免疫组化染色,肿瘤细胞Vim 和PCK(图4b)表达呈强阳性,S⁃100 表达阳性,EMA 和LCA均呈阴性,提示脊索瘤。遂收入院。既往史无特殊。入院后体格检查:双侧鼻腔粘连,咽后壁可见硬性肿物,左侧面部浅感觉减退。实验室检查无特异性指标。头部CT 显示鼻咽、斜坡占位性病变,呈等密度,颅底骨质破坏(图4c)。MRI 增强扫描可见肿瘤侵犯左侧咽旁、翼腭窝、颞底,病灶呈中等不均匀强化(图4d)。临床诊断为左侧颅底占位性病变,于2010 年12 月2 日在全身麻醉下行左上颌骨掀翻侧颅底肿瘤切除术,术中可见肿瘤呈结节状、灰白色、质地较韧,边界尚清晰,广泛侵犯鼻咽、蝶窦、斜坡、蝶骨大翼、海绵窦、颞下窝、翼腭窝、翼肌等,中颅底骨质广泛缺损,手术分块全切除肿瘤后可见颞底硬脑膜粗糙(图4e),广泛电凝,并行颅底重建和上颌骨复位内固定(图4f),术中未发生脑脊液鼻漏、术后未发生并发症,病理证实为脊索瘤。术后MRI显示肿瘤全切除(图4g),共住院10 天,顺利出院。术后1 个月在当地医院接受放射治疗30 次(具体剂量不详),出院后4 年4 个月(2015 年4 月7 日)随访时自诉饮水呛咳、声音嘶哑、咳痰无力等后组脑神经症状,MRI 检查考虑肿瘤复发,建议再次手术治疗,因经济原因放弃治疗,于2016 年3 月死亡。
讨 论
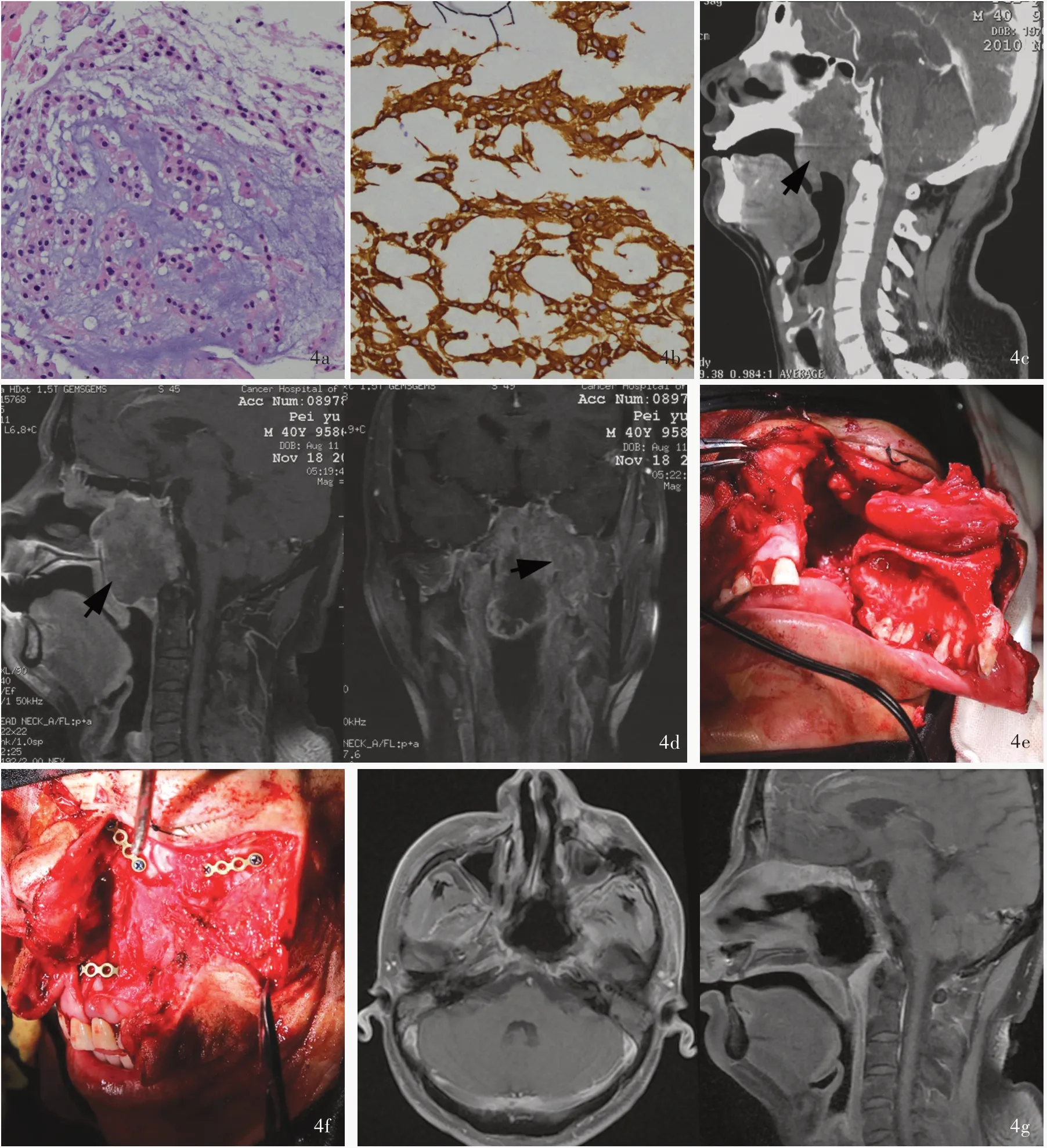
图4 例4 患者鼻咽镜组织活检、手术前后头部CT 和MRI 检查、术中所见 4a 组织学形态显示纤维组织局部黏液样变性,其中可见胞质疏松和透亮细胞 HE 染色 ×200 4b 免疫组化染色,肿瘤细胞PCK 呈强阳性 EnVision 二步法 ×200 4c 术前矢状位CT 显示,肿瘤侵犯斜坡、咽部等颅底区域,呈等密度,斜坡骨质破坏(箭头所示) 4d 术前增强T1WI 显示,肿瘤向侧方生长,侵犯左侧咽旁、翼腭窝、颞底,呈不均匀强化(箭头所示,左图为矢状位、右图为冠状位) 4e术中行上颌骨掀翻后充分显露并分块全切除肿瘤 4f 上颌骨复位内固定进行颅面修复 4g 术后增强T1WI 显示,肿瘤全切除(左图为横断面,右图为矢状位)Figure 4 Pathological presentation, CT and MRI findings of pre⁃ and post⁃operation, and intraoperative view in Case 4 HE staining demonstrated circumscribed myxoid change of fibrous tissue surrounding the tumor cells with loose cytoplasm (Panel 4a). ×200 Immunohistochemistry illustrated strong PCK expression (Panel 4b). EnVision ×200 Preoperative sagittal CT showed the homogeneous isodensity lesion with bone destruction located in the clivus and pharynx (arrow indicates, Panel 4c).Preoperative sagittal and coronal enhanced T1WI showed the inhomogeneous enhanced mass extending towards the lateral skull base including parapharyngeal space and pterygopalatine fossa (arrows indicate, Panel 4d). A Weber⁃Ferguson incision was given followed by osteotomies to expose and resect the tumor (Panel 4e). The swung maxillary bone was returned to original position and fixed to the rest of the facial skeleton (Panel 4f). Postoperative axial and sagittal enhanced T1WI showed total resection of the tumor (Panel 4g).
斜坡起自鞍背、后床突,向后下方延伸至枕骨大孔,因被诸多结构所阻挡,故斜坡病变在手术中的显露颇为困难;加之其周围重要神经血管众多,后方毗邻脑干和脊髓,疾病早期不易被检出,待患者就诊时大多已至疾病晚期、病灶体积巨大,使手术难度和风险明显增加。斜坡恶性肿瘤病理类型多样、起源复杂,可累及骨质、硬脑膜、神经、血管等颅底结构,不同病例治疗原则和手术入路各异[1⁃2],而且由于其预后不良,需多学科诊疗模式进行综合治疗[1,3⁃4]。
斜坡恶性肿瘤手术入路需结合肿瘤起源部位、质地、血供、受累范围,以及术前症状、术后治疗方案等因素综合考虑,应在保留神经血管功能的前提下,以最大限度安全切除肿瘤为原则。斜坡恶性肿瘤大多起源于硬膜外,因此手术入路主要采取经鼻、经口腭联合经口鼻、Derome、上颌骨掀翻、颞下等硬膜外入路。
经鼻入路可充分显露蝶窦、蝶鞍和中上斜坡,特别是可在神经内镜下实现近距离观察,主要适用于中上斜坡体积较小的病灶[2,4],术中可通过磨除鞍结节和蝶骨平台骨质扩大前颅底和鞍上显露范围,并可通过垂体移位和磨除后床突向斜坡后上方探查[5]。经鼻入路操作简单,在神经内镜下视野清晰、手术时间短、手术损伤小、并发症少,尤其适用于组织活检术[4],本组有11 例经组织活检术确诊的患者(淋巴瘤2 例、颅内转移瘤3 例、鼻咽鳞癌4 例、浆细胞瘤2 例),均选择手术损伤较小的经鼻入路(图1),术后及时接受放化疗等辅助治疗。笔者认为,对放化疗敏感的斜坡恶性肿瘤,外科手术治疗应以组织活检和减瘤为目的,减少对正常组织的破坏,利于术后施行综合治疗。然而,目前临床所应用的各种改良扩大经鼻入路仍存在术野深、操作空间狭窄所致病灶边缘显露困难的问题,故而难以实现En bloc切 除[2,6]。Kim 等[7]采 用 神 经 内 镜 下 经 鼻 入 路 手 术切除斜坡恶性肿瘤,肿瘤全切除率为66.67%,80.95%的患者病灶位于中上斜坡,其中肿瘤向侧方生长是无法达到手术全切除和预后不良的重要原因,而颈枕交界区特别是枢椎前方显露欠佳则是该入路不能达到肿瘤全切除的另一原因。本组选择经口腭联合口鼻入路手术的7 例患者均为脊索瘤,于神经内镜下显露下斜坡和高位颈椎前方(图2),但是由于硬腭的限制,对中上斜坡显露欠佳,4 例磨除部分硬腭骨质以扩大显露至中段斜坡,3 例经口鼻入路联合操作,手术切除效果较为满意。经口腭入路的主要缺陷是咽腔和术区缺损填塞修补困难,由于缺乏有效的硬性支撑,术后易出现手术切口迁延不愈、漏口形成等并发症,一般不适用于硬膜下病变[8]。
虽然斜坡恶性肿瘤大多起源于硬膜外,但可侵犯硬膜下区域,因此术前通过MRI 判断是否存在硬脑膜受累至关重要[9⁃10]。在MRI 上肿瘤与硬膜下区域间出现的短T2信号带通常为颅底硬脑膜,若显示不清则疑似肿瘤侵犯硬膜下[9];而增强MRI 显示的肿瘤周围脑实质强化伴水肿或软脑膜强化征象,特别是硬脑膜线性强化征且厚度>5 mm,高度提示肿瘤与硬膜内外相交通[10]。本组有16 例肿瘤与硬膜内外相交通患者均选择硬膜外入路,便于制备颞肌筋膜等自体材料进行颅底重建,并可以避免脑脊液鼻漏、颅内感染的发生,有利于术后尽早开展辅助治疗。
当肿瘤主要位于前颅底并侵犯斜坡前上方时,则以选择Derome 入路为宜,特别是病变广泛侵袭前颅底、中上鼻咽部、筛窦、蝶窦者[11]。Derome 入路术中显露范围较大,可贯彻无瘤原则,实现整块扩大切除;同时冠状开颅也提供了充足的带蒂组织瓣,使颅底重建简单可行,本组2 例颅鼻交通性肌纤维母细胞瘤患者即经Derome 入路全切除肿瘤(图3),由于经Derome 入路术中对额叶牵拉严重,有1 例患者术后出现精神症状,此为该入路的主要并发症。上颌骨翻转面部移位入路可在不牵拉脑组织的情况下充分显露蝶筛、鞍区、海绵窦、颅前窝底和颅中窝底、全斜坡、颞骨岩部和咽部等部位,利于呈侧方生长斜坡肿瘤的显露和整块切除,并可有效保护相邻重要神经血管[12]。本组5 例脊索瘤、1 例骨肉瘤、1 例肌纤维母细胞瘤、1 例鼻咽鳞癌和1 例纤维肉瘤患者均经上颌骨掀翻入路于直视下实现肿瘤全切除(图4),且无一例术后发生严重并发症。鉴于该入路手术操作步骤复杂,术中应注意:(1)勿剥离上颌骨前壁骨面面颊部软组织,以免影响上颌骨血运致术后发生骨坏死。(2)斜坡周围骨性结构破坏,向外侧分离时需注意保护海绵窦、颈内动脉、视神经等重要神经血管解剖结构。(3)严密修补硬脑膜缺损,可以游离自体阔筋膜进行缝合,将颅腔与鼻咽腔隔开。(4)若术区残腔较大,可以脂肪填塞,并移行鼻甲黏膜或颊脂垫覆盖显露的颈内动脉等重要结构。(5)如果颅底重建组织需求量较大,可向外侧直行延长外眦切口,切取额颞部带蒂帽状腱膜瓣翻转,经鼻根部或颞部皮下隧道导入颅底术区。(6)保证上颌骨复位对位良好以利于术后正常咬合[12]。颞下入路的手术适应证为,岩斜区特别是向侧方和幕下生长的斜坡肿瘤,磨除Kawase 四边形和部分岩尖骨质、结扎离断岩上窦可增加对下斜坡和颅后窝肿瘤的显露[13⁃14];术中解剖侧裂池、释放脑脊液可减少对颞叶的牵拉和损伤,也可于硬膜下分离进入脚间池和上斜坡[14];向颧弓下延伸切口尚可显露并切除向颞下窝生长的Fisch 分型“C”型肿瘤[15]。该入路的缺点是,磨除岩骨骨质可导致迷路开放而损伤听力。本组有3 例患者肿瘤向一侧斜坡旁、咽旁、颞下窝生长,选择颞下入路充分显露肿瘤,由于肿瘤侵犯颈内动脉壁,仅行次全切除术。
斜坡恶性肿瘤常侵犯周围骨质和颅底硬脑膜,术后残腔缺损较大,易发生脑脊液鼻漏、颅内感染等并发症,颅底重建过程中需注意以下问题:(1)硬脑膜力求水密缝合,采用人工硬膜、肌筋膜瓣、骨膜瓣多层修补后再以生物蛋白胶粘合固定,切取自身肌肉、筋膜或脂肪组织(颞肌、胸锁乳突肌、股前外侧阔筋膜、腹部皮下脂肪等)支撑填塞缺损残腔。(2)采用带蒂活组织瓣进行修复,与颅底残留骨质广泛接触。(3)对放化疗敏感的恶性肿瘤患者术后均需辅助治疗,对于此类患者我们推荐开颅手术,利于获取充足的带蒂活组织瓣进行颅底重建,这样可达到预防辅助治疗所诱发的颅底伤口迁延不愈的目的。(4)头面部皮肤组织缺损者,应转入头颈外科进行皮瓣移植修复[2,16]。本组31 例患者术中明确硬脑膜缺损脑脊液渗出后,即行筋膜、骨膜、肌肉组织等多层硬脑膜修复和颅底重建,并填塞术区消除残腔,术后14 例出现脑脊液鼻漏,其中12 例经腰大池置管引流治愈、2 例手术前后接受放射治疗的患者均预后不良。因此笔者认为,对于接受放化疗的患者或术后需尽快辅以放化疗的患者应行开颅手术,妥善进行颅底重建,避免脑脊液鼻漏等并发症而延误辅助治疗。
斜坡病变病理类型十分复杂,恶性肿瘤比例较高[1,4],主要包括脊索瘤、软骨肉瘤、颅内转移瘤等。脊索瘤和软骨肉瘤在影像学上难以鉴别,CT 均显示斜坡骨质破坏,肿瘤灶内呈散在分布的高密度影;MRI 则呈等或长T1、长T2信号,肿瘤灶内信号欠均匀,肿瘤边界清楚,增强扫描多呈不均匀强化[9,17]。但脊索瘤大多原发于斜坡中线区域,无明显钙化,可因瘤内出血或富含蛋白质而发生囊性变,表现为短T1信号[9⁃10,17];软骨肉瘤主要发生于斜坡中线旁区域,向侧方生长,瘤内可见斑片状钙化[9];斜坡转移瘤边界不甚清楚,可表现为短T2信号,增强扫描呈明显强化,PET 显像有助于鉴别和定位原发灶[9]。不同病理类型的斜坡恶性肿瘤治疗原则不尽相同,多学科诊疗模式尤为必要[3]。放疗科对鼻咽癌的治疗具有丰富的临床经验,肿瘤内科对淋巴瘤、浆细胞瘤、转移瘤等相对熟悉,多学科诊疗模式可以有效提高术前定性诊断的准确性,有利于合理选择组织活检术和根治性切除术的适应证。淋巴瘤、浆细胞瘤、转移瘤等对放化疗较为敏感,手术以获得病理诊断为目的;而对于脊索瘤、软骨肉瘤等低度恶性肿瘤,应以根治性切除为目的[18]。斜坡解剖结构复杂,肿瘤Ⅰ期根治性切除须采取神经外科与头颈外科联合手术,以提高手术全切除率和安全性。规范化的术后综合治疗有助于改善斜坡恶性肿瘤患者之预后[1,18]。根据美国国立综合癌症网(NCCN)指南[19],经病理证实的恶性肿瘤患者应接受三维适形或适形调强放射治疗;肿瘤残留患者应行立体定向放射外科(SRS)治疗(包括X 刀、伽马刀);术后肿瘤内科根据病理分型制定药物化疗方案,合理选择同步放化疗的适应证,并推荐患者接受基因检测以指导靶向治疗。
斜坡恶性肿瘤发生率较高,并非均以手术全切肿瘤为目的,应开展多学科诊疗模式进行规范化综合治疗。术前根据临床和影像学表现进行综合评估,明确手术目的、制定治疗方案、采取个体化手术入路,并有效进行颅底重建,术后及时开展辅助治疗,可以减少相关并发症的发生,提高治疗安全性,改善预后。
利益冲突无
