化学计量学二阶校正方法结合高效液相色谱用于蜂蜜中10种酚酸类物质的快速定量分析
2020-03-31张晓华吕敏明郑晶晶母淑婷刘攀华
张晓华, 吕敏明, 郑晶晶, 母淑婷, 刘攀华, 陈 征
(许昌学院食品与生物工程学院, 河南省食品安全生物标识快检技术重点实验室, 河南 许昌 461000)
蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物混合后,经充分酿造而成的天然甜物质[1-3],其主要成分有糖类、蛋白质、维生素、矿物质、酚酸、黄酮等物质。由于蜂蜜的来源不同,其成分也会有所差异,这些物质在给予蜂蜜良好风味的同时也赋予其较好的药理活性,是天然的营养品,具有抑菌、抗氧化、调节肠胃的功能,亦可治疗便秘、烧伤等病症,具有消炎润肺、止咳的作用,还可以用来预防肿瘤、治疗足廯等[2-8]。
近年来,蜂蜜因其具有抗氧化、抗衰老的功效而深受广大顾客的喜爱,国内外相关研究证明蜂蜜的抗氧化性能与其所含的多酚类物质有关。Al-Mamary等[9]测定了当地的5种来自不同种蜂蜜的总酚含量,结果显示,总酚含量越高,其抗氧化能力就越强。郭夏丽等[10]采用HPLC方法,分析了洋槐蜜、枣花蜜等7种蜂蜜中的23种多酚物质,并对其抗氧化性进行了研究。
蜂蜜中的多酚类物质主要包括酚酸和黄酮两大类。酚酸类物质是多酚的重要组成部分,是一种纯天然的绿色抗氧化剂,可以有效地阻止自由基对人体的损伤,是延缓人体衰老的天然“保健品”,大部分带有苯环、羟基和羧基官能团,化学结构相似,所以具有相似的物理化学性质,例如:色谱保留时间相近,紫外可见及荧光光谱相似等。受蜜源和一些环境因素(如土壤、季节、温度和气候)等的影响,不同种类、不同产地蜂蜜中酚酸类物质的含量有很大区别。所以,蜂蜜中酚酸类物质的含量可以作为区分蜂蜜种类和蜜源的有效方式[11]。但是,由于蜂蜜基质异常复杂,实现蜂蜜中多种酚酸类物质的定性定量分析具有很大的挑战。
近几年,多元校正技术,尤其是二阶或三阶校正方法的发展,可以很好地弥补上述方法的缺陷。它通过数学方法将重叠的谱图分辨为各个纯的分析物以及干扰物质的谱图,即所谓的“二阶优势”[12,13]。也就是说,在未知干扰共存的条件下,它可以利用“数学色谱”代替“普通色谱或质谱方法”,快速准确地实现感兴趣物质的定性和定量分析。目前,这种联合策略已在食品领域得到了广泛应用[14-20],本文利用高效液相色谱-二极管阵列检测器(HPLC-DAD)结合基于交替三线性分解算法(alternating trilinear decomposition, ATLD)的二阶校正方法,实现了蜂蜜中10种酚酸类物质的同时、快速定性和定量分析。分析物之间以及分析物与复杂背景中的干扰物质的色谱峰出现了严重的重叠。然而,基于“二阶优势”,使用ATLD算法可以分辨得到各个分析物的合理的色谱和光谱图以及准确的浓度预测。结果表明:利用数学方法使得各个分析物的色谱和光谱图与背景中的干扰物质得到了完全分离,且定量结果准确可靠。另外,本文还利用了统计与品质因子,包括灵敏度(SEN)、选择性(SEL)、预测均方根误差(RMSEP)、检出限(LOD)和定量限(LOQ),对所发展方法的预测性能进行了评估,结果令人满意。该方法具有简单、快速、精准等优点,可用于复杂基质中目标分析物的定量分析。
1 实验部分
1.1 仪器、试剂、材料与样品
Agilent 1260高效液相色谱仪,配DAD检测器(美国安捷伦公司); EFAA-DC24-RT防腐型24位氮吹仪(安谱实验科技股份有限公司); XW-80A涡旋混匀器;US6180DH数显加热型超声波(北京优晟公司); AE224J电子天平(上海舜宇恒平公司,精密度为十万分之一)。
3,4-二羟基苯甲酸(3,4-dihydroxybenzoic acid, 3,4-DA)、绿原酸(chlorogenic acid, CHA)、对香豆酸(p-coumaric acid,p-CA)、脱落酸(abscisic acid, AA)、对羟基苯甲酸(p-hydroxybenzoic acid,p-HA)、阿魏酸(ferulic acid, FA)、肉桂酸(cinnamic acid, CIA)、咖啡酸(caffeic acid, CA)和丁香酸(syringic acid, SA)标准品购于阿拉丁试剂,没食子酸(gallic acid, GA)标准品购于麦克林试剂公司。甲醇(色谱级)购于赛默飞世尔公司;甲酸(色谱级)购于阿拉丁试剂;果葡糖浆(亿倍香,上海好成公司);试验所用的高纯水为娃哈哈纯净水。
Poly-Sery HLB固相萃取柱(200 mg, 6 mL), Poly-Sery PSD固相萃取柱(250 mg, 6 mL), Poly-Sery Mixed anion exchange固相萃取柱(MAX, 150 mg, 6 mL), 3种固相萃取柱均购自安谱实验科技股份有限公司。
枣花蜂蜜(原味42°蜜,河南卓宇蜂业有限公司)。
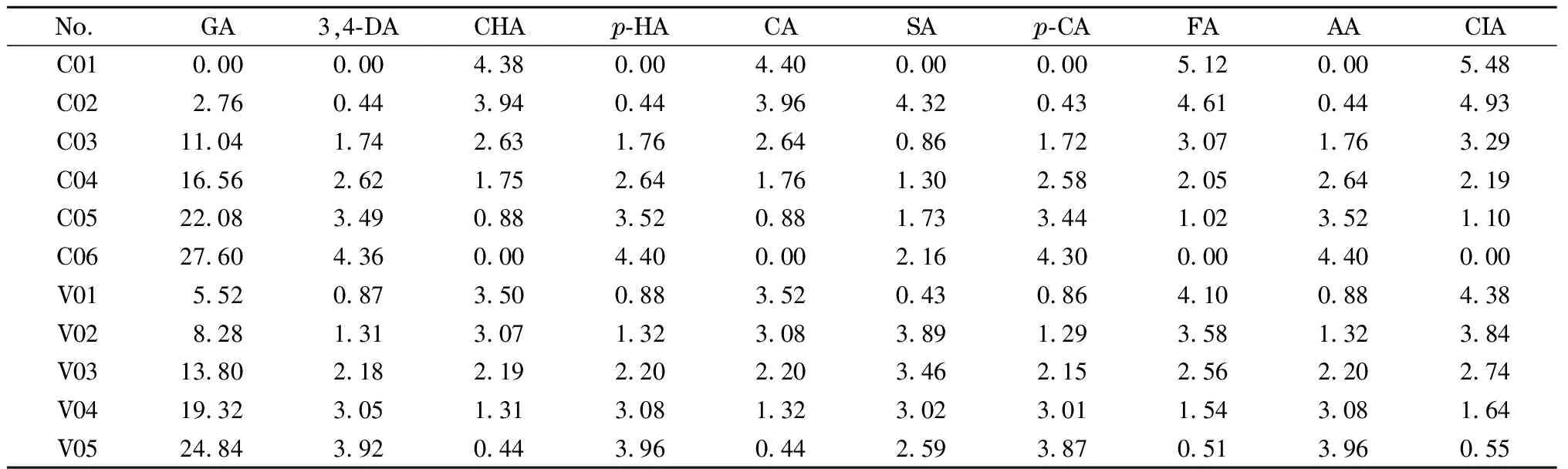
表 1 校正样与验证样中酚酸类物质的质量浓度
GA: gallic acid; 3,4-DA: 3,4-dihydroxybenzoic acid; CHA: chlorogenic acid;p-HA:p-hydroxybenzoic acid; CA: caffeic acid; SA: syringic acid;p-CA:p-coumaric acid; FA: ferulic acid; AA: abscisic acid; CIA: cinnamic acid. C01-C06: calibration sample 1-calibration sample 6. V01-V05: validation sample 1-validation sample 5.
1.2 溶液的配制
母液:将上述10种酚酸标准品各称取20.00 mg左右,分别放置于10个10 mL的棕色容量瓶,用甲醇定容,然后转移到10 mL的棕色样品瓶中,于4 ℃冰箱中保存。
工作液:根据各个分析物DAD响应的强弱,取不同体积母液稀释得到。没食子酸母液取1 000 μL, 3,4-二羟基苯甲酸、绿原酸、对香豆酸、脱落酸、对羟基苯甲酸、阿魏酸、肉桂酸、咖啡酸和丁香酸母液各取200 μL分别置于10 mL的容量瓶中,用酸化甲醇(含0.1%(v/v)的甲酸,下同)-酸化水(含0.1%(v/v)的甲酸,下同)(6∶4, v/v)混合溶液定容,得到10种酚酸物质的工作液,各工作液的浓度分别为:GA 0.28 g/L; 3,4-DA 0.044 g/L; CHA 0.044 g/L;p-CA 0.043 g/L; AA 0.044 g/L;p-HA 0.044 g/L; FA 0.051 g/L; CIA 0.055 g/L; CA 0.044 g/L; SA 0.043 g/L。
校正样:在每个10 mL的棕色容量瓶中加入不同体积(0.00、0.10、0.20、0.30、0.40、0.50、0.60、0.70、0.80、0.90、1.00 mL)的10种酚酸工作液,再由酸化甲醇-酸化水(6∶4, v/v)溶液定容。虽然本文涉及的目标分析物较多,但一方面本实验是采取分色谱子区间解析数据(每个区间最多只含有两个物质),另一方面化学计量学二阶校正可以使用“数学分离”方法增强“物理分离”,因此采用简单的交叉设计即可避免相似结构的分析物之间的相互干扰。另外,我们设计了5个不同浓度水平的验证样测试所发展方法的准确性,验证样的浓度均位于校正样范围之内,只包含10种多酚物质,不含其他干扰。校正样和验证样的具体质量浓度见表1。
模拟蜂蜜:采用在果葡糖浆中添加各个目标分析物的方法配制模拟蜂蜜。咖啡酸、对香豆酸、阿魏酸工作液各取2.50 mL,没食子酸、3,4-二羟基苯甲酸、绿原酸、脱落酸、对羟基苯甲酸、肉桂酸和丁香酸工作液各取1.60 mL于100 mL的容量瓶里,用果葡糖浆定容。涡旋混匀后,在40 ℃下超声20 min,待用。
蜂蜜实际样和加标样:称取2.50 g枣花蜂蜜用10 mL酸化水稀释,40 ℃下超声20 min混合均匀后,全部加入到处理好的固相萃取柱中进行前处理,共设置3个平行样品进行试验。为了进一步验证所提出方法的性能,我们设计了加标实验,在各个蜂蜜样本中添加不同浓度水平的分析物的标准溶液(添加咖啡酸、对香豆酸和阿魏酸的工作液各60 μL,添加其余工作液各40 μL)。加标蜂蜜样本中各个分析物的最终浓度在其浓度的线性范围内。注射到色谱系统之前每个加标样的处理方式和蜂蜜样本相同。
1.3 样品前处理
本实验使用HLB、PSD和MAX 3种SPE柱对样品进行前处理。
HLB和PSD的前处理:(1)使用甲醇和酸化水对SPE柱进行活化和平衡处理;(2)用酸化水稀释样品,并进行上样;(3)再用酸化水淋洗,抽干;(4)最后用甲醇洗脱,抽干;(5)在40 ℃下氮吹至干燥,然后用流动相定容至1 mL。
MAX的前处理:方法同HLB和PSD柱,只是使用高纯水替换上述处理过程中的酸化水。
1.4 色谱条件
色谱柱:Agilent Eclipse XDB-C18柱(250 mm×4.6 mm, 5 μm)。流动相A:高纯水(含0.1%甲酸);流动相B:甲醇(含0.1%甲酸);梯度洗脱程序:0~2.0 min, 25%B~35%B; 2.0~7.0 min, 35%B~40%B; 7.0~8.0 min, 40%B~55%B; 8.0~9.0 min, 55%B~65%B; 9.0~12.0 min, 65%B~100%B; 12.0~15.0 min, 100%B~25%B。进样量20 μL,柱温30 ℃,流速1.00 mL/min,分析时间15 min。检测波长为190~400 nm,每2 nm采集一个数据。
1.5 理论方法
通过DAD得到各个分析物的全光谱数据,每秒进行多次扫描,通过对多个样本的多次HPLC运行可以收集得到一个三维数阵。每个样本的每个数据点都是由两个参数构成:对应的保留时间和吸收波长。
每个样本经HPLC-DAD测量得到一个大小为I×J(保留时间×吸收波长)的矩阵数据。当将K个样本(包括校正样、蜂蜜样和蜂蜜加标样)得到的矩阵数据堆叠在一起,就得到一个大小为I×J×K的三维数据阵X,三维数阵的表达形式可以参考文献[14]。然后采用ATLD算法,把分析物的浓度与其光谱信号进行关联。ATLD是基于最小二乘原理的迭代算法,具有对组分数不敏感、收敛快速等优点。关于该算法详细的信息请参考文献[18],其程序由湖南大学化学生物传感与计量学国家重点实验室吴海龙教授提供。所有计算均在MATLAB环境中,在配有3.50 GHz Intel®Core (TM) i5-4690 CPU 8.00 GB内存并装有Windows 10操作系统的戴尔计算机上运行。
1.6 品质因子
本文还利用了统计与品质因子,包括SEN、SEL、RMSEP、LOD和LOQ,验证了实验方法的可靠性,相关统计与品质因子的表达式见公式(1~5)[21-23]。
(1)
(2)
LOD=3.3s(0)
(3)
LOQ=10s(0)
(4)
(5)
2 结果与讨论
2.1 色谱行为分析
图1a和1b是6个校正样和5个验证样在252 nm处扣除空白样品背景后得到的色谱图。从这两个图可以看出:无论是校正样还是验证样,10种酚酸物质的出峰位置都几乎相同,每个峰的形状也非常相似,无明显的色谱时间漂移。故本试验中采用的色谱条件是相对稳定的,能够满足三线性数据的要求。但是,10种分析物的色谱峰存在一定的重叠,尤其是咖啡酸和丁香酸,对香豆酸和阿魏酸,色谱峰重叠非常严重,无法直接使用传统的定量方法(利用峰面积或者峰高)进行定性定量分析。
图1c是校正样C04、实际样T01和加标样S01在252 nm处的色谱图。从图1c可以看出,蜂蜜中的干扰物很多,但10种酚酸物质的出峰位置基本没有变化,峰形也几乎未改变,未出现明显的色谱时间漂移现象。但是,蜂蜜背景复杂,许多种干扰物质和目标分析物出现共流出的情况,要实现目标分析物与背景中干扰物质的完全分离,需要非常长的分析时间,或者根本无法实现完全分离。然而,我们使用ATLD算法,利用“数学分离”的方法,在很短的时间(t<15.0 min)内就完成了10种目标物质的定量分析。
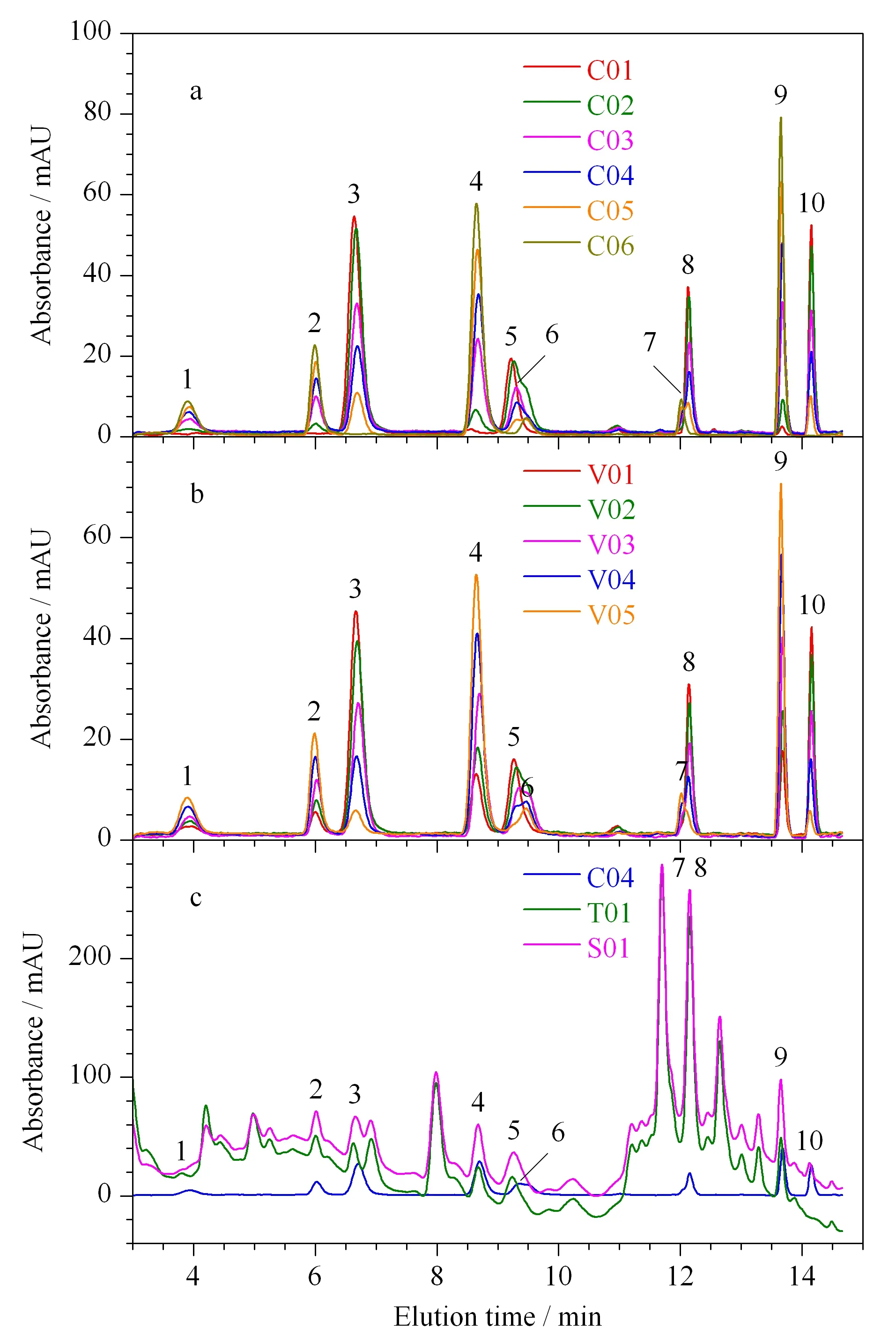
图1 (a)校正样、(b)验证样、(c)校正样C04、实际样T01和加标样S01在252 nm处的色谱图Fig. 1 Chromatograms for (a) calibration samples, (b) validation samples, and (c) a calibration sample (C04), a jujube flower honey sample (T01), and a spiked acacia honey sample (S01) at 252 nm Peak identifications: 1. gallic acid; 2. 3,4-dihydroxybenzoic acid; 3. chlorogenic acid; 4. p-hydroxybenzoic acid; 5. caffeic acid; 6. syringic acid; 7. p-coumaric acid; 8. ferulic acid; 9. abscisic acid; 10. cinnamic acid.
2.2 HPLC-DAD-ATLD方法性能的验证
在运用HPLC-DAD-ATLD方法进行实际样本分析之前,我们设计了5个不同浓度水平的验证样来测试所发展方法的准确性。这些验证样不含任何未知干扰,只含有10种目标分析物,其浓度均在校正样浓度范围之内。为了简化分析过程,依据分析物的保留时间和背景干扰的强弱,采取分区间的方式对所获得的色谱数据进行解析,共划分为8个区域,每个区域包含不同的分析物,r-1区~r-8区依次对应没食子酸、绿原酸、3, 4对羟基苯甲酸、对羟基苯甲酸、两种共流出组分咖啡酸和丁香酸、两种共流出组分阿魏酸和对香豆酸、脱落酸、肉桂酸。
验证样的分析结果如表2所示,在所研究的浓度范围之内,通过ATLD方法计算得到的目标分析物的理论质量浓度与其实际质量浓度呈现出非常好的线性关系,其线性相关系数范围为0.998 2~0.999 9,相关性良好,平均回收率为97.6%~101.1%。相关数据表明上述方法得到了令人满意的结果,也验证了ATLD方法在定性定量分析含有重叠峰的HPLC-DAD数据的可行性。

表 2 验证样中每个分析物的线性方程、相关系数和平均回收率(n=5)
y: the relative concentration values of each analyte in calibration samples;x: the nominal concentrations in calibration samples.
2.3 HPLC-DAD-ATLD方法用于模拟蜂蜜中10种酚酸类物质的定量检测
蜂蜜的背景基质非常复杂,是糖类的超饱和溶液,主要包括38%(质量分数)的果糖和31%(质量分数)的葡萄糖。在进行蜂蜜中酚酸类物质的定量分析之前,我们设计了模拟蜂蜜考察背景基质对所建立方法稳定性和准确性的影响。
用HLB、PSD和MAX这3种不同的SPE柱对模拟蜂蜜进行前处理,将经过前处理的模拟蜂蜜溶液经0.22 μm滤膜过滤后注入HPLC-DAD系统中进行数据采集。每种固相萃取柱做3次平行试验,取平均值作为该萃取柱的回收率,其结果见表3。
从表3可以看出,HLB柱回收率中没食子酸平均回收率最高,对香豆酸的平均回收率最低;PSD柱回收率中绿原酸平均回收率最高,没食子酸的平均回收率最低;MAX柱回收率中没食子酸平均回收率最高,绿原酸平均回收率最低。总体来看,HLB柱10种目标分析物的平均回收率为70.9%~102.2%; PSD柱10种目标分析物的平均回收率为55.7%~85.5%; MAX柱10种目标分析物的平均回收率为1.8%~102.1%,其中,绿原酸的平均回收率仅为1.8%。因此,HLB固相萃取柱的萃取效果较好,整体优于其他两种柱子,这是由3种固相萃取柱的组成以及吸附、解吸原理决定的。

表 3 模拟蜂蜜中10种酚酸类物质经3种固相萃取柱净化后的回收率(n=3)
2.4 HPLC-DAD-ATLD方法用于枣花蜂蜜中10种酚酸类物质的定量检测
由模拟蜂蜜的试验结果得出,3种固相萃取小柱中HLB的萃取效果最佳,因此用HLB固相萃取柱对枣花蜂蜜中的酚酸类物质进行提取。经固相萃取后由HPLC-DAD进行数据采集,对于每一个样本,可以得到保留时间-光谱二维矩阵数据。把不同样本叠加起来,可以得到一个三维数据阵,进而使用ATLD算法进行数据解析。基于ATLD算法得到枣花蜜中10种酚酸类物质的归一化色谱图见图2,光谱图见图3。可以看出,这10种分析物都存在一定程度的干扰现象,包括枣花蜜中的共流出干扰物质、基线漂移或者仪器噪声等。其中,没食子酸、咖啡酸、丁香酸、脱落酸以及肉桂酸受到的干扰物较多,没食子酸的光谱图中分析物与干扰物有部分重叠,对羟基苯甲酸的色谱图中有与分析物相近的干扰物质流出,脱落酸的光谱图中分析物与干扰物在检测波长196 nm左右出现大量重叠,肉桂酸的光谱图中分析物与部分干扰物几乎完全重叠。在这样干扰物种类繁多、干扰强度大的情况下,想使得目标分析物与干扰物完全分离需要相当长的分析时间,或者基本无法实现分离,但通过ATLD算法的数学分离功能,可以在15 min内对目标分析物进行定量分析,且结果基本令人满意。
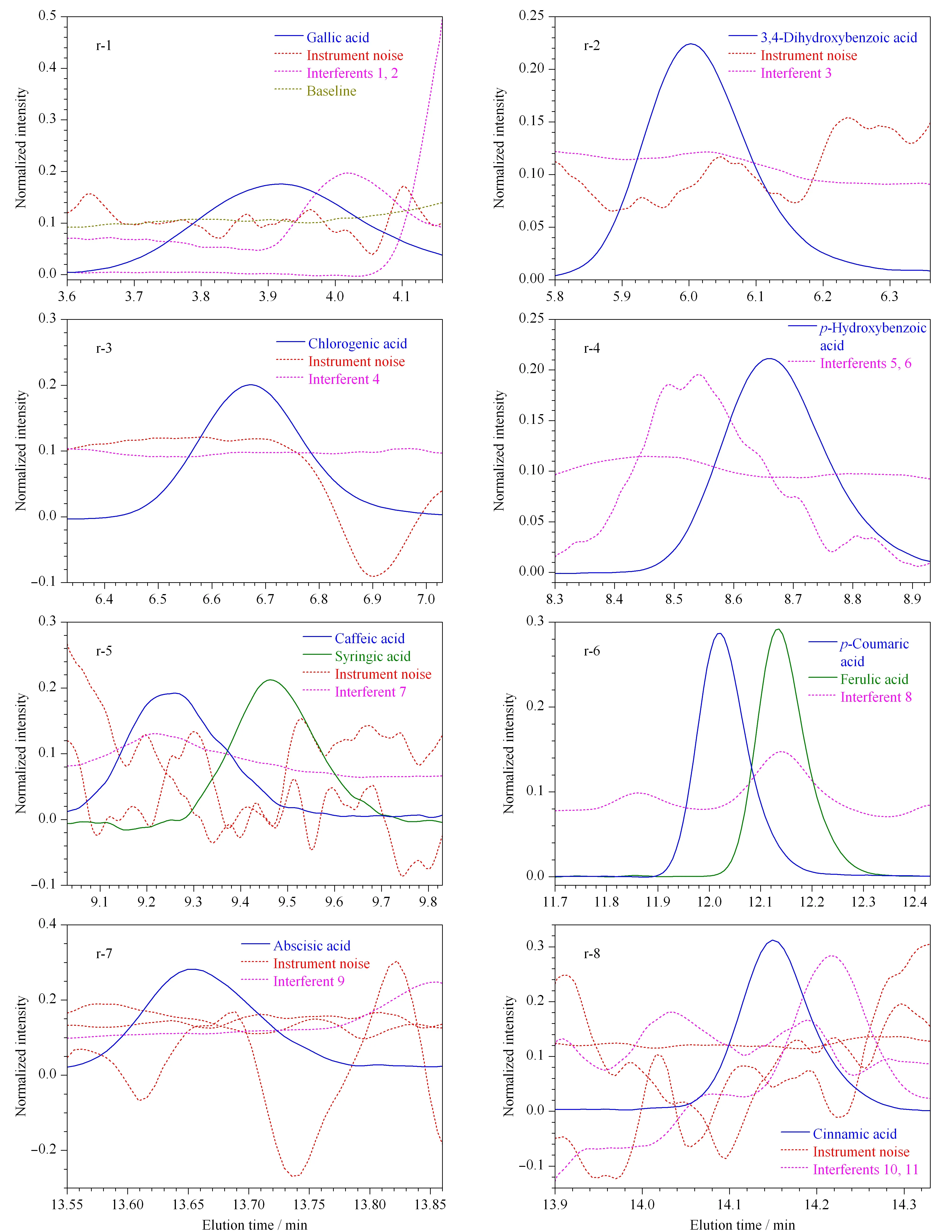
图2 基于HPLC-DAD-ATLD方法得到的枣花蜂蜜中10种分析物的归一化色谱图Fig. 2 Elution time profiles of the ten analytes in jujube flower honey samples based on the HPLC-DAD-ATLD methodAll plots were normalized to unit length in their regions (r-1-r-8).
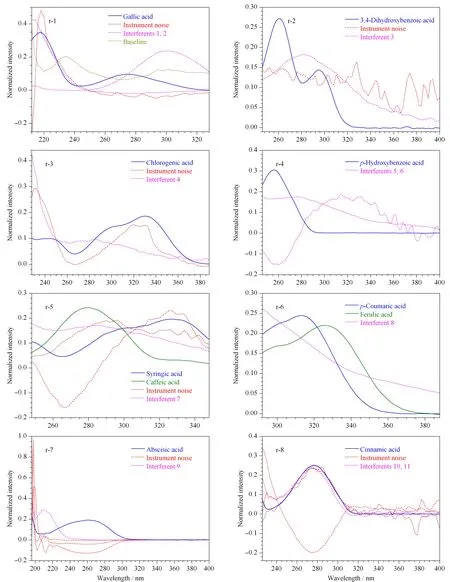
图3 基于HPLC-DAD-ATLD方法得到的枣花蜂蜜中10种分析物的归一化光谱图Fig. 3 Spectral profiles of the ten analytes in jujube flower honey samples based on the HPLC-DAD-ATLD methodAll plots were normalized to unit length in their regions (r-1-r-8).
对蜂蜜实际样品和加标样品分别做3次平行试验,取平均值计算枣花蜜中每种目标分析物的实际含量和加标回收率,其结果见表4。由表4中数据可以得出:该枣花蜂蜜中未检出绿原酸和肉桂酸,其余8种酚酸类物质都已检出,含量从高到低依次为3,4-二羟基苯甲酸13.14 μg/g、脱落酸11.51 μg/g、对羟基苯甲酸8.72 μg/g、对香豆酸3.47 μg/g、咖啡酸2.69 μg/g、没食子酸1.68 μg/g、阿魏酸1.58 μg/g、丁香酸1.10 μg/g。另外,蜂蜜中酚酸物质的加标回收率为62.1%~93.8%,其中,对羟基苯甲酸的加标回收率最高,对香豆酸的加标回收率最低,其原因可能有几个方面:(1)真蜂蜜成分复杂,干扰物较多,易受到其他成分的干扰;(2)不同的酚酸类物质由于物理、化学性质不同,对固相萃取柱的作用不同,或者难以吸附,或者难以洗脱;(3)分析物较多,固相萃取柱的容量有限;(4)该分析物本身紫外响应强度较低。
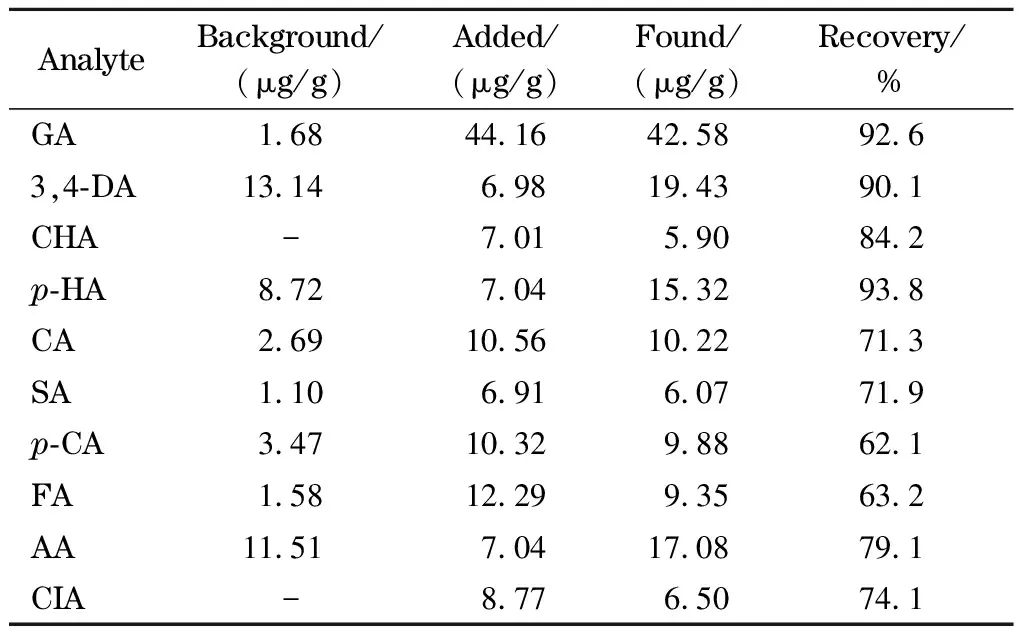
表 4 基于HPLC-DAD-ATLD方法得到的枣花蜜中10种分析物的定量结果及加标回收率(n=3)
-: not detected.
2.5 统计和品质因子验证
本文还利用统计与品质因子(包括SEN、SEL、RMSEP、LOD和LOQ)验证了实验方法的可靠性,结果见表5。
EN、SEL、RMSEP、LOD和LOQ的值对于研究的样品背景以及共存的其他组分(例如:在同一流出时间区域内出现的未知干扰物以及其他目标分析物)有很强的依赖性。由表5可知,相对于其他分析物,绿原酸和没食子酸的SEN值偏低,最主要的原因是在相同的浓度条件下,其紫外吸收响应偏弱。另外,在没食子酸和绿原酸的出峰范围内,蜂蜜基质中共流出干扰物质较多对其SEN也有一定的影响。但是,考虑到所研究样品目标分析物种类较多以及背景干扰物的复杂性,所得的分析结果令人满意。
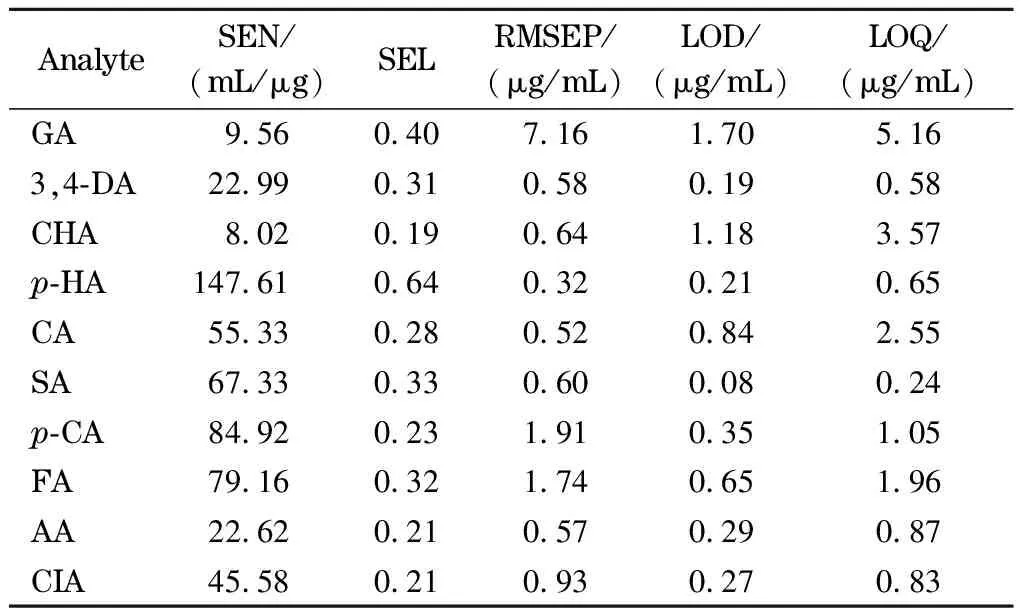
表 5 基于HPLC-DAD-ATLD方法各个分析物的品质因子计算结果
SEN: sensitivity; SEL: selectivity; RMSEP: root mean square error of prediction; LOD: limit of detection; LOQ: limit of quantitation.
3 结论
本文首先通过模拟蜂蜜试验,确定了固相萃取柱的种类及操作条件。然后在操作条件下,使用HLB固相萃取柱对蜂蜜进行了预处理,通过HPLC-DAD的数据采集,得到了保留时间-光谱-浓度三维数据阵。利用基于交替三线性分解算法的二阶校正方法对所得到的三维数阵进行解析,进而得到蜂蜜中10种酚酸类物质的定性定量结果。另外,本文还利用统计与品质因子(包括SEN、SEL、RMSEP、LOD和LOQ)验证了试验方法的可靠性,结果令人满意。该方法具有简单、快速、精准等优点,可用于复杂基质中目标分析物的定量分析。
