高湿贮藏对青花菜黄化和糖代谢的影响
2020-03-31赵紫迎贾雯茹左小霞金文渊郑永华
赵紫迎,贾雯茹,左小霞,金文渊,金 鹏,郑永华,
(1.南京农业大学食品科学技术学院,江苏 南京 210095;2.苏州大福外贸食品有限公司,江苏 苏州 215000)
青花菜又名西兰花、绿菜花,营养成分齐全且含量高,并具有抗氧化、预防癌症等功效[1-2],深受各国消费者喜爱。但青花菜水分质量分数达90%以上,采后在常温下2 d会出现开花黄化的迹象,6 d就会失水萎蔫,失去食用价值[3],影响青花菜的外观及内在品质,从而限制青花菜采后流通和产业发展,因此研究青花菜的贮藏保鲜技术有重要的现实意义[4]。
湿度是影响新鲜果蔬贮藏的环境因素,果蔬采后在低湿环境下贮藏时由于蒸腾作用极易失水,导致产品的萎蔫而失去商品性。薛彦斌等[5]研究了不同相对湿度(relative humidity,RH)对黄瓜、茄子和青椒等果菜类贮藏期间质量损失率和乙烯产生的影响,发现RH越低,质量损失率越高,乙烯生成量越多,贮藏期越短;王剑功[6]发现高湿(RH 90%~98%)贮藏可抑制大叶菠菜和油菜等蔬菜的质量损失,保持较高的感官评分和叶绿素含量。这些研究表明,较高环境湿度有利于果蔬品质的保持。但普通冷库中常达不到果蔬保鲜要求的湿度条件,采用传统的超声波和高压喷雾等加湿处理,由于其产生的水雾颗粒直径较大,在低温环境中极易产生结露凝水的现象,湿度控制的精度低,并起不到增湿的作用,同时会促进果蔬病原菌生长而增加腐烂的发生[7-8]。本研究采用的以色列HygroTech公司发明的干雾控湿高湿冷库,是通过减小加湿水雾颗粒的直径(2~10 μm)使水分直接蒸发到空气中而达到RH 95%~98%的高湿条件,同时可避免凝水结露,减轻果蔬的腐烂。杨奕辰[9]和孟祥春[10]等已采用该干雾控湿高湿冷库用于青菜、柑橘和番木瓜等果蔬的保鲜实验,发现干雾控湿高湿贮藏可有效抑制这些果蔬产品的蒸腾失水,延长贮藏期,因而在果蔬采后保鲜中具有较好的应用前景。但有关干雾控湿高湿贮藏对青花菜保鲜的作用尚鲜见研究报道。结合青花菜采后易失水萎蔫和黄化的特性,推测高湿贮藏对青花菜保鲜应该具有潜在的作用。为此,本实验研究了干雾控湿高湿冷库和普通冷库贮藏对青花菜贮藏期间质量损失、黄化、叶绿素和可溶性糖含量及其代谢相关酶活力变化的影响,以探索高湿贮藏对青花菜保鲜的作用,并从糖代谢的角度阐明其作用机理,以期为高湿贮藏在青花菜保鲜中的应用提供依据。
1 材料与方法
1.1 材料与试剂
挑选大小均匀、花球紧实、成熟度一致、无病虫害的‘山水’青花菜为实验材料,采收后覆冰降温,2 h内运回实验室。
乙腈(色谱纯) 国药集团化学试剂有限公司;石英砂、碳酸钙、盐酸、氯化镁(MgCl2)、抗坏血酸、乙二胺四乙酸钠(EDTA-Na2) 上海麦恪林生化科技有限公司;三羟甲基氨基甲烷(Tris)、交联聚乙烯吡咯烷酮(crosslinked polyvinylpyrrolidone,PVPP)、苯甲基磺酰氟(benzenesulfonyl fluoride,PMSF)北京索莱宝科技有限公司;尿苷二磷酸葡萄糖(uridine diphosphate glucose,UDPG)、果糖-6-磷酸(fructose-6-phosphate,F-6-P)、蔗糖、葡萄糖 上海源叶生物科技有限公司;甘油、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)、腺嘌呤核苷三磷酸(adenine nucleoside triphosphate,ATP)、6-磷酸-葡萄糖脱氢酶(6-phosphate-glucose dehydrogenase,G6PDH) 南京都莱生物技术有限公司;4-羟乙基哌嗪乙磺酸(4-hydroxyethyl piperazine ethanesulfonic acid,Hepes)、葡萄糖磷酸变位酶(glucose phosphomutase,PGM)、焦磷酸(inorganpyrophosphate,Ppi) 南京建成生物工程研究所;植物叶绿素酶检测试剂盒、植物脱镁螯合酶检测试剂盒 南京迈博生物科技有限公司。
1.2 仪器与设备
Hygrote湿度控制系统(配有电脑控制终端、湿度调节感应系统和果蔬贮藏库专用大口径5 mm干雾雾化器)以色列Hygrotech公司;RS-YS-W-A型GSP无线温湿度测点、RSWS-ETH-6型以太网温湿度记录仪 山东仁科测控技术有限公司;AWH-SA型电子桌秤 上海凡展衡器有限公司;V729型可见分光光度计 青岛聚创环保设备有限公司;2-16R型高速冷冻离心机 湖南恒诺仪器设备有限公司;1100型高效液相色谱 美国安捷伦公司;Shodex Sugar-D糖分析柱(250 mm×4.6 mm) 日本昭和电工集团;电热恒温水浴锅 精中科技有限公司;RT2140型家用防水触摸式电磁炉 美的集团。
1.3 方法
1.3.1 原料处理
将挑选后的青花菜随机分为两组,然后放入720 mm×515 mm×390 mm的塑料转运筐中,每组12 筐,每筐6 颗,分别置于(4.0±0.5)℃的干雾控湿高湿冷库(RH 95%~98%)(高湿组)和普通冷库中(RH 70%~75%)(低湿组)贮藏36 d,每隔6 d取青花菜花蕾用于各项指标分析测定。
1.3.2 指标的测定
1.3.2.1 质量损失率的测定
质量损失率采用称质量法测定,具体按公式(1)计算。
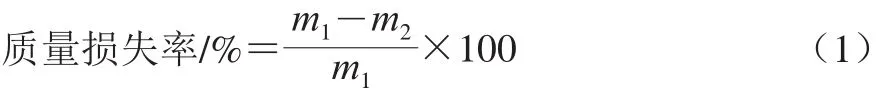
式中:m1为贮藏前的质量/g;m2为贮藏后的质量/g。
1.3.2.2 黄化指数的测定
黄化指数参考Ku等[11]的方法,并稍加修改,黄化级数标准见表1,黄化指数按式(2)计算。


表 1 青花菜黄化分级标准Table 1 Grading standards for the yellowing of postharvest broccoli
1.3.2.3 叶绿素a、叶绿素b和总叶绿素含量的测定
称取青花菜样品0.5 g,加入少量石英砂、碳酸钙和3~5 mL体积分数95%乙醇溶液,在研钵中充分研磨。用少量体积分数95%乙醇冲洗数次后,包括残渣一起倒入离心管中,用高速冷冻离心机12 000×g离心10 min后将上清液转至25 mL容量瓶中,用体积分数95%乙醇溶液定容,在649 nm和665 nm波长处测定吸光度。分别根据式(3)~(5)计算叶绿素a、叶绿素b的质量浓度、总叶绿素含量,然后转换成以干质量计的含量。

式中:ρa和ρb分别为叶绿素a和叶绿素b的质量浓度/(mg/L);CChl为总叶绿素含量/(mg/g);V为样品提取液总体积/mL;m为样品质量/g。
1.3.2.4 叶绿素酶和脱镁螯合酶活力的测定
粗酶液的提取:称取青花菜样品1 g,加入8 mL-20 ℃预冷的丙酮,在研钵中充分研磨,用高速冷冻离心机12 000×g离心10 min后去除上清液取沉淀,用-20 ℃预冷的丙酮洗脱,直至沉淀无绿色。取沉淀加入5 mL 5 mmol/L pH 7.0的磷酸缓冲液,在30 ℃下抽提30 min,用高速冷冻离心机在10 000×g离心10 min后取上清液用来测叶绿素酶和脱镁螯合酶活力。
叶绿素酶活力的测定使用植物叶绿素酶检测试剂盒进行,结果用U/μg表示;脱镁螯合酶活力的测定使用植物脱镁螯合酶酶联免疫吸附检测试剂盒进行,结果用mmol/g表示。
1.3.2.5 可溶性糖含量的测定
可溶性糖含量的测定使用高效液相色谱法。取2 g青花菜样品在10 mL、体积分数80%乙醇溶液中研磨成匀浆,在80 ℃水浴下提取1 h,然后用高速离心机12 000×g离心10 min后取上清液,上清液用0.45 μm纤维膜过滤后进行高效液相色谱分析。分析色谱柱为Sugar-D糖分析柱,检测器采用蒸发光散射检测器,进样体积为20 μL,柱温为40 ℃,流速为1 mL/min,流动相为体积分数75%的乙腈溶液,结果以干质量计,单位为mg/g。
1.3.2.6 蔗糖代谢相关酶活力的测定
蔗糖磷酸合酶(sucrose-phosphate synthase,SPS)和蔗糖酸性转化酶(sucrose acid invertase,SAI)活力的测定分别参照Hubbard[12]和Vargas[13]等的方法,稍加改动。称取1 g青花菜样品,加入6 mL提取液(含100 mmol/L pH 7.5 Tris-HCl、10 mmol/L MgCl2、10 mmol/L VC、2 mmol/L EDTA-Na2、3 g/100 mL PVPP、0.1 mmol/L PMSF),在低温条件下研磨成匀浆,转入10 mL离心管中,12 000 r/min离心20 min,取上清液测定酶活力。
SPS活力测定:反应体系为100 μL 0.05 mmol/L pH 7.5 Tris-NaOH、20 μL 50 mmol/L MgCl2、20 μL 100 mmol/L UDPG、20 μL 100 mmol/L F-6-P,酶反应液0.5 mL。在30 ℃条件下水浴30 min,加入2 mol/L NaOH溶液200 μL,沸水浴10 min,迅速冷却后加入0.1 g/100 mL苯酚0.5 mL和体积分数30%盐酸溶液1.5 mL,摇匀后在80 ℃条件下水浴10 min,冷却后于480 nm波长处测吸光度。
SAI活力测定:反应体系为0.1 mol/L pH 4.8醋酸缓冲液1 mL,0.1 mol/L蔗糖溶液0.5 mL,酶反应液0.5 mL。在37 ℃条件下水浴30 min,加入3.15 g/L 3,5-二硝基水杨酸溶液1.5 mL终止反应,沸水浴5 min,迅速冷却后于540 nm波长处测吸光度。
各酶活力以每毫克酶每秒内催化底物合成糖的质量表示。
1.3.2.7 己糖(葡萄糖和果糖)降解相关酶活力的测定
粗酶液的提取:称取1 g青花菜样品,加入6 mL提取液(50 mmol/L pH 6.8 Tris-HCl、5 mmol/L MgCl2、1 mmol/L EDTA、体积分数15%甘油),在低温条件下研磨成匀浆,转入10 mL离心管中,取上清液测定酶的活力。
葡萄糖激酶(glucokinase,GK)活力的测定参照Mustroph等[14]的方法:反应体系为0.1 mol/L pH 8.5 Tris-HCl 2 mL、5 mmol/L MgCl20.1 mL、0.6 mmol/L NAD 0.1 mL、2 mmol/L ATP 0.1 mL、2 U G6PDH 0.1 mL、酶反应液0.1 mL、10 mmol/L葡萄糖溶液0.1 mL。在30 ℃条件下水浴30 min,之后沸水浴5 min终止反应,冷却后于340 nm波长处测吸光度。
尿苷二磷酸葡萄糖焦磷酸化酶(UDP-glucose pyrophosphorylase,UGPase)活力的测定参照Sowokinos等[15]的方法。反应体系为80 mmol/L pH 7.8 Hepes 2 mL、5 mmol/L MgCl20.1 mL、0.6 mmol/L NAD 0.1 mL、1 mmol/L UDPG 0.1 mL、2 U G6PDH 0.1 mL、1 U PGM 0.1 mL、酶反应液0.1 mL、0.5 mmol/L Ppi 0.1 mL。在30 ℃条件下水浴30 min,之后沸水浴5 min终止反应,冷却后于340 nm波长处测吸光度。
GK与UGPase单位均为U/g。
1.3.2.8 蛋白质含量的测定
蛋白质含量的测定参照Bradford[16]的方法,以牛血清白蛋白为标准。
1.4 数据处理与分析
上述指标均取3 个平行样,作3 次重复测定。运用Microsoft Excel 2010和SAS 9.2软件对测定数据进行统计分析,OriginPro 8.5.1软件作图,用Duncan’s多重比较法进行差异显著性分析,P<0.05代表差异显著。
2 结果与分析
2.1 高湿贮藏对青花菜质量损失率和黄化指数的影响

图 1 高湿贮藏对青花菜质量损失率(A)与黄化指数(B)的影响Fig. 1 Effect of high RH storage on mass loss rate (A) and yellowing index (B) of postharvest broccoli
如图1A所示,低湿组青花菜质量损失率在贮藏期间迅速上升,贮藏36 d后质量损失率达到41.67%;而高湿组青花菜质量损失率上升缓慢,在整个贮藏期间质量损失率都显著低于低湿组(P<0.05),贮藏结束时的质量损失率仅为11.20%,因此高湿贮藏能够显著抑制采后青花菜水分的损失。与质量损失率的变化趋势相似,低湿组青花菜黄化指数在贮藏期间迅速上升,贮藏24 d后黄化指数显著高于高湿组(P<0.05),贮藏结束时高湿组青花菜的黄化指数仅为2.93,而低湿组黄化指数高达4.53(图1B),因此高湿贮藏能够抑制青花菜黄化的发生。这些结果表明,高湿贮藏能够保持采后青花菜较高的水分含量,延缓衰老黄化,从而保持其新鲜度和商品性。
2.2 高湿贮藏对青花菜叶绿素a、叶绿素b和总叶绿素含量的影响
如图2所示,在整个贮藏期间,总叶绿素、叶绿素a和叶绿素b的含量均呈一直下降的趋势,且高湿组叶绿素含量在整个贮藏期间均高于低湿组。贮藏结束时,低湿组青花菜的总叶绿素、叶绿素a和叶绿素b的含量分别比高湿贮藏组低33.31%、32.38%、34.76%,因此,高湿贮藏能够抑制青花菜叶绿素的降解,从而延缓黄化,保持其感官品质。

图 2 高湿贮藏对青花菜总叶绿素(A)、叶绿素a(B)和叶绿素b(C)含量的影响Fig. 2 Effect of high RH storage on total chlorophyll (A) , chlorophyll a (B)and chlorophyll b (C) contents of postharvest broccoli
2.3 高湿贮藏对青花菜叶绿素酶和脱镁螯合酶活力的影响
叶绿素酶和脱镁螯合酶是催化叶绿素降解的两个重要酶。如图3所示,青花菜贮藏过程中叶绿素酶活力呈下降趋势,而脱镁螯合酶活力呈缓慢上升趋势,在整个贮藏期间低湿组青花菜叶绿素酶和脱镁螯合酶活力都高于高湿组,且在贮藏结束时低湿组的叶绿素酶和脱镁螯合酶活力分别是高湿组的1.34 倍和1.38 倍。因此,高湿贮藏可以使青花菜维持较低的叶绿素酶和脱镁螯合酶活力,从而抑制叶绿素的降解,保持较高的叶绿素含量。


图 3 高湿贮藏对青花菜叶绿素酶(A)和脱镁螯合酶(B)活力的影响Fig. 3 Effect of high RH storage on chlorophyllase (A) and MDCase (B)activities of postharvest broccoli
2.4 高湿贮藏对青花菜可溶性糖含量的影响
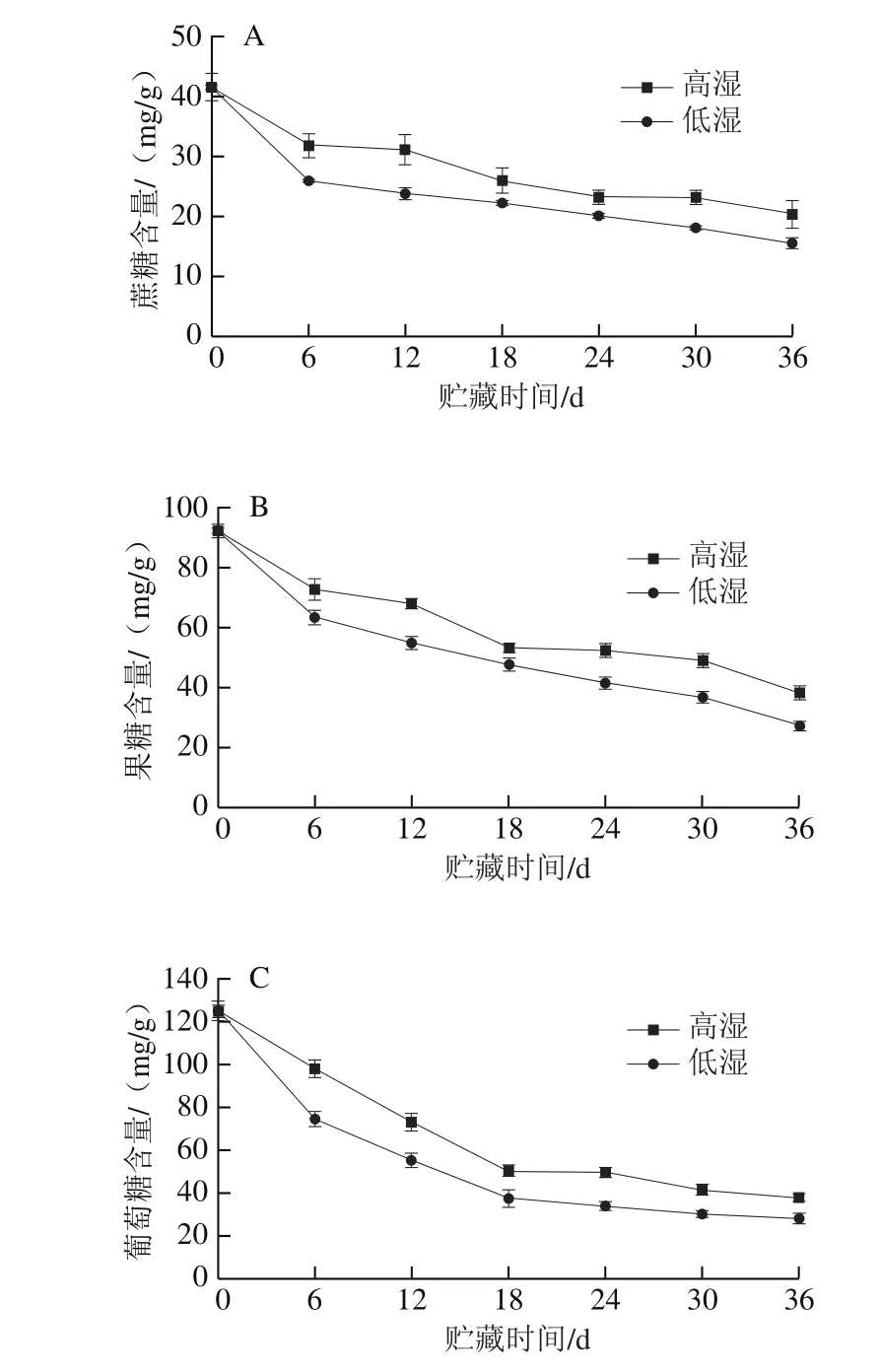
图 4 高湿贮藏对青花菜蔗糖(A)、果糖(B)和葡萄糖(C)含量的影响Fig. 4 Effect of high RH storage on sucrose (A) , fructose (B) and glucose (C) contents of postharvest broccoli
如图4所示,青花菜贮藏过程中蔗糖、果糖和葡萄糖含量均呈下降趋势,高湿贮藏可显著抑制这3 种可溶性糖含量的下降,至贮藏结束时,低湿组青花菜的蔗糖、果糖和葡萄糖含量分别比高湿贮藏组低23.95%、28.73%和25.57%。这些结果表明,高湿贮藏能够维持青花菜较高的可溶性糖含量。
2.5 高湿贮藏对青花菜SPS和SAI活力的影响
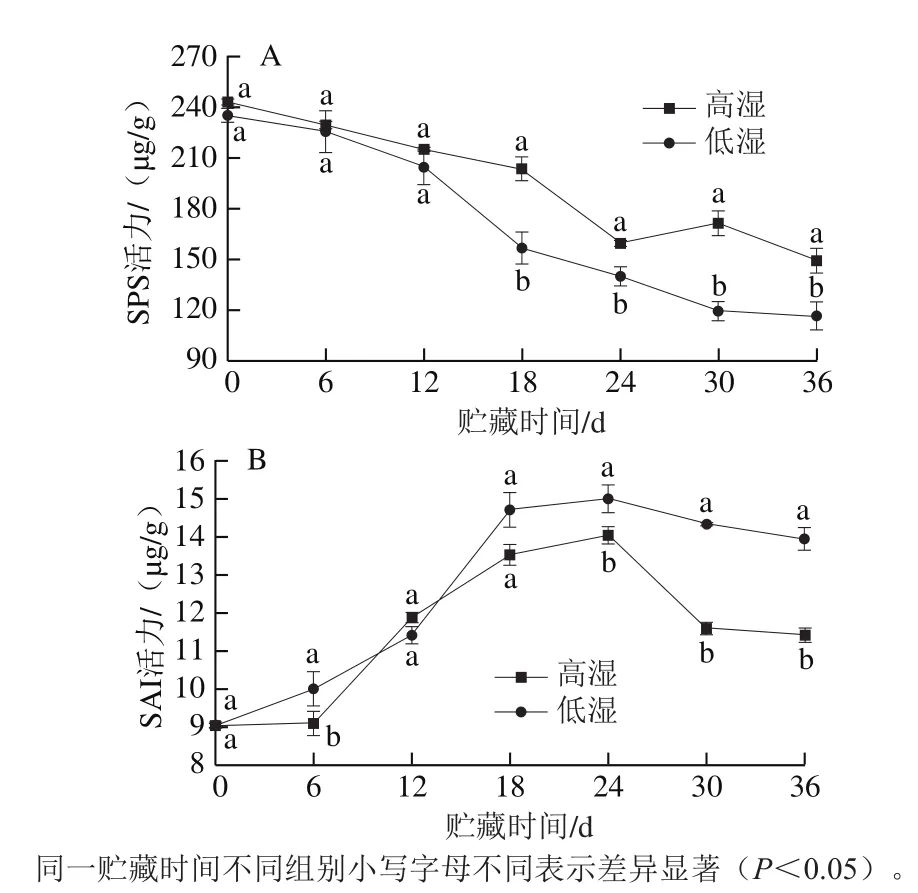
图 5 高湿贮藏对青花菜SPS(A)和SAI(B)活力的影响Fig. 5 Effect of high RH storage on SPS (A) and SAI (B) activities of postharvest broccoli
如图5A所示,青花菜贮藏过程中SPS活力呈下降趋势,高湿贮藏可延缓SPS活力的下降,贮藏18 d后SPS活力显著高于低湿组(P<0.05)。如图5B所示,高湿、低湿组青花菜的SAI活力均呈现先上升后下降的趋势,最高峰均出现在第24天,分别为14.1 μg/g和15.0 μg/g,并且在贮藏结束时,低湿组青花菜的SAI活力是高湿组的1.2 倍。因此,高湿贮藏能够保持青花菜较高的SPS活力和较低的SAI活力,即能够促进青花菜蔗糖的合成而抑制蔗糖的分解作用,从而保持较高的蔗糖含量。
2.6 高湿贮藏对青花菜GK和UGPase活力的影响
图 6 高湿贮藏对青花菜GK(A)和UGPase(B)活力的影响Fig. 6 Effect of high RH storage on GK (A) and UGPase (B) activities of postharvest broccoli
如图6A所示,两组青花菜的GK活力均呈现先升后降的趋势,并在第24天出现活力高峰,在整个贮藏期间高湿组青花菜GK活力始终低于低湿组,在贮藏结束时,低湿组青花菜的GK活力是高湿组的1.23 倍。如图6B所示,青花菜在贮藏期间UGPase活力呈逐渐上升的趋势,低湿组UGPase活力始终高于高湿组。这些结果表明,高湿贮藏能够保持青花菜较低的GK和UGPase活力,即能够抑制葡萄糖的分解,从而保持较高的葡萄糖含量。
3 讨 论
黄化是青花菜采后的衰老现象和限制其贮藏的主要问题,而叶绿素的降解是造成青花菜黄化的直接原因。叶绿素降解主要由发挥脱植基作用的叶绿素酶和催化卟啉环脱去Mg2+的脱镁螯合酶调控。本研究中干雾控湿高湿贮藏可明显降低叶绿素酶和脱镁螯合酶的活力,抑制叶绿素的降解,保持较高的叶绿素a、叶绿素b和总叶绿素的含量,从而延缓青花菜的黄化。这与杨奕辰[9]采用干雾控湿高湿贮藏抑制青菜叶绿素降解和关文强等[17]采用RH 85%~96%的高湿冰箱贮藏抑制青菜和西芹叶绿素降解的结果相似。由于干雾控湿高湿贮藏不仅可以解决目前普通冷库湿度偏低导致果蔬失水萎焉、增湿处理易凝露积水而增加腐烂发生等问题[10],同时与塑料薄膜包装[18]等保湿保鲜手段及1-甲基环丙烯(1-methylcyclopropen,1-MCP)[19]、6-苄氨基嘌呤[20]、乙醇[21]以及复合型乙烯吸收剂[22]等化学处理相比,具有绿色、环保等优点,因而在青花菜等果蔬采后保鲜中具有较好的应用前景。
可溶性糖不仅是植物的能量来源和渗透调节物质,还可作为信号分子调节相关基因的表达和酶活力,从而调节果蔬的成熟衰老[23]。Yang Xiaotang等[24]发现,采用150 mmol/L的外源葡萄糖和果糖处理可抑制香蕉皮中叶绿素降解酶基因的表达和酶活力,从而抑制叶绿素的降解。采用外源蔗糖[25]和葡萄糖[26]处理可延缓青花菜采后衰老黄化,从而延长保鲜期。而一些延缓青花菜采后衰老黄化的保鲜处理也都与其保持较高的可溶性糖含量的作用有关。如Perini等[27]发现50 ℃热水3 min浸泡处理可显著抑制青花菜叶绿素含量的下降,延缓其衰老黄化,同时保持较高的可溶性糖含量;采用2.5 μL/L 1-MCP处理也可保持较高的叶绿素和可溶性糖含量,延缓青花菜的衰老黄化[28]。采用光照处理可抑制叶绿素酶和脱镁螯合酶的活性,从而抑制叶绿素降解,延缓鲜切西兰花黄化,这与其诱导的可溶性糖,尤其是葡萄糖累积密切相关[29]。Hasperué等[30]研究发现,与早上采收的青花菜相比,傍晚采收的在采后贮藏中不易发生衰老黄化,这是因为白天光合作用使青花菜中积累较多的淀粉,其可以转化为可溶性糖,从而延缓其衰老黄化。本研究发现,采用RH 95%~98%的干雾控湿高湿贮藏可保持青花菜较高的蔗糖、果糖和葡萄糖含量,抑制其叶绿素的降解和黄化。这些结果表明,高湿贮藏可能通过维持较高的可溶性糖含量,从而延缓青花菜的黄化,但具体的作用机理有待深入研究。
蔗糖、果糖和葡萄糖是果蔬中可溶性糖存在的主要形式[31]。SPS和SAI是蔗糖代谢的两个关键酶,SPS参与蔗糖的合成,能不可逆地催化尿苷二磷酸葡萄糖和果糖-6-磷酸反应生成蔗糖-6-磷酸,蔗糖-6-磷酸水解后产生蔗糖[32];SAI是蔗糖转化酶的一种,其作用为催化细胞液泡中的蔗糖降解为果糖和葡萄糖[33],因此较高的SPS活力和较低的SAI活力有利于蔗糖的合成积累[32]。GK是4 种己糖激酶之一,能够催化葡萄糖磷酸化;UGPase可调节尿苷二磷酸葡萄糖的合成与降解[34],因此GK和UGPase的活力与己糖含量密切相关。有研究发现用蔗糖、葡萄糖[35]和1-MCP[28]处理可保持青花菜较高的SPS活力,降低SAI、GK和UGPase活力,从而保持较高的蔗糖、果糖和葡萄糖等可溶性糖含量,同时抑制叶绿素含量的下降和黄化。本实验中,高湿贮藏也保持了青花菜中较高SPS活力和较低的SAI、GK和UGPase活力,同时保持了较高的蔗糖、果糖和葡萄糖等可溶性糖含量,抑制了叶绿素的降解和衰老黄化。这些结果表明,高湿贮藏可能通过调控糖代谢相关酶活力维持较高的可溶性糖含量,从而延缓青花菜的黄化。
4 结 论
与低湿贮藏相比,高湿贮藏可显著抑制青花菜的蒸腾失水,抑制叶绿素酶和脱镁螯合酶的活力,维持较高的叶绿素a、叶绿素b和总叶绿素含量,延缓青花菜的黄化;还可提高SPS的活力,降低SAI、GK和UGPase的活力,维持较高的可溶性糖含量,从而延缓青花菜的衰老黄化。
