桑叶生物碱对D-半乳糖诱导小鼠生物大分子氧化损伤的改善作用及机理
2020-03-31杨忠敏王祖文黄先智丁晓雯
杨忠敏,王祖文,黄先智,丁晓雯,
(1.西南大学食品科学学院,重庆市农产品加工重点实验室,食品科学与工程国家级实验教学示范中心,重庆 400716;2.西南大学科技处,重庆 400716)
生物大分子主要包括脂质、DNA、蛋白质等,是构成生命的基础物质,与生命活动息息相关[1]。自由基是机体在正常代谢过程中产生的具有高度活性及强氧化性的活性氧簇和活性氮簇。在正常情况下自由基的产生及清除处于动态平衡,若某些原因导致清除其能力下降或产生增加,打破抗氧化防御机制平衡状态,机体就会发生氧化应激[2]。氧化应激状态下自由基会攻击机体内的生物大分子,使之发生氧化变性、交联和断裂,进而破坏细胞结构和功能,可能会导致癌症、心血管疾病、脑功能紊乱等疾病的发生或发展[3-4]。而抗氧化剂能中和自由基,清除氧化剂或防止氧化剂转变为毒性更强的化合物,减缓或抑制细胞损伤,从而达到抗氧化作用[5]。因此,寻找能阻止生物大分子氧化损伤的有效抗氧化剂,对维护机体健康及预防控制相关疾病的发生或发展具有重要意义。
桑叶中生物碱类化合物是糖环上的氧原子被氮原子取代的一系列多羟基生物碱,以1-脱氧野尻霉素(1-deoxynojirimycin,DNJ)为代表,为高效的糖苷酶抑制剂,能显著抑制餐后血糖浓度的上升,具有抗病毒、降糖、降脂等多种生物活性[6-7]。已有研究表明,DNJ能显著降低罗非鱼与糖尿病小鼠血清中丙二醛(malondialdehyde,MDA)的含量[8-9]。本实验室前期的研究表明,桑叶生物碱粗提液可以有效降低高脂饮食小鼠MDA水平,显著提高抗氧化酶活力[10]。目前桑叶生物碱对生物大分子氧化应激作用影响的研究主要集中在改善脂质氧化方面,而其对DNA、蛋白质氧化损伤的影响在国内外鲜有相关报道。因此,本研究以D-半乳糖(D-galactose,D-Gal)诱导昆明种小鼠建立氧化应激模型,以目前常用的抗氧化药物还原型谷胱甘肽(glutathione,GSH)作为阳性对照,通过比较评价各组小鼠基本生理指标,脂质、DNA、蛋白质氧化损伤和抗氧化指标的变化,探讨桑叶生物碱对氧化应激小鼠生物大分子氧化损伤的作用及机理,以期为桑叶生物碱抗氧化功能性食品的开发提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性昆明种小鼠60 只(体质量18~20 g),4 周龄,购自重庆医科大学实验动物中心(生产许可证号:SCXK(渝)2018-0003)。基础饲料,购于重庆医科大学实验动物中心。
桑叶粉末 重庆市蚕业科学技术研究院;D-Gal(纯度≥99%)、GSH(纯度≥98%) 上海阿拉丁有限公司;8-异前列腺素F2α(8-iso-prostaglandin F2α,8-iso-PGF2α)、蛋白羰基(protein carbonyl,PCO)、晚期蛋白氧化产物(advanced oxidation protein products,AOPP)、3-硝基络氨酸(3-nitrotyrosine,3-NT)、8-羟基鸟嘌呤(8-hydroxy-2’-desoxyguanosine,8-OH-dG)、5-羟基胞嘧啶(5-hydroxy-2’-deoxycotosine,5-OH-dC)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、金属硫蛋白(metallothionein,MT)、硫氧还蛋白(thioredoxin,Trx)、总抗氧化能力(total antioxidant capability,TAC)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 厦门慧嘉生物科技有限公司;总超氧化物歧化酶(total superoxide dismutase,T-SOD)测定试剂盒 南京建成生物工程研究所。其他试剂均国产分析纯。
1.2 仪器与设备
Symergy H1酶标仪 基因有限公司;RE52CS-1旋转蒸发仪 上海亚荣生化仪器厂;811DK高速冷冻离心机 德国Eppendorf公司;KQ5200DB超声波清洗仪昆山市超声仪器有限公司。
1.3 方法
1.3.1 桑叶生物碱制备
称取桑叶粉,按料液比1∶30(m/V),于60 ℃、功率800 W条件下超声处理60 min,重复提取2 次,合并滤液,减压浓缩;将浓缩液以2.1 BV/h流速过D101大孔树脂;再将过D101的纯化液以2.5 BV/h流速过732型阳离子树脂,先用蒸馏水洗至中性,再用0.5 mol/L氨水洗以2 倍柱体积洗脱得到氨水洗脱液;再将氨水洗脱液以2.1 BV/h流速过AB-8大孔树脂,真空冷冻干燥得样品[11-12]。采用硅钨酸沉淀法测的本实验所制桑叶生物碱中总生物碱的含量为93.57%。
1.3.2 桑叶生物碱改善氧化损伤的作用研究
1.3.2.1 小鼠饲养条件
小鼠按照西南大学实验动物保护和使用规则饲养,室温(21±2)℃,相对湿度40%~60%,整个实验期间室内通风条件良好,12 h明暗交替(9∶00~21∶00),所有小鼠均喂饲普通饲料,自由觅食、饮水。
1.3.2.2 D-Gal诱导小鼠氧化应激模型的建立
60 只雄性SPF级昆明种小鼠,适应环境饲养7 d后。随机分出10 只小鼠为正常对照组,腹腔注射与造模试剂等体积的生理盐水;其余小鼠腹腔注射D-Gal(1 000 mg/kg mb),连续注射20 d后,颌下采血,测定造模组、正常对照组小鼠血清中MDA、SOD水平是否存在显著性差异,若存在显著性差异即判断小鼠造模成功,用于后期实验。
1.3.2.3 分组与给药
保留10 只正常对照组小鼠,另挑造模成功小鼠50 只,随机均分为模型对照组、阳性药物组(灌胃200 mg/kg mbGSH)以及低、中、高剂量组(分别灌胃50、100、200 mg/kg mb桑叶生物碱,桑叶生物碱剂量根据前期预实验所确定)。实验期间,小鼠每天称体质量1 次,并根据体质量变化按照0.1 mL/10 g mb每天灌胃1 次,连续4 周。
1.3.2.4 血浆样本采集
4 周实验结束后,各实验组小鼠禁食不禁水12 h,摘取小鼠眼球取血,用肝素钠采血管收集血液,于4 ℃、3 000 r/min离心15 min,即为血浆,于-80 ℃保存备用。
1.3.2.5 相关指标测定
小鼠每天称体质量1 次,根据体质量以调整给药量。实验期4 周,每隔2 d称量小鼠的摄食量。按照下式计算食物利用率。
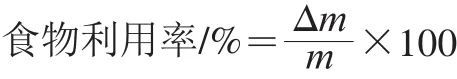
式中:Δm为同期内体质量的增量/g;m为同期内的摄食量/g。
血浆中8-iso-PGF2α、PCO、AOPP、3-NT、8-OH-dG、5-OH-dC的水平,抗氧化酶系统中SOD、GSH-Px活力,非酶抗氧化系统中非酶抗氧化剂MT、Trx含量及TAC的检测,均按照试剂盒说明书进行操作。
1.4 数据统计分析
数据均用SPSS 20.0统计软件进行处理,用单因素方差分析及多重比较进行显著性差异分析,实验结果以±s表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 桑叶生物碱对小鼠体质量、摄食量和食物利用率的影响
小鼠体质量的增长情况是反映其生长发育是否正常的重要指标之一,摄食量和食物利用率是影响小鼠体质量变化的关键因素。
由图1A、B可知,在整个实验期间,各组小鼠体质量、摄食量均呈现增加趋势。在造模成功时(0 周),与正常对照组相比,其余5 组体质量、摄食量与其均存在极显著性差异(P<0.01),造模组之间小鼠体质量、摄食量均无显著性差异(P>0.05),表明氧化应激会使小鼠体质量、摄食量下降。4 周实验结束时,模型对照组体质量、摄食量较正常对照组减少23.37%、25.30%(P<0.01),阳性药物组以及桑叶生物碱中、高剂量组体质量是模型对照组的1.71、1.12、1.16 倍(P<0.05),摄食量是模型对照组的1.25、1.18、1.22 倍(P<0.05)。结果表明,桑叶生物碱通过增加小鼠摄食量来有效缓解小鼠体质量减轻症状。
由图1C可知,与正常对照组相比,模型对照组小鼠食物利用率下降了44.15%(P<0.01)。阳性药物组、桑叶生物碱中、高剂量组分别是模型对照组的1.52、1.45、1.50 倍(P<0.05)。结果表明,桑叶生物碱调节小鼠食物利用率情况与其体质量变化一致。
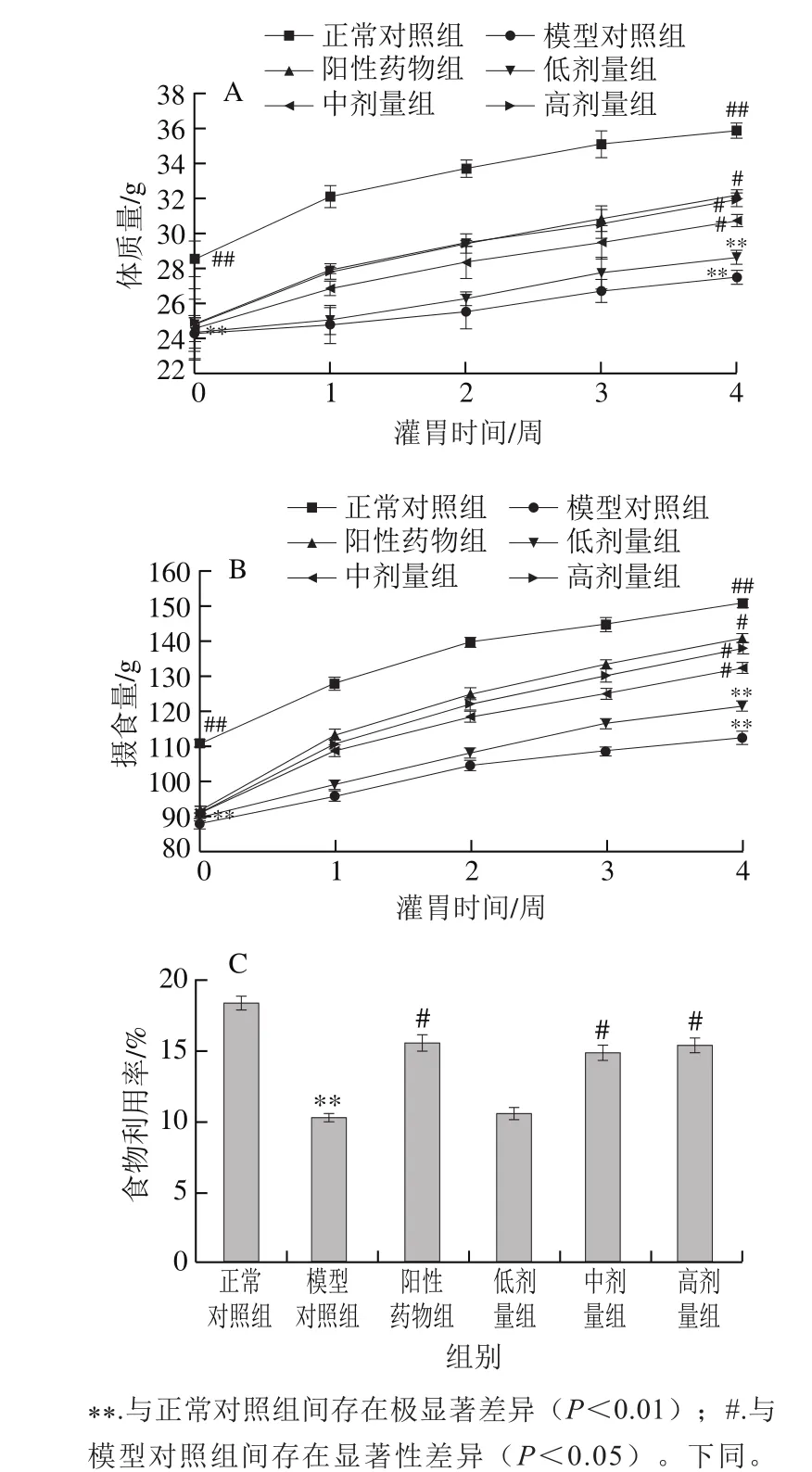
图 1 桑叶生物碱对D-Gal诱导小鼠体质量(A)、摄食量(B)和食物利用率(C)的影响(n=10)Fig. 1 Effect of mulberry leaf alkaloids on body mass (A), food intake (B)and food utilization (C) in mice with D-Gal-induced injury (n = 10)
2.2 桑叶生物碱对小鼠生物大分子氧化损伤的影响
2.2.1 桑叶生物碱对小鼠脂质氧化损伤的影响
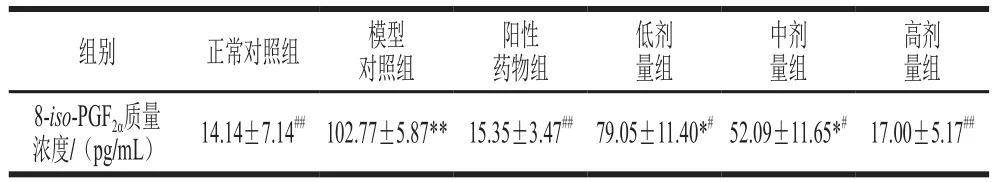
表 1 桑叶生物碱对D-Gal诱导小鼠血浆中8-iso-PGF2α的影响(n=10)Table 1 Effect of mulberry leaf alkaloids on 8-iso- PGF2α level in plasma of mice with D-Gal-induced injury (n= 10)
8-iso-PGF2α广泛存在于体液和各种组织中,其合成和释放持续稳定,含量不受饮食中脂质和药物等因素影响,被认为是测定体内脂质过氧化及氧化应激的金指标和评价抗氧化疗效的最理想的生化指标[13-14]。
由表1可知,与正常对照组相比,模型对照组8-iso-PGF2α水平极显著增加了626.80%(P<0.01),表明模型对照组小鼠发生脂质氧化损伤。与模型对照组相比,桑叶生物碱低、中剂量组8-iso-PGF2α水平分别显著减少了23.08%、49.31%;阳性药物组、桑叶生物碱高剂量组分别极显著减少了85.06%、83.46%(P<0.01)。结果表明,实验剂量范围内,桑叶生物碱对小鼠8-iso-PGF2α水平有明显下调作用,高剂量恢复至与正常对照组无显著差异的水平(P>0.05)。
2.2.2 桑叶生物碱对小鼠蛋白氧化损伤的影响
蛋白质是一类重要的生物大分子,是各种自由基攻击的重要目标之一。PCO的生成是蛋白质被自由基氧化修饰的重要标记,这一特征具有普遍性,因而PCO水平可以判断蛋白质是否氧化损伤[15-16]。Witko-Sarsat等[17]研究表明,AOPP是从中性粒细胞骨髓过氧化物酶来源的氯氧化剂次氯酸作用于蛋白质而形成的蛋白交联产物,是蛋白质被氧化的特异性标志之一。机体发生硝化应激反应时,过氧亚硝基会使得蛋白的络氨酸残基发生硝化反应而产生特异性的3-NT,检测其在体液中的表达水平可以反映过氧亚硝基介导的蛋白氧化损伤[18]。
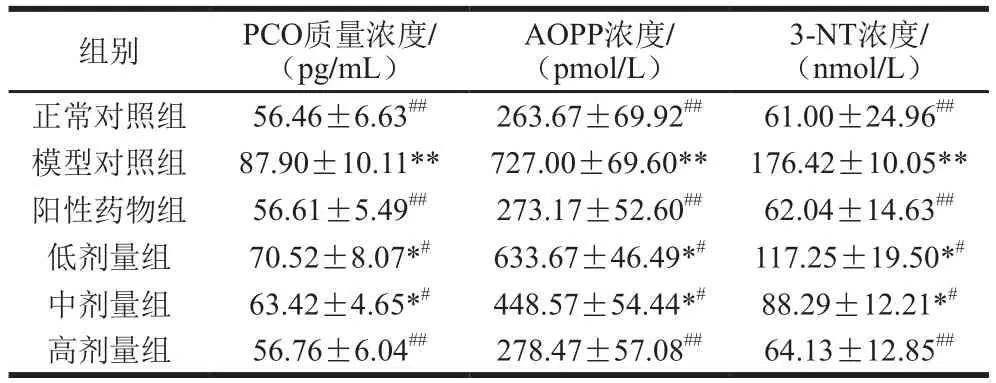
表 2 桑叶生物碱对D-Gal诱导小鼠血浆PCO、AOPP、3-NT水平的影响(n=10)Table 2 Effect of mulberry leaf alkaloids on PCO, AOPP and 3-NT levels in plasma of mice with D-Gal-induced injury (n= 10)
由表2可知,与正常组对照组相比,模型对照组小鼠PCO、AOPP、3-NT水平分别极显著增加了55.69%、175.72%、189.21%(P<0.01),表明模型对照组小鼠蛋白发生了氧化损伤,其有害产物水平增加。与模型对照组相比,阳性药物组及桑叶生物碱低、中、高剂量组均下调了小鼠PCO、AOPP、3-NT水平,阳性药物组较模型组分别极显著减少了35.60%、62.43%、64.83%(P<0.01),桑叶生物碱高剂量组较模型组分别极显著减少了35.43%、61.70%、63.65%(P<0.01)。结果表明,桑叶生物碱明显改善小鼠的蛋白氧化损伤,且高剂量组恢复至与正常对照组无显著性差异的水平(P>0.05)。
2.2.3 桑叶生物碱对小鼠DNA氧化损伤的影响
研究表明,DNA氧化损伤的主要产物是8-OH-dG、5-OH-dC。在DNA的碱基中,鸟嘌呤的分子轨道具有较高的能级,其8位碳原子容易被氧化损伤而生成修饰碱基8-OH-dG[19]。8-OH-dG的化学性质比较稳定,其可作为外源或内源因素对DNA氧化损伤的较灵敏和稳定指标[20]。Wagner等[21]采用酶水解小牛胸腺DNA和反相高效液相色谱-电化学检测法技术证实5-OH-dC是一类DNA氧化损伤的重要产物。因此,测定这两个指标能较好地反映DNA氧化损伤的情况。

表 3 桑叶生物碱对D-Gal诱导小鼠血浆中8-OH-dG、5-OH-dC质量浓度的影响(n=10)Table 3 Effect of mulberry leaf alkaloids on 8-OH-dG and 5-OH-dC contents in plasma of mice with D-Gal-induced injury (n= 10)
由表3可知,与正常对照组相比,模型对照组小鼠8-OH-dG、5-OH-dC含量分别极显著增加了212.09%、181.85%(P<0.01),表明模型组小鼠发生了DNA氧化损伤。与模型对照组相比,阳性药物组以及桑叶生物碱低、中、高剂量组均下调了小鼠8-OH-dG、5-OH-dC水平,阳性药物组较模型组分别极显著减少了67.47%、63.18%(P<0.01),桑叶生物碱高剂量组较模型组分别极显著减少了65.02%、57.90%(P<0.01)。结果表明,桑叶生物碱明显改善小鼠的DNA氧化损伤,且高剂量组恢复至与正常对照组无显著性差异的水平(P>0.05)。
2.3 桑叶生物碱对小鼠血浆TAC的影响
单独测定机体中的某一抗氧化成分含量往往不能全面反映机体的抗氧化能力,因而采用TAC来评价机体的总抗氧化能力。
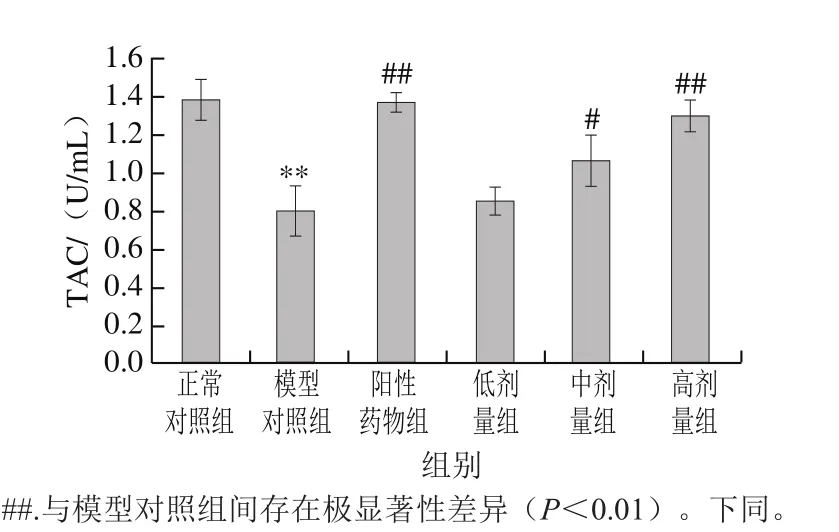
图 2 桑叶生物碱对D-Gal诱导小鼠血浆TAC的影响(n=10)Fig. 2 Effect of mulberry leaf alkaloids on plasma TAC in mice with D-Gal-induced injury (n = 10)
由图2可知,与正常对照组相比,模型对照组小鼠TAC极显著下降了42.03%(P<0.01)。与模型对照组相比,阳性药物组、桑叶生物碱3 个剂量组均能使小鼠TAC增加;阳性药物组、桑叶生物碱高剂量组TAC分别是模型对照组的1.71、1.63 倍(P<0.01),结果表明,桑叶生物碱能有效恢复氧化应激小鼠的总抗氧化能力,且高剂量组恢复到与正常对照组无显著性差异的水平(P>0.05)。
2.4 桑叶生物碱改善小鼠生物大分子氧化损伤的作用机理
2.4.1 桑叶生物碱对小鼠血浆抗氧化酶的影响
SOD是广泛存在于动植物体内的酸性金属酶,其作用是清除机体过剩自由基、抑制脂质氧化等,被誉为机体的“清道夫”[22]。GSH-Px能催化过氧化物与GSH反应,能有效清除氧自由基,防止氧化应激反应的发生,进而有效阻断活性氧自由基对机体的进一步损伤,保护细胞膜以及一些生物大分子的结构和功能,是生物体内重要的活性氧清除剂之一。
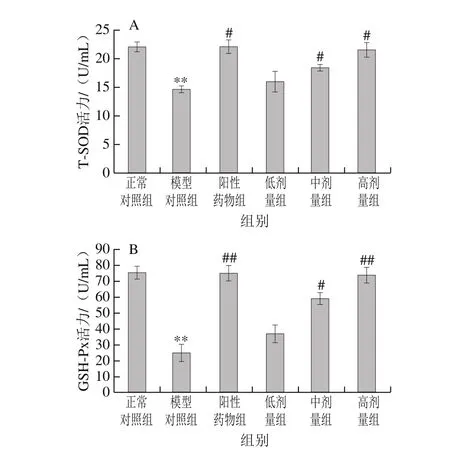
图 3 桑叶生物碱对D-Gal诱导小鼠血浆T-SOD(A)、GSH-Px(B)活力的影响(n=10)Fig. 3 Effect of mulberry leaf alkaloids on T-SOD (A) and GSH-Px (B)activity in plasma of mice with D-Gal-induced injury (n = 10)
由图3可知,与正常对照组相比,模型对照组小鼠T-SOD、GSH-Px分别极显著下降了33.65%、66.87%(P<0.01)。与模型对照组相比,阳性药物组、桑叶生物碱3 个剂量组均能上调小鼠T-SOD、GSH-Px活力;阳性药物组T-SOD、GSH-Px分别是模型对照组的1.51(P<0.05)、3.00 倍(P<0.01),桑叶生物碱高剂量组是模型对照组的1.47(P<0.05)、2.96 倍(P<0.01)。结果表明,桑叶生物碱能有效使模型小鼠T-SOD、GSH-Px活力增加,高剂量组能恢复至与正常对照组无显著性差异的水平(P>0.05)。
2.4.2 桑叶生物碱对小鼠血浆非酶抗氧化剂的影响
MT是一类广泛存在机体内具有独特生物学功能的金属硫蛋白,其可以通过结合和释放金属离子来调节机体自由基水平[23]。研究表明,MT清除自由基的能力是谷胱甘肽的25 倍,是SOD的10 000 倍,被称为机体最佳抗氧化剂[24]。Trx是构成硫氧还蛋白系统的重要组成成分,其能与过氧化物还原酶发生交互作用来清除机体的活性氧,从而发挥抗氧化作用,维持细胞的氧化还原平衡环境[25]。桑叶生物碱对小鼠血浆中非酶抗氧化剂MT、Trx含量的影响结果如图4所示。
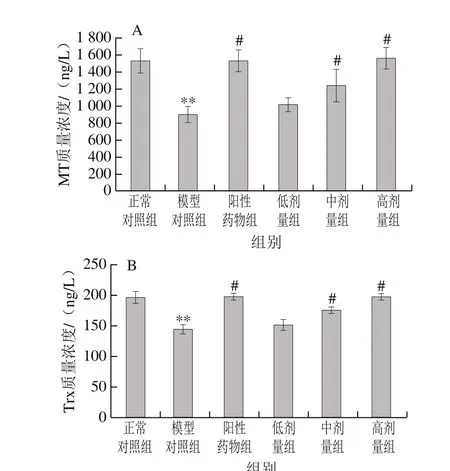
图 4 桑叶生物碱对D-Gal诱导小鼠血浆MT(A)、Trx(B)质量浓度的影响(n=10)Fig. 4 Effect of mulberry leaf alkaloids on MT (A) and Trx (B)contents in plasma of mice with D-Gal-induced injury (n = 10)
由图4可知,与正常对照组相比,模型对照组小鼠MT、Trx分别极显著下降了41.37%、26.56%(P<0.01)。与模型对照组相比,阳性药物组、桑叶生物碱3 个剂量组均能使小鼠MT、Trx质量浓度增加;阳性药物组MT、Trx分别是模型对照组的1.71、1.37 倍(P<0.05),桑叶生物碱高剂量组是模型对照组的1.74、1.37 倍(P<0.05)。结果表明,桑叶生物碱能有效使模型小鼠非酶抗氧化剂MT、Trx质量浓度增加,且高剂量组恢复到与正常对照组无显著性差异的水平(P>0.05)。
3 讨 论
生物碱是桑叶中重要的活性成分之一,具有较好的抗氧化潜力[26]。实验动物注射外源性的D-Gal后,机体会产生大量活性氧自由基,造成组织器官的氧化应激损伤,是目前公认的建立动物衰老的模型方法[27]。本研究采用D-Gal对小鼠进行造模,灌胃不同剂量(50、100、200 mg/kg mb)的桑叶生物碱。在本研究的实验剂量与时间范围内,结果显示3 个水平的剂量组间呈现J型关系,而更高剂量是否会产生有害的作用,还需要进一步研究。
D-Gal造模后致小鼠血浆MDA、SOD水平显著下降,表明造模成功。体质量是动物实验中的一个非特异性观察指标,其反映动物机体的综合代谢和机能,进而能够评价动物的生长情况。本研究中,造模成功时,模型对照组小鼠与正常对照组小鼠体质量存在极显著差异(P<0.01),与文献[28]报道一致。4 周治疗结束后,桑叶生物碱高剂量组与正常组不存在显著性差异(P>0.05)。实验中小鼠摄食量、食物利用率的变化与体质量相一致。
机体氧化应激损伤的发生通常是以自由基代谢产物如脂质过氧化物8-iso-PGF2α;蛋白质过氧化物PCO、AOPP、3-NT;DNA氧化产物8-OH-dG、5-OH-dC等物质的含量水平作为衡量标准。MDA是研究的最早且最为明确的脂质过氧化产物,但已有研究表明8-iso-F2α比MDA能更好反映机体氧化应激程度[29]。8-iso-F2α是自由基攻击细胞膜脂质花生四烯酸,使其发生脂质过氧化后而形成的前列腺素衍生物,作为临床氧化应激的标准物[13]。本研究发现桑叶生物碱高剂量组极显著降低小鼠血浆8-iso-F2α含量,表明桑叶生物碱对脂质过氧化的有较好改善作用,与文献[10]报道一致。蛋白质是组成细胞的基本物质,参与机体脂类、矿物质等的转运,其氧化对机体的生理状态具有重要影响。机体内PCO主要是通过金属离子介导氧化系统完成[30];此外羟基直接作用于肽链,使得蛋白质的一级结构被破坏,进而在肽链的断裂处也能形成PCO[31]。李竹青[32]研究表明AOPP会加剧机体的氧化应激状态。当机体中蛋白质或氨基酸发生硝化反应时,则会严重影响代谢酶活性的调节和细胞信号转导,3-NT是硝基化反应重要产物[33]。张月等[34]体外研究表明辣椒碱对不同自由基引发的蛋白羰基化修饰与硝化修饰均有显著的抑制作用。本研究结果显示,桑叶生物碱高剂量组均能显著降低小鼠PCO、AOPP、3-NT水平(P<0.01),表明桑叶生物碱能有效改善机体内蛋白氧化损伤。同张月等[34]的研究对比,生物碱类化合物不仅在体外对蛋白质大分子的氧化损伤具有改善作用,本研究还进一步证实其在机体内也能发挥有效的活性功能。自由基会引起DNA的氧化与交联,使其发生变性,导致DNA突变,进而影响其信息传递功能以及转录复制的特性,使机体蛋白质的合成能力下降,同时也会引起多种酶的减少或失活[35]。Ullah等[36]研究发现咖啡因可以通过减少8-OH-dG降低机体氧化应激。本研究结果也显示,桑叶生物碱显著降低DNA氧化产物8-OH-dG、5-OH-dC含量,表明桑叶生物碱能与其他生物碱类化合物一样对机体DNA氧化损伤具有改善作用。
研究表明,血浆中的TAC是机体酶促与非酶促抗氧化能力的综合表现,其TAC越高,机体抗氧化防御系统能力越强,当TAC降低时,机体的细胞信号转导方向改变从而使机体发生早期防御反应[37]。本研究结果发现桑叶生物碱能极显著增加小鼠TAC(P<0.01),表明桑叶生物碱能增强机体抗氧化系统防御能力。
机体自身有一套复杂且完整由酶系统与非酶系统构成的抗氧化防御系统,酶系统主要包括SOD、GSH-Px等抗氧化酶类,非酶系统主要包括MT、Trx等抗氧化物质。研究表明,SOD、GSH-Px能清除机体过量自由基,缓减机体氧化应激状态,在维持细胞的氧化与抗氧化平衡的过程中扮演着重要的角色[38]。在机体氧化应激状态下,这两种酶的活性逐渐降低,与此一致的是本研究中,模型组小鼠中SOD、GSH-Px活力亦是极显著降低。经桑叶生物碱干预后,小鼠机体内这两种酶的活性都明显提高,且随桑叶生物碱的剂量的增加而增加,高剂量组恢复到正常水平。非酶抗氧化剂能清除机体自由基的低分子质量物质,不同的抗氧化剂都具有特异性,在机体中清除自由基的作用不能相互代替,但相互间可协同作用,是机体抗氧化防御系统中不可缺少部分[39]。本研究结果显示,桑叶生物碱能显著增加模型小鼠血浆中MT、Trx含量(P<0.05)。这些研究结果综合表明提高机体抗氧化酶SOD、GSH-Px的催化活性、非酶抗氧化剂MT、Trx的水平与桑叶生物碱在模型组小鼠体内对氧化应激的拮抗作用是密切相关的。
综上所述,在实验剂量与时间范围内,桑叶生物碱能显著改善D-Gal诱导小鼠脂质、DNA、蛋白质的氧化损伤,具有较好的抗氧化作用,其作用机理可能与其显著增加机体抗氧化酶活力和非酶抗氧化剂含量,使机体抗氧化防御系统能力增强有关,但其具体作用机理还需进一步深入探讨。
