酪蛋白糖基化对其胰蛋白酶消化物在免疫低下模型小鼠中免疫活性的影响
2020-03-31刘宛宁赵新淮
时 佳,刘宛宁,付 余,赵新淮,
(1.东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030;2.西南大学食品科学学院,重庆 400715)
酪蛋白是含量最多的乳蛋白成分,并且是食品工业广泛应用的蛋白质配料。近20 年来,为进一步提高酪蛋白的应用效果,科研人员通过物理、化学或生物等不同途径修饰酪蛋白结构、改进其功能性质,糖基化是其中修饰技术之一。美拉德反应是蛋白质(提供氨基)和还原糖(提供羰基)之间的反应,可以导致蛋白质发生糖基化。研究发现,利用美拉德反应和蘑菇β-葡聚糖对燕麦分离蛋白进行糖基化修饰,修饰后燕麦分离蛋白的溶解性、乳化性和热稳定性得到改善[1]。葡聚糖和乳清分离蛋白经美拉德反应糖基化后,蛋白质分子间相互作用降低,在较大pH值范围内和较高浓度下有较好的溶解性和热稳定性[2]。利用美拉德反应分别和葡萄糖、半乳糖、阿拉伯糖、核糖糖基化得到糖基化β-乳球蛋白,其乳化和起泡性质均得到改善,并且这些性质的改善程度与糖种类有关[3]。蛋白质糖基化反应对蛋白质的某些生物活性也有影响。例如,葡萄糖糖基化的豌豆7S球蛋白有更低的抗体亲和性和较低的Caco-2单层细胞毒性[4];乳糖糖基化的酪蛋白具有较低的免疫活性[5]。作为重要的营养素之一,蛋白质对动物机体的免疫状况有直接影响,可以促进免疫器官发育、淋巴细胞增殖,以及降低迟发性过敏反应[6–8]。然而,在免疫低下小鼠模型中,美拉德糖基化反应对酪蛋白消化物的免疫增强作用是否有影响的相关研究鲜见报道。
环磷酰胺是一种细胞毒性化疗药物,属于烷化剂类免疫抑制剂,因此常被用于建立免疫低下动物模型[9–10]。本研究利用环磷酰胺诱导免疫低下小鼠模型,确定糖基化酪蛋白消化物对免疫低下小鼠免疫状况的改善作用,并与酪蛋白消化物对比,以揭示酪蛋白美拉德糖基化反应对其消化物免疫活性的潜在影响。
1 材料与方法
1.1 材料与试剂
雌性BALB/c小鼠(6~8 周龄;生产许可证号:SCXK(京)2012-0001,使用许可证号SYXK(黑)2016-007)和饲料 北京维通利华实验动物技术有限公司;小鼠淋巴瘤YAC-1细胞 中国科学院细胞库。动物实验按照哈尔滨医科大学实验动物准则执行。
酪蛋白、乳糖、环磷酰胺和刀豆蛋白A(concanavalin A,ConA) 美国Sigma公司;磷酸盐缓冲液 北京索莱宝科技有限公司;胰蛋白酶(120 000 U/g) 北京奥博星生物技术有限公司;台盼蓝 美国Amresco公司;RPMI-1640培养基 美国HyClone公司;胎牛血清(fetal bovine serum,FBS)加拿大Wisent公司;半乳糖测试盒 美国BioAssay Systems公司;CCK-8检测试剂盒 日本Dojindo公司;鼠免疫球蛋白(immunoglobulin,Ig)(IgM、IgA、IgG)检测试剂盒 南京建成生物技术有限公司;其他化学试剂均为分析纯级。
1.2 仪器与设备
DELTA 320型精密pH计、AL204型电子分析天平梅特勒-托利多(上海)仪器有限公司;HF-90型CO2培养箱 美国力康公司;Model 680型酶标仪 美国Bio-Rad公司;DK-98-1型电热恒温水浴锅 天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 乳糖糖基化酪蛋白消化物的制备
取一定量乳糖均匀分散于60 g/L酪蛋白溶液中,使乳糖和酪蛋白质量比为1.6∶1,调整酪蛋白终质量浓度为50 g/L、溶液pH 6.8。将反应物于沸水浴(100 ℃)中反应3 h,然后将样品在冰浴中迅速冷却至室温。调整溶液pH值至4.5,4 000×g离心10 min,收集沉淀,pH 4.5下水洗2 遍,所得沉淀用0.5 mol/L NaOH溶液调节pH 7,冷冻干燥后粉碎得到糖基化酪蛋白(乳糖含量(13.2±0.4)g/kg pro)。
质量浓度为50 g/L、pH 7.0的酪蛋白溶液和糖基化酪蛋白溶液中分别加入胰蛋白酶(7 000 U/g pro),37 ℃水解4 h,沸水浴灭酶5 min,快速冷却至20 ℃,再用0.5 mol/L NaOH溶液调整pH值至7.0,冷冻干燥粉碎后得到酪蛋白消化物和糖基化酪蛋白消化物(乳糖含量(10.6±0.3)g/kg pro)。
1.3.2 化学指标测定
蛋白含量:用凯氏定氮法测定样品含氮量,转换因子为6.38。
乳糖含量:按照文献[11]方法测定乳糖含量。称取一定量样品于安瓿瓶,加入2 mL 2 mol/L三氟乙酸溶液,100 ℃水解4 h,冷却至20 ℃,用0.1 mol/L NaOH溶液调整pH值至7.0,用半乳糖测试盒测定水解液半乳糖浓度,然后换算为样品中的乳糖含量。
1.3.3 小鼠分组及模型建立
雌性BALB/c小鼠80 只,适应性饲养1 周后,分为8 组:正常组、模型组、6 个实验组,每组10 只。正常组小鼠每天灌胃生理盐水28 d;模型组小鼠灌胃80 mg/kg mb环磷酰胺3 d后,再灌胃生理盐水25 d;实验组小鼠先灌胃80 mg/kg mb环磷酰胺3 d,再分别给予100、200、400 mg/kg mb的酪蛋白消化物或糖基化酪蛋白消化物25 d。
1.3.4 血清生化指标和Ig质量浓度测定
小鼠最后1 次灌胃24 h后,称体质量,眼球采血。血液样品于2 000×g离心10 min,用Beckman DXC 800自动生化分析仪测定血清生化指标。按照相应试剂盒说明书操作测定血清IgM、IgA、IgG质量浓度。
1.3.5 脾脏指数和胸腺指数测定
小鼠眼球取血后,脱颈处死,剖取脾脏和胸腺,滤纸吸取表面残留血液及多余水分,分别称湿质量。脾脏指数和胸腺指数分别按式(1)、(2)计算。

1.3.6 脾淋巴细胞增殖实验
无菌条件下将各组小鼠剖腹,取脾脏,剪成小块,置于200 目不锈钢网筛,筛网中央浸没于盛有Hank’s液的平皿中。无菌注射器芯研磨脾脏组织,用Hank’s液吹洗掉网筛上的剩余组织,收集脾脏组织悬液于无菌离心管,199×g离心5 min,弃去上清液。用3 mL红细胞裂解液重悬细胞,静置3 min,199×g离心5 min,弃去上清液;RPMI-1640培养液重悬细胞制成单细胞悬液,通过台盼蓝实验计算细胞数,活细胞数不少于95%,调整细胞浓度为2×105个/mL。
将脾细胞悬液接种于96 孔板(200 μL/孔),同时每孔加20 μL ConA(终质量浓度5 μg/mL),置于37 ℃、5% CO2培养箱中培养24~48 h。每孔加20 μL CCK-8,继续培养4 h,利用酶标仪在450 nm波长处测定光密度。以不添加脾细胞添加RPMI-1640培养液作空白孔。脾淋巴细胞增殖指数按式(3)[12]计算。

1.3.7 NK细胞活力分析
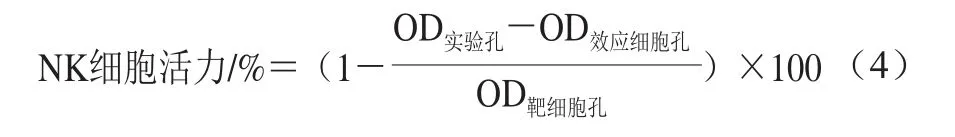
将YAC-1细胞(靶细胞)用RPMI培养液(含10% FBS)调整细胞浓度为1×104个/mL。将脾细胞悬液(5×105个/mL)和YAC-1细胞悬液(1×104个/mL)各100 μL/孔接种于96 孔板,同时设定效应细胞和靶细胞孔。细胞在37 ℃、5% CO2培养箱中培养24~48 h后,每孔加15 μL CCK-8,继续培养4 h,用酶标仪于450 nm波长处测定各孔光密度值。自然杀伤(natural killer,NK)细胞活力按式(4)[13]计算。
1.4 数据处理与分析
实验结果均以平均值±标准差表示。采用SPSS 16.0软件进行Duncan’s多重比较,确定各组间数据的差异显著性(P<0.05)。
2 结果与分析
2.1 2 种酪蛋白消化物对小鼠血清生化指标的影响
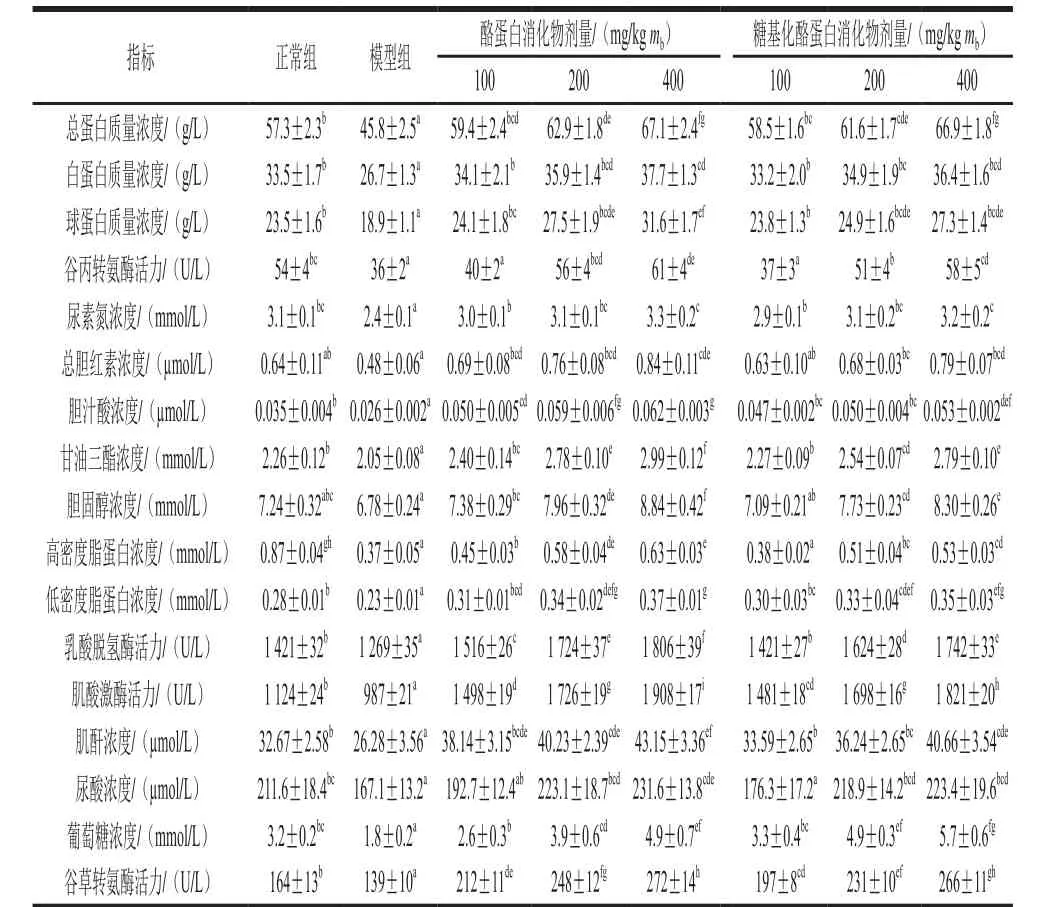
表 1 酪蛋白消化物及糖基化酪蛋白消化物对小鼠血清生化指标的影响Table 1 Effect of glycated casein digest and casein digest on serum biochemical indices of mice
动物的血清生化指标常用于反映实验动物的健康与生理状况。已有研究表明,膳食咖啡酸通过影响血清生化指标,调控机体免疫功能[14]。饲料中添加β-伴大豆球蛋白可影响幼鲤生长以及其血清生化指标,实现幼鲤免疫状态改善[15]。本研究中2 种酪蛋白消化物对小鼠17 项生化指标的影响如表1所示。与正常组小鼠相比,模型组小鼠各项指标水平均显著降低(P<0.05),表明环磷酰胺对小鼠产生不良影响。与模型组小鼠相比,糖基化酪蛋白消化物组小鼠各项指标水平均显著增加(P<0.05),表明糖基化酪蛋白消化物可改善小鼠生理状况。然而,与酪蛋白消化物相比,糖基化酪蛋白消化物对小鼠生理状况的改善程度要低一些。糖基化酪蛋白消化物的活性低于酪蛋白消化物,这可能与酪蛋白的糖基化反应有关。美拉德反应破坏了蛋白质中赖氨酸等必需氨基酸[16],因此导致糖基化酪蛋白消化物在免疫低下小鼠中活性降低。
血清总蛋白(total protein,TP)主要由血清球蛋白(globulin,GLO)和血清白蛋白(albumin,ALB)构成。TP含量高,则动物营养状况良好[17]。谷丙转氨酶(alanine amiotransferase,ALT)是检测肝功能的重要指标。血清尿素氮(blood urea nitrogen,BUN)为蛋白质代谢后产物,是反映动物体内蛋白质代谢和氨基酸平衡状况的指标[18]。对于5 项重要生化指标(TP、ALB、GLO质量浓度,ALT活力及BUN浓度),与模型组小鼠相比,酪蛋白消化物组小鼠5 项指标分别从45.8、26.7、18.9 g/L,36 U/L及2.4 mmol/L增加到59.4~67.1、34.1~37.7、24.1~31.6 g/L,40~61 U/L及3.0~3.3 mmol/L,而糖基化酪蛋白消化物处理组小鼠5 项指标分别增加到58.5~66.9、33.2~36.4、23.8~27.3 g/L,37~58 U/L及2.9~3.2 mmol/L。这些数据表明,酪蛋白消化物比糖基化酪蛋白消化物具有更好的免疫提升效率。
2.2 2 种酪蛋白消化物对血清中Ig分泌的影响
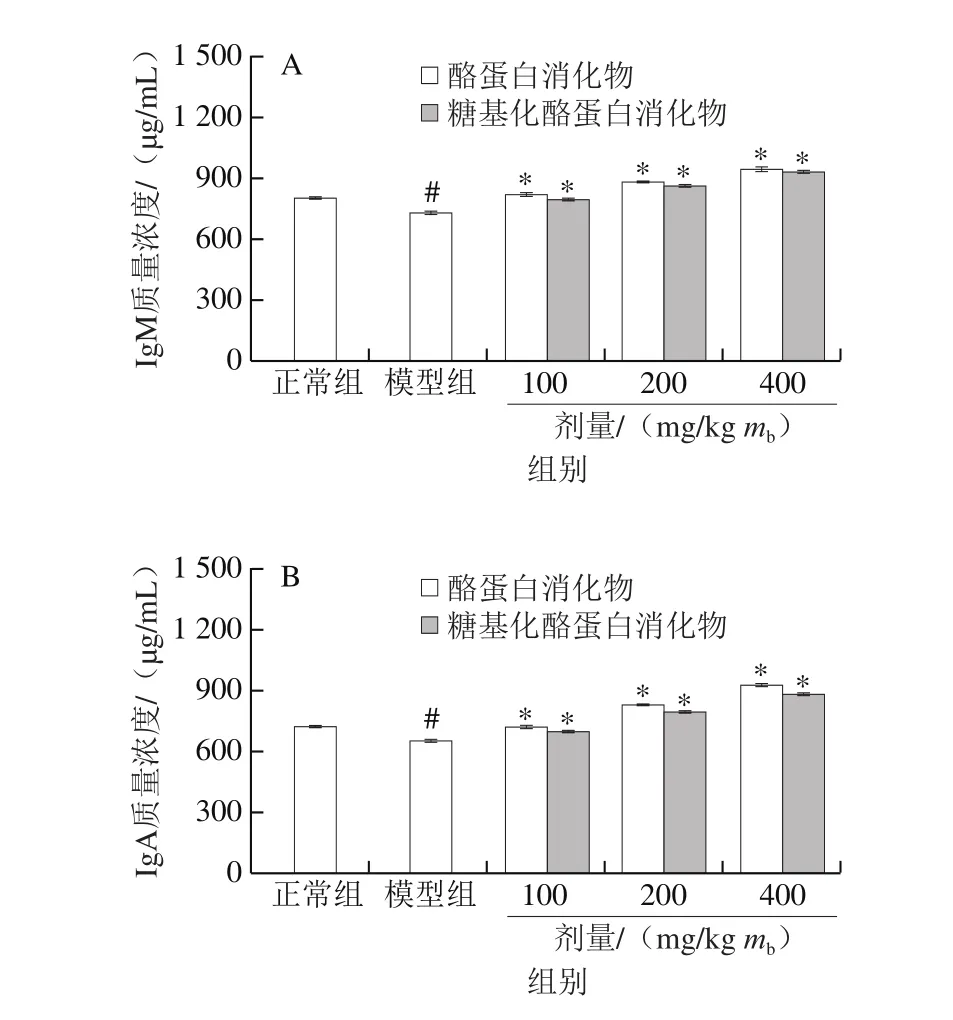
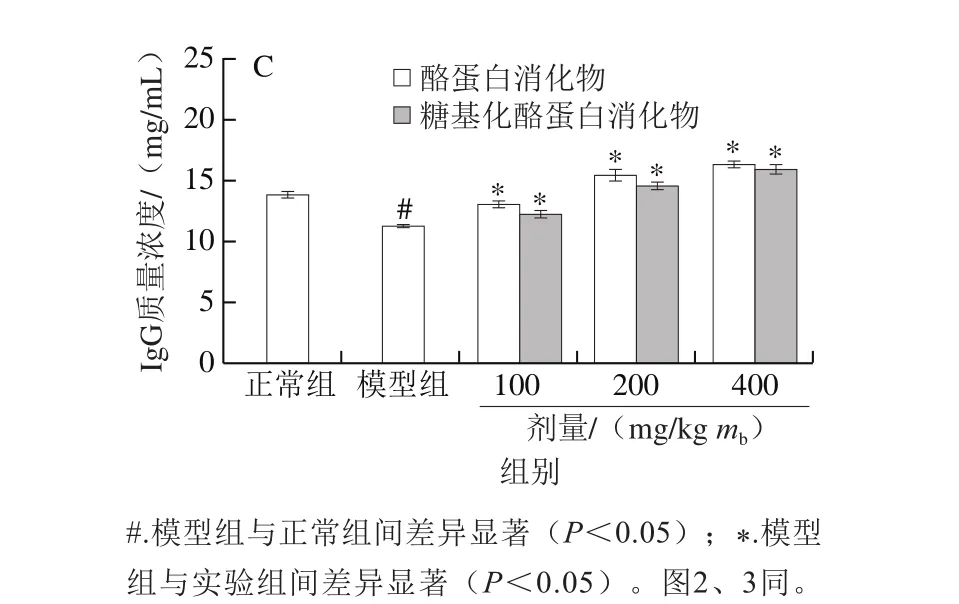
图 1 酪蛋白和糖基化酪蛋白消化物对小鼠血清IgM(A)、IgA(B)和IgG(C)分泌的影响Fig. 1 Effects of glycated casein digest and casein digest on serum IgM (A), IgA (B), and IgG (C) levels of mice
Ig是机体主要的免疫分子,其含量高低直接反映动物机体免疫应答能力[19]。已有研究结果表明,大豆低聚糖可以增强小鼠IgM、IgA和IgG分泌[20]。酪蛋白肽通过促进Ig产生和免疫分子分泌,调控机体的免疫功能[21]。由图1可知,与正常组小鼠比较,模型组小鼠血清IgM、IgA和IgG质量浓度分别从806.4、724.7 μg/mL和13.9 mg/mL降低至726.9、654.1 μg/mL和11.3 mg/mL,表明环磷酰胺导致小鼠免疫低下。与模型组小鼠比较,酪蛋白消化物组小鼠血清IgM、IgA和IgG质量浓度分别增加至821.9~947.9、721.8~927.4 μg/mL和13.1~16.4 mg/mL,而糖基化酪蛋白消化物组小鼠血清IgM、IgA和IgG质量浓度分别增加至799.4~937.7、699.7~885.3 μg/mL和12.4~16.0 mg/mL。在同一剂量水平下,酪蛋白消化物显示出比糖基化酪蛋白消化物更强的提升效果,证明糖基化反应降低了酪蛋白消化物提升Ig分泌的能力。Shi Jia等发现酪蛋白与乳糖的糖基化反应降低了酪蛋白消化物的免疫活性[5];蔺海鑫等发现原肌球蛋白与核糖的糖基化反应也降低了其免疫活性[22];Shi Jia等研究结果表明,酪蛋白与乳糖的美拉德反应减弱了酪蛋白消化物对丙烯酰胺诱导小肠上皮细胞屏障损伤的保护作用[23]。
2.3 2 种酪蛋白消化物对小鼠免疫器官指数的影响
脾脏是动物的外周免疫器官,产生淋巴细胞,参与体液和细胞免疫。胸腺是动物的一级免疫器官,对T细胞成熟和分化起作用[24]。因此,脾脏指数、胸腺指数直接反映机体免疫状况。研究表明,毛豆腐提取物可以增加脾脏指数和胸腺指数,提高动物免疫状况[25]。来源于κ-酪蛋白的糖巨肽具有免疫抑制活性,鸡蛋卵清蛋白源糖肽具有显著的免疫调节功能[26-27]。甘薯糖蛋白可显著提高小鼠脾脏指数和胸腺指数,脾淋巴小节增多增大,胸腺T细胞线粒体数量增多,表明甘薯糖蛋白具有明显的增强免疫调节作用[28]。
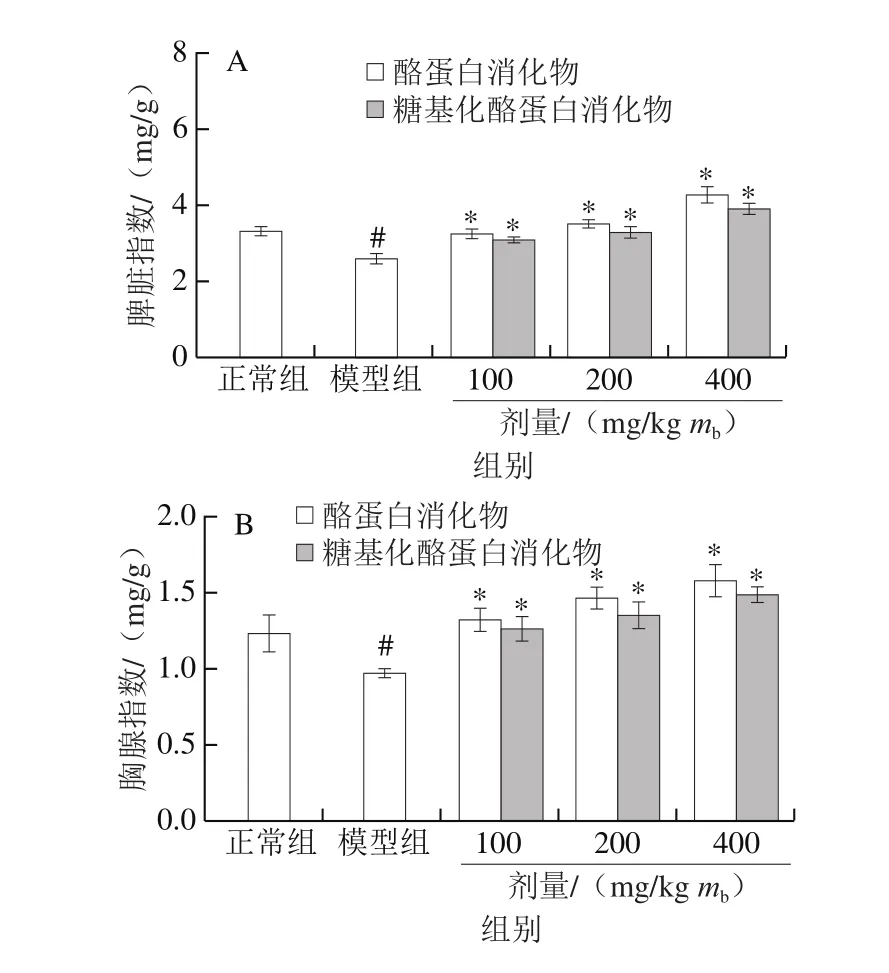
图 2 酪蛋白和糖基化酪蛋白消化物对小鼠脾脏指数(A)和胸腺指数(B)的影响Fig. 2 Effects of glycated casein digest and casein digest on spleen (A)and thymus (B) indices of mice
由图2可知,与正常组小鼠比较,模型组小鼠的脾脏和胸腺指数均显著降低(P<0.05),表明环磷酰胺影响小鼠免疫器官的发育。与模型组小鼠比较,给予酪蛋白消化物和糖基化酪蛋白消化物后,小鼠胸腺指数和脾脏指数均显著增加(P<0.05),且呈剂量依赖效应。酪蛋白消化物导致小鼠的脾脏和胸腺指数分别增加至3.24~4.26 mg/g和1.32~1.58 mg/g,而糖基化酪蛋白消化物仅分别增加至3.06~3.89 mg/g和1.26~1.48 mg/g。同一剂量水平下,酪蛋白消化物对小鼠脾脏和胸腺指数的提升作用强于糖基化酪蛋白消化物,证明糖基化反应不利于酪蛋白消化物改善小鼠脾脏和胸腺的生长发育状况。
2.4 糖基化酪蛋白消化物对脾淋巴细胞增殖和NK细胞活力的影响
脾淋巴细胞是体内免疫细胞之一,其增殖和分化是机体免疫应答过程的一个重要阶段。因此,淋巴细胞增殖水平评估是研究细胞免疫的常用方法[29]。NK细胞是重要的免疫效应细胞,在体内抗肿瘤非特异性免疫中发挥重要作用[30]。已有研究结果表明,乳蛋白肽可以促进小鼠脾淋巴细胞增殖、提高NK细胞活力[21,31]。胃蛋白酶水解鲤鱼卵蛋白后,其水解物显著提高了脾淋巴细胞增殖作用和NK细胞活力[32]。大豆糖肽对ConA诱导的脾细胞有增殖抑制作用,而对正常生长的脾细胞有增殖促进作用[33]。由图3可知,与正常组小鼠相比,模型组小鼠的脾淋巴细胞增殖指数和NK细胞活力均显著下降(P<0.05),而2 种消化物以剂量依赖方式促进小鼠脾淋巴细胞增殖和增强NK细胞活力。与模型组小鼠相比,酪蛋白消化物处理24 h和48 h后,小鼠脾淋巴细胞增殖指数分别从0.951和0.974增加至1.154~1.342和1.184~1.472,NK细胞活力分别从30.8%和32.2%增加至35.8%~48.8%和46.1%~61.4%;糖基化酪蛋白消化物处理24 h和48 h后,小鼠脾淋巴细胞增殖指数分别增加至1.147~1.316和1.176~1.379,NK细胞活力分别增加至33.1%~45.7%和41.5%~58.3%。整体上看,糖基化酪蛋白消化物刺激小鼠脾细胞的能力仍然低于酪蛋白消化物,再次证明糖基化反应降低了酪蛋白消化物提升小鼠免疫细胞活性的作用。

图 3 酪蛋白和糖基化酪蛋白消化物对小鼠淋巴细胞增殖指数和NK细胞活力的影响Fig. 3 Effects of glycated casein digest and casein digest on lymphocyte proliferation index and NK cell activity of mice
3 结 论
采用环磷酰胺处理后,小鼠免疫功能显著下降,与正常组小鼠相比,模型组小鼠17 项血清生化指标水平显著降低,同时3 种血清Ig质量浓度、脾脏、胸腺、脾淋巴细胞增殖指数、NK细胞活力等其他重要免疫指标也显著降低。实验结果表明,免疫低下模型小鼠给予酪蛋白消化物和糖基化酪蛋白消化物后,小鼠免疫状况均得到改善,各项免疫指标水平增加,提示两种消化物均具有提升免疫作用。本研究结果进一步表明,酪蛋白消化物具有比糖基化酪蛋白消化物更好的免疫提升效率,酪蛋白经美拉德糖基化反应导致其消化物的免疫活性降低,从而揭示蛋白质美拉德糖基化反应的潜在不利作用。考虑到蛋白质的美拉德糖基化反应导致蛋白质氨基酸被破坏和免疫活性降低,因此,控制乳制品加工处理过程中的美拉德反应具有必要性。
