热胁迫对大肠杆菌细胞膜和膜蛋白的影响
2020-03-30张爱静李琳琼王鹏杰高瑀珑
张爱静,李琳琼,王鹏杰,高瑀珑
(南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心/江苏高校粮油质量安全控制及深加工重点实验室,南京 210023)
0 引言
【研究意义】大肠杆菌是一类在自然界广泛存在且极易引起食品污染的革兰氏阴性菌[1]。在自然环境中,大肠杆菌经常遭受高温、低温、酸、碱及渗透压等不适环境的胁迫,由于被不适环境条件胁迫,诱发其启动自我保护机制,通过对外界不利环境的适应而进行生长。在食品生产加工过程中,食品原料中的微生物经常处于胁迫环境中,面对不适宜的生长环境条件,其生理代谢会发生应激反应,通过这种对不良环境的适应能力使其生存下来[2-3]。高温杀菌是食品工业中通常采用的一种灭菌手段[4]。微生物的耐热性不仅受遗传因素的影响,还受环境因素的影响[5]。微生物会对不利的生存环境产生抗性或适应性反应的机制,近年来引起了研究者的广泛关注[6-7]。然而,微生物对不利环境因素产生抗性或适应性反应的机制尚未研究清楚,深入系统研究大肠杆菌在食品加工过程中热胁迫响应机制,为高温杀菌技术在食品工业中的应用奠定理论基础,对于保障食品加工安全,建立食品质量安全控制体系具有重要意义。【前人研究进展】GIULIODORI等[8]研究发现,将大肠杆菌从最适培养温度37℃转移至10℃培养时,其会迅速做出冷应激反应,诱导相关基因的合成与冷休克蛋白的表达等。CEBRIÁN等[9]通过对金黄色葡萄球菌进行亚致死性的酸、碱和过氧化氢胁迫处理,发现与原始对照菌株相比,适应性菌株对这些致死条件的抗性增加,表明金黄色葡萄球菌经过酸、碱和过氧化氢胁迫处理产生了抗性。有研究认为[10-11],细胞膜流动性发生变化是菌体对不利生存环境产生适应性的原因之一。细胞膜是紧贴在细胞壁内侧包裹细胞质的一层柔软而富有弹性的半透性薄膜,是由磷脂和蛋白质分子组成的生物膜。流动的脂质双分子层是生物膜结构的基本特征,适宜的流动性是保证细胞处于正常生理状态的重要条件。BENEY等[12]研究表明,胁迫蛋白参与信号传导,在防止蛋白变性和稳定细胞膜结构方面起到一定作用。微生物对环境变化的感受和迅速做出反应的能力对其生存尤为重要,大多数微生物都有这样的能力[13-15]。【本研究切入点】根据张爱静等[16]的研究,发现大肠杆菌ATCC43889分别经50℃、60℃和70℃10次热胁迫均可诱导其抗热性增加,经10次热胁迫并转接培养后,D值显著增大(P<0.05),且胁迫温度越高,D值越大。然而,微生物对热胁迫环境因素产生抗性或适应性反应的机制尚不清楚。【拟解决的关键问题】本研究以食品生产加工中常见的污染菌大肠杆菌为试材,研究热胁迫作用下大肠杆菌抗热性增加与个体形态变化、生物被膜生成能力、细胞膜脂肪酸组成、细胞膜流动性变化以及外膜蛋白表达的关系,旨在综合分析热胁迫诱导大肠杆菌耐热性增加的机制,为研究食品加工条件,加强食品安全预测及控制提供依据。
1 材料与方法
试验于2018年在南京财经大学食品科学与工程学院进行。
1.1 材料与试剂
大肠杆菌ATCC43889购于江苏省疾病预防控制中心,采用胰蛋白胨大豆肉汤(Trypticase Soy Broth,TSB)培养基培养。供试菌经活化后,接入TSB培养基,36℃、140 r/min摇床振荡培养18 h,备用。
正己烷、甲醇、乙醚和甲基叔丁基醚为色谱纯;氢氧化钠、氯化钠、氯化镁、氯仿、盐酸、三羟甲基氨基甲烷(Tris)、戊二醛、乙醇、冰乙酸为分析纯;37种脂肪酸甲酯混标;TSB培养基、胰蛋白胨大豆琼脂(Trypticase Soy Agar,TSA)培养基,购于南京丁贝生物科技有限公司。
皂化溶液I:由15 g氢氧化钠、50 mL甲醇与50 mL蒸馏水混合配制;甲基化溶液Ⅱ:由65 mL 6 mol·L-1盐酸与55 mL甲醇混合配制;萃取溶液Ⅲ:由50 mL正己烷与50 mL乙醚混合配制;洗涤溶液Ⅳ:由0.36 g氢氧化钠与30 mL蒸馏水混合配制。
无菌缓冲液A(10 mmol·L-1PBS,pH 7.2—7.4);无菌缓冲液B(包含10 mmol·L-1MgCl2与250 mmol·L-1Tris,pH 7.5);无菌缓冲液C(50 mmol·L-1Tris/HCl,pH7.4)。
彩虹180广谱蛋白Marker、5×蛋白质上样缓冲液、TritionX-100、30%丙烯酰胺制胶液、四甲基乙二胺、过硫酸铵、考马斯亮蓝R250、BCA蛋白浓度测定试剂盒、96孔微量酶标板和色谱柱HP-5(30 m×0.32 mm×0.25 μm),购于南京丁贝生物科技有限公司。
1.2 仪器与设备
BSA224S塞多斯精密电子天平,北京塞多斯天平有限公司;601超级恒温水浴锅,金坛市医疗仪器厂;GL-21M高速冷冻离心机,上海市离心机械研究所有限公司;M200多功能酶标仪,瑞士Tecan公司;S-3400N II扫描电子显微镜,日本Hitachi公司;Agilent 6820型气相色谱仪,GCMS-QP2010型气相色谱-质谱联用设备,安捷伦科技仪器公司;DSC-8000差示扫描量热仪,珀金埃尔默股份有限公司;JY-SCZ2+电泳仪,北京君意东方电泳设备有限公司;ZF-258凝胶成像系统,上海金鹏分析仪器有限公司。
1.3 试验方法
1.3.1 3种抗热性大肠杆菌ATCC43889菌株的获得将1.1中活化的原始对照菌株ATCC43889按体积比为1%转接至装有200 mL TSB培养基的500 mL三角瓶中,36℃、140 r/min摇床振荡培养18 h至稳定期,分别将10 mL培养液加入无菌的中号试管(20 mm×200 mm),置于50℃、60℃和70℃的热水浴中进行加热胁迫处理,处理时间各为15 min,按照体积比为1.5%—2%的各温度加热胁迫处理后的ATCC43889菌种分别接种于装有100 mL TSB培养基的250 mL三角瓶中,36℃、140 r/min摇床振荡培养18 h至稳定期,再分别取10 mL培养液加入无菌的中号试管(20 mm×200 mm),置于50℃、60℃和70℃的热水浴中进行加热胁迫处理,处理时间各为15 min;以此类推,重复以上恒温振荡培养与加热胁迫处理10次,得到分别经50℃、60℃和70℃反复热胁迫处理10次并转接培养10次的3种抗热性的ATCC43889菌株。ATCC43889的稳定期通过平板菌落计数方法结合比浊法测得的生长曲线来测定[17]。
1.3.2 大肠杆菌ATCC43889个体形态的观察 参照梁静南等[18]与胡春辉等[19]的方法,并做适当修改。具体方法如下,将1.1中活化的大肠杆菌ATCC43889原始对照菌株与1.3.1中获得的3种抗热性菌株按照体积比为1%分别接种于装有100 mL TSB培养基的250 mL三角瓶中,36℃、140 r/min摇床振荡培养至稳定期,离心(4℃,5 000×g,15 min),弃上清液,再以0.85%无菌氯化钠生理盐水洗涤1次;加入2.5%戊二醛,用微型漩涡混合仪振荡3—5 min,使其与固定液充分接触,于室温下固定3 h后,离心(4℃,5 000×g,15 min),弃上清液,加入缓冲液A,振荡3—5 min,离心(4℃,5 000×g,15 min),弃上清液,重复2次;将离心管中的样品依次分别用30%、50%、70%、80%、90%、95%和100%的乙醇脱水离心(25℃,5 000×g,15 min),弃上清液;将上述样品放置于干燥箱(40℃,3 h)里干燥,之后将其固定在载物台上,置于镀金仪中真空喷金90 s,最后用扫描电镜拍照。扫描电镜使用的电压为20 kV,在放大倍数分别为10 000倍、20 000倍和40 000倍的视野下进行观察。
1.3.3 大肠杆菌ATCC43889生物被膜生成能力的测定 参照LAJHAR等[20]的方法,并做适当修改。具体方法如下,将1.1中活化的大肠杆菌ATCC43889原始对照菌株与1.3.1中获得的3种抗热性菌株按照体积比为1%分别接种于装有100 mL TSB培养基的250 mL三角瓶中,36℃、140 r/min摇床振荡培养至稳定期,备用。于无菌96孔微量酶标板中每孔加入TSB 100 μL,每个菌株3个平行,分别接种10 μL上述4种备用菌株,36℃静置培养36 h后,吸出培养液,各孔加入200 μL缓冲液A清洗板孔2次,各孔加入100 μL甲醇固定15 min,吸出孔中的甲醇,自然风干;每孔加入100 μL的1%结晶紫溶液,染色5 min,吸出孔中的结晶紫染色液,用清水冲洗掉多余的染料;将酶标板倒置于滤纸上吸去残余的水分,室温下晾干;每孔加入100 μL 33%冰乙酸溶液,36℃保温30 min,充分溶解结晶紫;在590 nm的波长处,以M200酶标仪分别测定各培养孔中溶液的OD值;以未接种菌的TSB培养液作为空白对照。本试验将每种菌株测定的OD590值减去空白对照的OD590值来表示这种菌株的生物被膜生成能力,OD590值每增加0.001作为该种菌株的一个生物被膜生成活力单位(U),生物被膜生成活力越大表示该菌株的生物被膜生成能力越强。
1.3.4 大肠杆菌ATCC43889细胞膜脂肪酸组成的测定 参照王秋红等[21]的方法,并作适当修改。具体方法如下,将1.1中活化的大肠杆菌ATCC43889原始对照菌株及1.3.1中获得的3种抗热性菌株按照体积比为1%分别接种于装有100 mL TSB培养基的250 mL三角瓶中,36℃、140 r/min摇床振荡培养至稳定期,分别用0.85%的氯化钠生理盐水适当稀释培养液,采用平板涂布的方法将上述4菌株稀释培养液在TSA平板上培养24 h,分别用一次性接种环刮取大约40 mg湿重的菌体置于10 mL离心管中,加入1 mL皂化溶液I,100℃水浴30 min,快速冷却后加入2 mL甲基化溶液Ⅱ,80℃水浴10 min,快速冷却,加入1.25 mL萃取溶液Ⅲ,摇震10 min;吸弃下层溶液,在上层溶液中加入3 mL洗涤溶液Ⅳ,摇震10 min。静置分层,移取上层液体于GC样品管中待测定。
ATCC43889细胞膜脂肪酸组成进行气相色谱分析条件为:进样口温度为270℃;检测器温度为280℃;载气为氮气,流速1.0 mL·min-1,不分流;尾吹气为氢气,流速25 mL·min-1;进样量为1 μL;升温程序:初温100℃,保持13 min,10℃·min-1升到180℃,保持6 min,再以1℃·min-1升到200℃,保持20 min。ATCC43889细胞膜脂肪酸组成由37种混合脂肪酸标样和气相色谱-质谱联用同时定性。气质联用测定条件为:气相色谱-质谱联用设备为GCMSQP2010 Ultra,色谱柱为HP-5,其他条件与气相色谱分析一致。ATCC43889细胞膜脂肪酸组成利用面积百分比进行分析。
1.3.5 大肠杆菌ATCC43889细胞膜磷脂相变温度的测定 参照CASADEI等[22]的方法,并作适当修改。具体方法如下,将1.1中活化的大肠杆菌ATCC43889原始对照菌株与1.3.1中获得的3种抗热性菌株按照体积比为1%分别接种于装有200 mL TSB培养基的500 mL三角瓶中,36℃、140 r/min摇床振荡培养至稳定期,分别取800 mL的4种菌株培养液,离心(3 000×g,4℃,15 min)、收集菌体,用缓冲液B洗涤两遍。将菌体沉淀重悬于7 mL缓冲液B中,加入20 mL甲醇和10 mL氯仿;摇床振荡30 min;再加入10 mL氯仿和10 mL缓冲溶液B,摇床振荡2 h。静置分层,收集下层的氯仿层,自然挥发(10 h),取10 mg样品置于DSC-8000差示扫描量热仪中,-20℃预冷30 min,采用10℃·min-1的温度梯度升温,在-10—60℃范围内测定ATCC43889细胞膜磷脂的相变温度,以空白作为对照。
1.3.6 大肠杆菌ATCC43889菌体外膜蛋白的测定ATCC43889菌体外膜蛋白的提取:ATCC43889菌体外膜蛋白的提取参照JUNEJA等[23]的方法,并作适当修改。具体方法如下,将1.1中活化的大肠杆菌ATCC43889原始对照菌株与3种抗热性菌株按照体积比为1%分别接种于装有200 mL TSB培养基的500 mL三角瓶中,36℃、140 r/min摇床振荡培养18 h,离心(4℃,5 000×g,10 min)、收集菌体,用缓冲液C洗涤2次,重悬于缓冲液C中;用超声波破碎菌体,处理15 min(15 s 1次,间隔10 s,300 W),离心(4℃,5 000×g,10 min),取上清液,离心(4℃,15 000×g,20 min);用适量的2%TritionX-100溶解沉淀20—30 min,离心(4℃,15 000×g,20 min),用100 μL蒸馏水溶解沉淀,-20℃低温保存备用。
ATCC43889菌体外膜蛋白的测定:采用BCA蛋白浓度测定试剂盒分别测定上述ATCC43889原始对照菌株与3种抗热性菌株外膜蛋白浓度,以缓冲液A将此4种ATCC43889菌株外膜蛋白溶液稀释至5 μg·μL-1,每种菌株取50 μL外膜蛋白溶液与50 μL的蛋白上样缓冲液混合,沸水浴8 min后,对其进行SDS-PAGE电泳,电泳结束后,凝胶经考马斯亮蓝R250染色2 h,待脱色完全电泳条带清晰后,用全自动凝胶成像系统扫描,并采用Image Lab 4.0.1软件进行图像分析。
1.4 数据统计分析
数据处理通过SPSS(version 22.0,SPSS Inc.)软件,数据间的多重比较采用Duncan新复极差法(SSR),数据结果以±SD来表示,P<0.05表示差异显著。
2 结果
2.1 热胁迫对大肠杆菌ATCC43889个体形态的影响
由图1可知,与原始对照菌株ATCC43889相比,经过加热胁迫并转接培养的菌株在扫描电子显微镜下形态变化明显,原始对照菌株ATCC43889的个体形态呈典型的短杆状或球状,外形饱满,表面光滑,大小均匀,比较一致(A1、B1、C1);经50℃热胁迫后,部分菌株由球状体变为长杆状(A2、B2、C2);经60℃热胁迫后的菌株个体形态较50℃热胁迫处理的菌株细长(A3),其表面粗糙(B3)、凹凸、不平整(C3);经70℃热胁迫处理后大部分菌株变成了更细长的杆状(A4),大量的菌株聚集在一起(B4),在较大的放大倍数下,菌体表面呈凸凹不平的无规则形态(C4)。上述研究结果表明,ATCC43889加热胁迫株的个体形态与原始对照菌株相比差异显著,这可能是ATCC43889在热胁迫环境下生存的一种自我保护方式。
2.2 热胁迫对大肠杆菌ATCC43889生物被膜生成能力的影响
细菌生物被膜是指当细菌粘附于接触表面时,其分泌的多糖、蛋白质等物质将其自身包裹、围绕其中形成了大量的细菌聚集膜样物[24]。由图2可知,随着胁迫温度的提高,热胁迫转接菌株的生物被膜生成活力增大,说明其生物被膜生成能力增强,与原始对照菌株相比,差异显著(P<0.05);而60℃和70℃热胁迫转接株的生物被膜生成能力差异不显著(P>0.05),说明ATCC43889在不利的热胁迫环境中可能是通过生成大量的生物被膜来增强其生存能力。有研究者认为[25],几乎所有的细菌都可形成生物被膜,其生成是细菌为适应环境变化及维持生命所发生的变化,生物被膜中的菌体被厚厚的多糖等包裹,在一定程度上增强了细菌对外界环境的抵抗力,是其进行自我保护的一种生存方式。
2.3 热胁迫对大肠杆菌ATCC43889细胞膜脂肪酸组成的影响
为了探明50℃、60℃、70℃的温度胁迫处理对ATCC43889细胞膜脂肪酸组成的影响,本研究以细胞膜脂肪酸中饱和脂肪酸(SFA)、不饱和脂肪酸(USFA)以及饱和脂肪酸与不饱和脂肪酸的比值(S/U)来作为评价指标。ATCC43889原始对照菌株及其分别经50℃、60℃、70℃各10次热胁迫处理并转接10次培养菌株的细胞膜中脂肪酸组成的相对含量见表1,由表1可知,ATCC43889原始对照菌株样品中共检测出14种脂肪酸,分别为C12:0、C13:0、C14:1、C16:0、C16:1、C17:0、C17:1、C18:1n9t、C18:1n9c、C18:2n6t、C18:3n3、C20:0、C21:0和C24:0。与原始对照菌株相比,分别经50℃、60℃、70℃热胁迫处理并转接10次培养的菌株,缺失了3种脂肪酸,分别为C18:1n9c、C18:3n3和C21:0,表明ATCC43889在遭遇到50℃、60℃、70℃热胁迫条件时,此3种脂肪酸在细胞膜中不表达。同时发现,随着热胁迫温度的升高,C13:0、C16:0和C17:0等饱和脂肪酸的含量在增加,而C14:1、C16:1、C17:1、C18:1n9t和C18:2n6t等不饱和脂肪酸的相对含量呈下降趋势。本研究发现,随着胁迫温度的提高,ATCC43889细胞膜中饱和脂肪酸的总含量上升,不饱和脂肪酸的总含量下降,饱和脂肪酸与不饱和脂肪酸的比值升高。S/U越高,表明菌体细胞膜流动性越弱,50℃、60℃、70℃热胁迫菌株细胞膜流动性的降低有利于保证其在高温环境下正常的流动性。ATCC43889抗热性菌株细胞膜的流动性变化是为了更好地适应外界胁迫环境。

图1 ATCC43889原始对照菌株及其热胁迫株在扫描电镜下的个体形态Fig.1 Individual morphology of ATCC43889 original control strain and heat-stressed strains under scanning electron microscope
2.4 热胁迫对大肠杆菌ATCC43889细胞膜磷脂相变温度的影响
差示扫描量热法可用来研究细菌细胞膜磷脂的相变,测定细菌细胞膜磷脂物理状态发生变化时吸收或释放的能量。由图3可知,在每一个热能图中均出现了一个峰,该峰值表示ATCC43889细胞膜磷脂的相变温度,也即磷脂的熔点(Tm);ATCC43889抗热性菌株的热胁迫温度越高,其磷脂的熔点越高。在一定范围内,细胞膜磷脂的熔点越低,膜的流动性越强;细胞膜磷脂的熔点越高,膜的流动性越弱。与对照组菌株相比,ATCC43889抗热性菌株细胞膜流动性的降低有利于其抵抗不利于生存的高温环境。

图2 ATCC43889原始及其对照菌株分别经不同温度热胁迫处理并转接培养其生物被膜生成能力Fig.2 Biofilm-forming ability of ATCC43889 original control strain and the strains which were treated with different temperatures,transfers and incubation, respectively
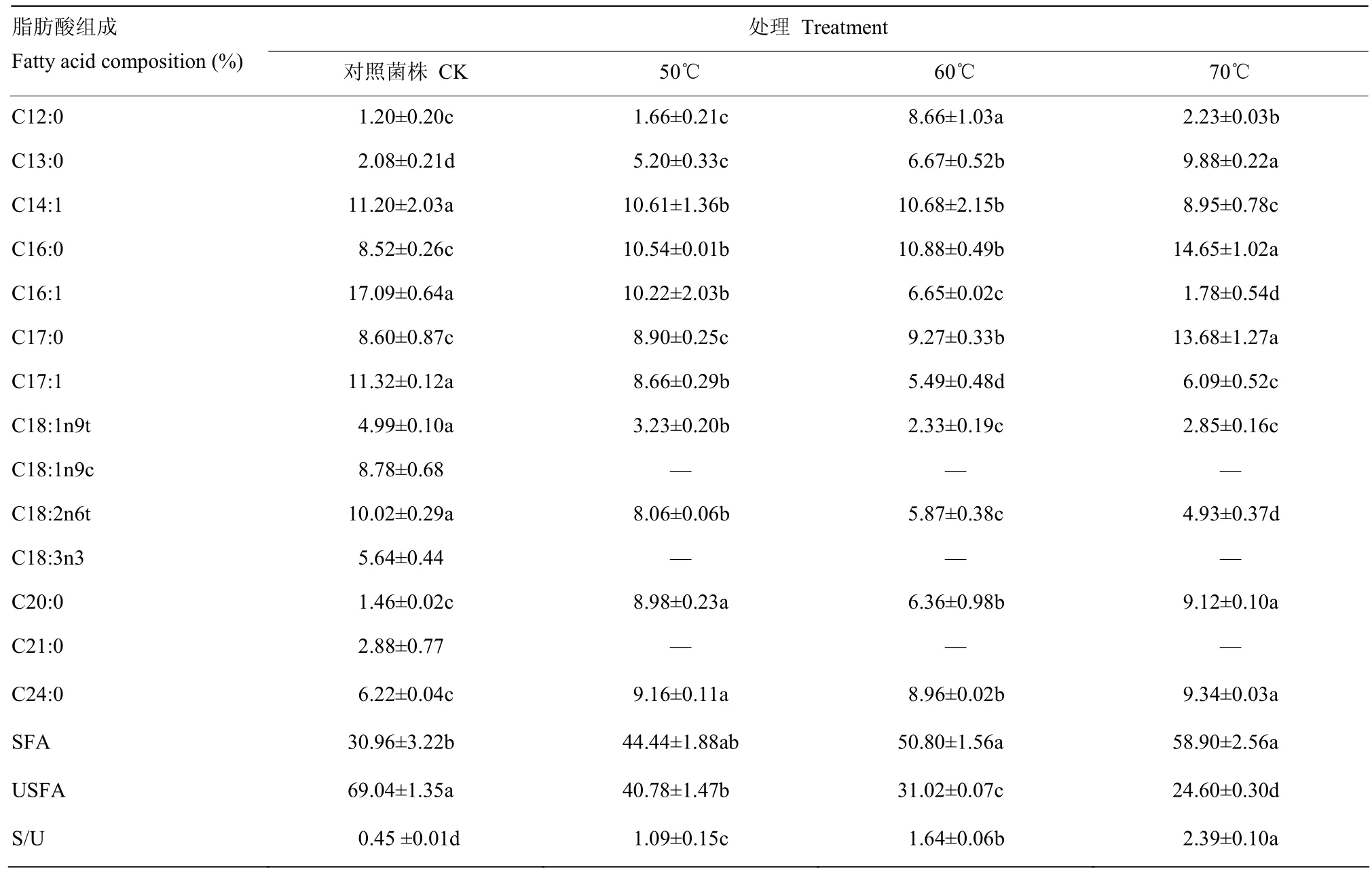
表1 ATCC43889原始对照菌株及其分别经不同温度热胁迫处理并转接培养菌株的细胞膜脂肪酸相对含量Table 1 Membrane fatty acid composition of ATCC43889 original control strain and the strains which were treated with different temperatures, transfers and incubation, respectively
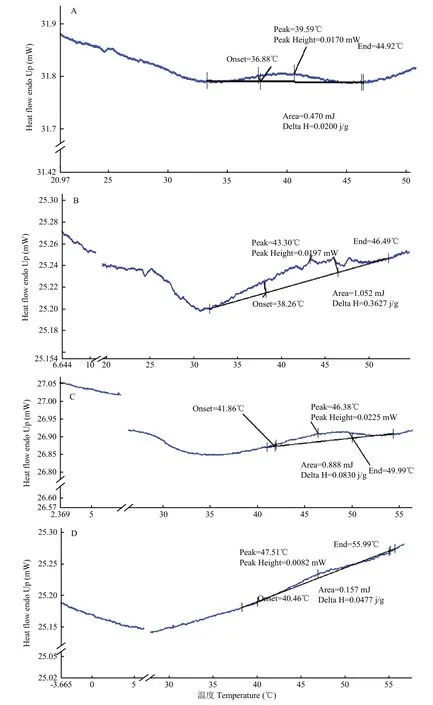
图3 ATCC43889原始对照菌株及其分别经不同温度热胁迫处理并转接培养的菌株细胞膜脂类提取物的差示扫描量热图谱Fig.3 DSC graph for lipids extracted from the whole cells of ATCC43889 original control strain and the strains which were treated with different temperatures, transfers and incubation, respectively
2.5 热胁迫对大肠杆菌ATCC43889外膜蛋白表达的影响
外膜蛋白是革兰氏阴性菌细胞壁外壁层的主要结构成分,对维持细菌细胞结构的稳定,细胞物质的交换及细菌的致病性均起到非常重要的作用[26-27]。本研究所提取的ATCC43889原始对照菌株及其经50℃、60℃、70℃各10次热胁迫处理并转接10次培养后获得的3种抗热性菌株的外膜蛋白,经过SDS-PAGE电泳检测后所得图谱见图4。可知,4种ATCC43889菌株外膜蛋白的分子质量主要分布在35—180 kD,但它们在构成和分布上存在着较大差异。与原始对照菌株相比,分别经50℃、60℃、70℃各10次热胁迫处理并转接10次培养的3种菌株外膜蛋白表达有明显的差异。随着胁迫温度的升高,分子质量在63 kD和75 kD附近的外膜蛋白条带颜色逐渐变深,说明这两种分子量附近的外膜蛋白表达量明显提高;分别经60℃、70℃各10次热胁迫处理并转接10次培养的2种抗热性菌株,在48—75 kD增加了特异条带,说明ATCC43889在这种高温胁迫下产生了某些抗热性蛋白,这些蛋白可能是热胁迫下与应激反应有关的热激蛋白。上述研究结果表明,经50℃、60℃和70℃热胁迫,可诱导ATCC43889一些外膜蛋白表达量的增加和产生热激蛋白。由此推测,由于这些蛋白表达的变化,可及时修复高温对其造成的分子损伤,导致ATCC43889热胁迫菌株中蛋白质合成、能量代谢、DNA复制能够正常进行。最终使ATCC43889抗热性菌株能够在50℃、60℃、70℃高温环境下生存下来;ATCC43889在50℃、60℃、70℃热胁迫作用下,菌体能够启动某些相关基因,以此来表达相关蛋白而达到抗热的目的。
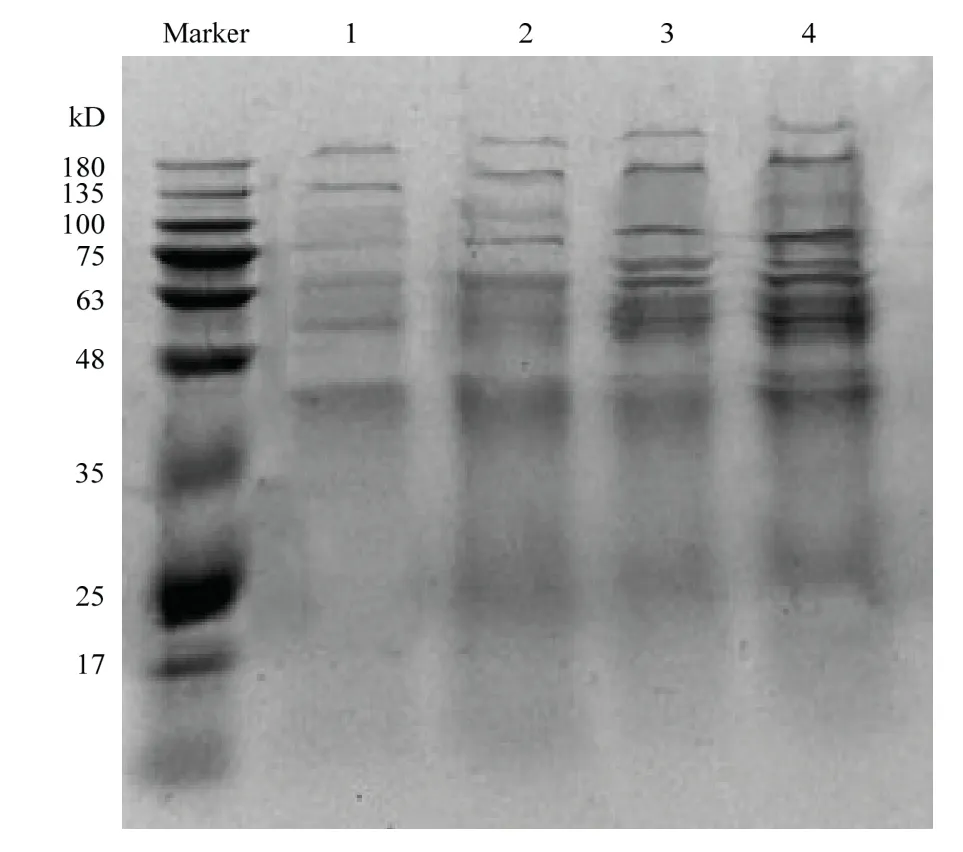
图4 ATCC43889原始对照菌株及其分别经不同温度热胁迫并转接培养的3种菌株外膜蛋白的SDS-PAGE图谱Fig.4 SDS-PAGE of outer membrane proteins of ATCC43889 original control strain and the strains which were treated with different temperatures, transfers and incubation,respectively
3 讨论
3.1 大肠杆菌ATCC43889个体形态变化与其抗热性的关系
刘艳霞等[28]采用不同浓度的维生素B6和维生素E烟酸酯药敏纸片联合影响双歧杆菌生长,通过革兰氏染色和原子力显微镜扫描观察其形态的变化。研究发现,不同浓度维生素B6和维生素E烟酸酯药敏纸片联合胁迫可诱导双歧杆菌个体形态从短杆状变为丝状体。舒文婷[29]也发现,与标准菌株相比,经亚胺培南药物作用的铜绿假单胞菌菌株个体形态变长,主要原因是亚胺培南药物作用使其耐药基因表达导致菌体变长。本研究发现,与原始对照菌株相比,分别经50℃、60℃和70℃各10次热胁迫处理并转接10次培养得到的3种抗热性ATCC43889菌株的个体形态变长,表明高温作用对ATCC43889的个体形态产生较大影响,形态的变长可能使其对热产生抗性。这种菌体形态的变化常常伴随着正常细菌的自溶,它们可能是不利环境的产物,也可能是对这种不利环境有抵抗力的个体,这可能是增加菌体存活稳定性的途径之一[30]。
3.2 大肠杆菌ATCC43889生物被膜生成能力与其抗热性的关系
生物被膜的形成是细菌为了适应生存环境而采取的一种策略。微生物易粘附于含有机物质的食品加工设备表面,形成生物被膜,而生物被膜中的细菌形态结构、生理、生化特性对外界不利环境(pH、温度和渗透压等)的敏感性皆比普通细菌强[31]。高璐等[32]研究了不同胁迫条件对副溶血性弧菌生物学特性的影响,该菌经低渗透压、低pH和高温条件下适应后传代的菌株,其生物被膜生成能力与原始对照菌株相比均增强。本研究也发现,与原始对照菌株相比,3种抗热性ATCC43889菌株生物被膜生成能力明显增强。
3.3 大肠杆菌ATCC43889细胞膜脂肪酸组成与其抗热性的关系
细菌细胞膜是磷脂双分子层,流动的脂质双分子层是生物膜结构的基本特征,适宜的流动性是保证细菌处于正常生理状态的重要条件。本研究发现,3种抗热性ATCC43889菌株细胞膜脂肪酸组成发生了变化,随着热胁迫温度的升高,细胞膜中饱和脂肪酸含量升高,不饱和脂肪酸含量下降,这与有关文献的报道一致[33]。此外,饱和脂肪酸与不饱和脂肪酸的比率可以反映细胞膜的流动性。本研究中,胁迫温度升高,饱和脂肪酸含量升高,不饱和脂肪酸含量降低,饱和脂肪酸与不饱和脂肪酸的比率增加,细胞膜流动性降低,有利于其在高温下保持正常的流动性。LI等[34]研究了冷、盐和碱等应激处理对保加利亚乳杆菌细胞膜组成和冻干存活率的影响,结果发现,应激处理使保加利亚乳杆菌对冻干耐受性增强,细胞膜中生成新物质环丙烷脂肪酸(CFA)。研究证明,环丙烷脂肪酸的生成可提高细胞膜的稳定性,限制酰基链的移动,改变细胞膜的流动性[35]。在本研究中,3种抗热性ATCC43889菌株中是否也合成类似CFA的物质来抵抗不利高温的环境?相关工作有待进一步研究。
3.4 大肠杆菌ATCC43889细胞膜磷脂相变温度与其抗热性的关系
磷脂分子的相变是指在某个温度点时,细胞膜磷脂分子层中脂肪酰链从全反式的高度有序刚性、致密的排列状态突然向高度无序的柔软、疏松排列状态的转变过程。这种转变过程不是渐进的,而是在某个温度时发生突变,该临界温度Tm称之为相变温度[36]。细胞膜磷脂分子相变温度Tm受脂肪酰链饱和程度的影响,饱和度越高,Tm越高。有研究表明,微生物为了适应环境温度的变化,通过改变脂肪酸链的不饱和度、链的长短以及支链与直链比来保持正常细胞膜的流动性,使其与外界进行正常的物质与能量交换[37],这与本研究的结论基本一致。本研究发现,3种抗热性菌株细胞膜中饱和脂肪酸含量升高,不饱和脂肪酸含量下降,Tm升高,膜流动性降低;胁迫温度越高,Tm也越高,膜流动性越弱,有利于其在高温下保持正常的流动性。细胞膜由磷脂双分子层组成,除了起到结构和屏障作用外,还与细胞内外信号转导、交流和能量产生有关。细胞膜在细菌的胁迫抵抗中起重要作用,它能够随环境条件的变化而发生改变,通过控制流动性来维持菌体的正常生理活动,与其生命活动相协调,这种适应性变化可以对细菌的生存起到保护作用。
3.5 大肠杆菌ATCC43889热激蛋白与其抗热性的关系
热激蛋白能够防止蛋白质变性或者帮助己变性的蛋白重新折叠恢复正常的构象,避免热胁迫引起的伤害,对高温胁迫条件下细菌的生存起着至关重要的作用。热激蛋白一旦形成,迅速应对外界胁迫环境表现出的抗热性,是生物对热胁迫适应的必需组成成分。LEYER等[38]研究酸适应胁迫诱导沙门氏菌对热、盐、表面活性剂等的交叉保护作用,结果发现,酸适应可诱导沙门氏菌合成特殊的外膜蛋白,从而增强了其对外界不利环境的抵抗力。本研究发现,3种抗热性ATCC43889菌株某些外膜蛋白表达量和组成也发生变化,这些变化可能是高温胁迫下ATCC43889合成的与热激反应相关的蛋白质。至于这些外膜蛋白到底是通过改变哪些代谢路径来帮助菌体抵抗不利的环境,还有待进一步研究。
4 结论
ATCC43889分别经50℃、60℃和70℃各10次热胁迫处理并转接10次培养后,产生了应激反应,其个体形态、生物被膜生成能力、膜脂肪酸组成、膜流动性和外膜蛋白表达均发生了变化。随着热胁迫温度的升高,其个体形态变长,生物被膜生成能力增强,饱和脂肪酸含量升高,不饱和脂肪酸含量下降,细胞膜流动性减弱,一些外膜蛋白表达量提高、表达种类增加,菌株耐热性增强。综上,ATCC43889在遭遇热胁迫环境时,会通过改变自身个体形态、增强生物被膜生成能力、调整膜脂肪酸组成和膜流动性及外膜蛋白表达来适应不利环境,提高其生存能力。
