耐高糖酵母的筛选及其在黄酒中的应用研究
2020-03-27潘惠丽曹龙辉
潘惠丽 曹龙辉

摘要:从蜂蜜、葡萄、面包3种原料中提取天然酵母进行梯度驯化,再通过紫外诱变育种,筛选出具有耐高糖性质的酵母并对其相关特性进行研究,将筛选出的菌株应用于黄酒酿造过程。结果表明,筛选出的酵母可耐受的糖度、pH值、酒精度分别为40%,1.5和10 %Vol,将其应用于黄酒发酵中,经过7 d发酵后,菌株降糖能力较传统菌株提高了20 g/L,酒精度提高了0.4 %Vol,糖类物质转化率达到11%。采用自然驯化和紫外诱变育种相结合,得到适用于黄酒酿造生产的耐高糖酵母菌株。
关键词:耐高糖酵母;紫外诱变;黄酒;筛选;应用
中图分类号:TS261.1 文献标志码:A doi:10.16693/j.cnki.1671-9646(X).2020.01.001
Abstract:Natural yeast was extracted from honey,grape and bread for gradient domestication,and then the yeast with high sugar tolerance was screened out by UV mutagenesis breeding and its related characteristics were studied. The screened strains were applied to the brewing process of yellow rice wine. The results showed that sugar tolerance of the screened yeast was 40%,1.5 and 10%Vol respectively. It was used in rice wine fermentation. After 7 days of fermentation,the sugar reduction ability of the strain was 20 g/L higher than the traditional strain,and the conversion rate of sugar in 0.4%Vol,which was 11% higher than that of the traditional strain. Using the combination of natural domestication and UV mutation breeding,a high sugar tolerant yeast strain suitable for rice wine brewing and production was obtained.
Key words:high sugar tolerant yeast;UV mutagenesis;yellow rice wine;screening;application
黃酒是中国最古老的酿造酒,广东黄酒是我国黄酒的一个重要分支。广东黄酒主要采用优质糯米和红曲酿造而成,是岭南一带客家人酿造的传统发酵型黄酒,具有独特的风味。传统的广东黄酒糖度偏高,不符合人们对保健养生的追求,而新型的低糖型黄酒口感清淡、糖度较低,更能顺应时代发展的需求。传统黄酒的酿造主要依靠添加外源白酒控制糖化和发酵平衡,酵母无法在耐高渗的环境中生长,导致发酵醪液中糖类物质的转化率不高,酒精产率较低[1]。因此,筛选出一株耐高糖酵母菌株对解决黄酒偏甜腻问题具有十分重要的意义。
目前,耐高糖酵母的选育采用高糖选择性富集技术,为此可以初步筛选出具有耐糖度的酵母菌株,再通过摇瓶发酵试验[2]、梯度驯化[3]、紫外诱变[4-5]、复合诱变[6]等技术手段进行耐高糖酵母菌株的选育,但现有的耐高糖酵母的研究均是针对其耐高糖酵母菌株发酵特性及发酵产物性质,将筛选出的耐高糖酵母应用于实际生产的研究并不多见,而酵母菌发酵性能的优异对黄酒的风味、口感起重要作用,因此筛选得到的具有优良发酵性能的酵母菌株可作为理想的发酵剂用于黄酒的酿造生产中[7]。
试验从蜂蜜、葡萄、面包[8-10]中提取天然酵母菌,通过梯度驯化和紫外诱变选育,最终得到耐高糖的酵母菌株,对其耐受特性和发酵性能进行研究,并将其初步用于黄酒酿造中,以期提高糖类物质的转化率、降低黄酒偏甜腻的口感,为广东低糖型黄酒的酿造工艺提供了一定的参考价值。
1 材料与方法
1.1 材料与试剂
枣花蜂蜜,产自福建省福州市;牛油排包,产自广东省深圳市;黑夏葡萄,产自云南省建水市;葡萄糖(固体)、琼脂粉、生理盐水、无菌水、酒精。
YEPD培养基(酵母浸出粉胨葡萄糖肉汤培养基)[11]:酵母粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,pH值6.5±0.2,于115 ℃下高压灭菌20 min。如用固体培养基,则加入20 g的琼脂。
高糖液体培养基[12]:分别配制10,20,30,35, 40,50,60 °Bx的YEPD培养基(只改变培养基中的葡萄糖浓度),于115 ℃下灭菌20 min,冷却待用。
TTC上层培养基[13]:葡萄糖5 g/L,琼脂15 g/ L,TTC 0.5 g/L。
TTC下层培养基[13]:葡萄糖10 g/L,蛋白胨2 g/L,酵母粉1.5 g/L,磷酸二氢钾1.0 g/L,硫酸镁0.4 g/L,琼脂20 g/L,pH值5.5~5.7,于115 ℃下灭菌20 min。
发酵培养基[4]:葡萄糖200 g/L,酵母粉10 g/L,硫酸铵1 g/L,磷酸二氢钾1 g/L,硫酸镁1 g/L,于115 ℃下灭菌20 min。
1.2 仪器
显微镜,重庆奥特光学仪器有限公司产品;电子天平,常州市衡正电子仪器有限公司产品;恒温培养箱、恒温水浴锅,上海一恒科学仪器有限公司产品;电热炉,山东鄄城华鲁电热仪器有限公司产品;分光光度计,上海佐科仪器仪表有限公司产品;手持折光仪,上海电物理光学仪器有限公司产品;高压灭菌锅,上海博讯实业有限公司医疗设备厂产品。
1.3 试验方法
1.3.1 酵母的提取
取适量的3种样品,经过适当处理后,分别装入已灭菌的含有60~75 mL的糖度为10 °Bx葡萄糖液的250 mL锥形瓶内,静置于28 ℃条件下培养3 d,3 d后取下层液体20 mL转接入含新鲜的10 °Bx葡萄糖液的锥形瓶,同等条件下培养相同时间,完成第2次酵母富集,同理完成第3次酵母富集[3]。
取3个样品的第3次的富集液,分别做10-1,10-2,10-3,10-4,10-5,10-6,10-7等7个稀释度,取10-3,10-4,10-5,10-6稀释度的试管中的液体,移液接入YEPD琼脂培养基中涂布稀释,每个稀释度共做3组平行试验并进行空白对照,倒置平板,放置于28 ℃恒温箱中培养48 h,观察酵母菌形态,并用显微镜观察细胞特征。
1.3.2 酵母菌的梯度驯化
选取11个符合酵母菌形态特征且菌落生长状况较好的酵母菌菌落,在YEPD琼脂培养基上进行平板划线分离,每个样品做3组,划线后的菌株置于28 ℃下培养48 h,观察菌株的形态与生长情况。
在划线分离培养的菌株中筛选出10个生长状况良好的菌种进行划线分离,重复划线至生长出单个菌株后接入YEPD斜面固体培养基,于28 ℃下培养48 h,低温保藏备用[14]。
采用逐步提高培养液糖浓度的方法进行梯度驯化。将平板筛选阶段挑取的单菌落转接入含10 °Bx葡萄糖的YEPD液体试管培养基中,置28 ℃条件下培养3 d,3 d后从各试管中分别吸取0.1 mL的菌悬液,再次转接入新鲜的含10 °Bx葡萄糖的YEPD液体培养基试管中,28 ℃条件下培养3 d,如此重复 3次。10 °Bx糖浓度驯化试验结束后,同样步骤先后在20~60 °Bx的YEPD液体培养基中进行酵母菌的驯化处理[3,12]。
1.3.3 梯度驯化后还原糖含量的测定
采用李环等人[15]测定还原糖含量的DNS法对梯度驯化后的YEPD液体培养基中还原糖含量进行测定,可得到准确性符合分析要求的还原糖含量,于波長520 nm处测定驯化后培养基中还原糖含量[16],初步得到一批耐高糖度的酵母菌株,保藏菌种待用。
1.3.4 酵母的紫外诱变
选取初步得到的耐高糖酵母菌株,在90 mm无菌培养皿中加入5 mL制备好的酵母菌悬液进行紫外诱变处理。诱变参数[4]为紫外灯15 W,照射距离 20 cm,处理时间为30,40,50,60,70 s。
1.3.5 诱变后耐高糖酵母的筛选
(1)耐糖试验。取诱变后的酵母菌悬液,分别接种于35,40 °Bx 的YEPD培养基与35 °Bx的YEPD琼脂培养基,于28 ℃恒温培养箱中黑暗条件下培养3~4d,观察诱变后菌株的形态与生长情况。用手持折光仪测其残糖量,筛选出生长状况良好且残糖量低的酵母菌种。
(2)产酒精特性测定。接种上述YEPD培养基中的菌液划线至TTC下层培养基,于28 ℃恒温箱中培养1 d,倒入TTC上层培养基,继续黑暗培养2~ 3 h后观察平板菌落颜色。TTC能与酵母代谢产物结合发生显色反应,颜色由浅红色至深红色,产酒精能力越强的菌株颜色越红[13]。利用TTC平板显色反应可以初步判定酵母菌的产酒精能力,选择菌落颜色为深红的酵母菌株用于下一步试验。
(3)产气能力测定。将上述筛选出的菌株按5%的接种量接种到带有杜氏小管的YEPD培养基试管中,于28 ℃恒温箱中恒温培养,每隔2 h观察1次杜氏小管内充气情况,当气体填满杜氏小管时停止观察,选择出气体充满杜氏小管时间较短的的菌株[4]。
(4)CO2失重测定。将经过产气能力测定的菌种,接种至装有发酵培养基的锥形瓶中,于28 ℃恒温振荡培养,每隔1 d称量并记录数值。计算培养基发酵液减少的质量,当前后2 d培养基发酵液的质量差值小于0.2 g时,可以判断为发酵完成,停止培养[4]。
1.3.6 酵母菌株的耐受性试验
(1)酒精耐受性能测定。在每根灭菌后冷却至室温的YEPD培养基试管中分别加入乙醇,使培养基的酒精度分别为6%,8%,10%,12%,14%,16%Vol,再分别将最终筛选的待试菌株接种到试管中,于28 ℃下恒温培养,经过36 h后测定并记录OD600 nm值。
(2)耐酸性能测定。将YEPD培养基中pH值分别调至1.5,2.0,2.5,3.0,3.5,4.0,灭菌后冷却至室温,再分别将最终筛选的待试菌株接种到培养基中,放置在28 ℃恒温箱中恒温培养,36 h后测定并记录OD600 nm值。
(3)高糖耐受性能测定。将YEPD培养基灭菌后冷却至室温,将培养基中葡萄糖质量分数分别调至30%,35%,40%,45%,50%,55%,再分别将最终筛选的待试菌株接种到试管中,放置在28 ℃恒温箱中恒温培养,36 h后测定并记录OD600 nm值。
1.3.7 耐高糖酵母发酵性能试验
黄酒生产的一般流程如下:选择糯米为原料→洗米、浸米→蒸饭→摊饭→加入红曲、麦曲、酒药拌曲搭窝→加入水、酵母等进行前发酵处理→后发酵→过滤澄清→煎酒→灭菌→成品黄酒。
按照上述工艺完成黄酒前发酵流程,在前发酵第2天分别加入0.5g传统黄酒酵母与诱变菌种,测定糖度和酒精度;发酵第7天后再次测定其糖度和酒精度,进行对比。
2 结果与分析
2.1 天然酵母镜检的形态观察
筛选10个菌株的显微镜观察形态见表1。
经过富集培养筛选出菌落生长状况良好的培养基,得到10个符合酵母菌生长特点的培养基。其中从葡萄中提取的菌落为乳白色,边缘整齐规则,有明显隆起,菌落面积小;从面包与蜂蜜中提取的菌株菌落为乳白色,边缘不整齐,有微小波浪形曲折,无明显突起,菌落面积大。挑取上述菌落进行显微镜观察发现,3种来源的菌株呈卵圆形或圆形,符合酵母菌细胞的形态特征。该形态分析结果与王昌魁、李伟安等人[3,12]对酵母菌形态分析的结果相同,由此可以判断3种来源的菌株为酵母菌株。
2.2 酵母菌梯度驯化结果
将筛选出的10株酵母菌株,10-3面包、10-4面包、10-3葡萄1.1、10-3葡萄1.2、10-4葡萄2.1、10-4葡萄2.2、10-5葡萄、10-6葡萄、10-4蜂蜜3.1、10-4蜂蜜3.2,将其分别编号为MB-1.1,MB-2.1,PT-1.1,PT-1.2,PT-2.1,PT-2.2,PT-3.1,PT-4.1,FM-1.1,FM-1.2。梯度驯化后,在糖度为10 ,20,30 °Bx的培养基中均有酵母菌的生长,在40 °Bx的培养基中酵母菌生长缓慢,菌落面积小,且测得的残糖与原培养液中糖度相差不大甚至不变,而在糖度为50,60 °Bx的培养基中酵母菌基本不生长。因此,通过梯度驯化可以得到耐受糖度为30 °Bx的酵母菌株。
通过DNS法测得的残糖量。葡萄糖的浓度与吸光度存在一定的线性关系,测定得到的葡萄糖标准溶液其回归方程为Y = 11.446X - 0.011 3,R2 = 0.999 2,线性关系良好。
葡萄糖标准溶液见表2,葡萄糖标准曲线见图1。
按1.3.3测定残糖,得到表3的数据。可得到各个样品溶液的吸光值与所测得的还原糖含量,原培养液中的还原糖含量为0.138 2 mg/100 mg,各个样品酵母菌株分解葡萄糖能力为52.5%~92.9%,其中PT-2.2的还原糖含量为0.009 8 mg/100 mg,含糖量最低,因此该菌株的还原糖分解利用率最高。根据测定所得样品的还原糖含量,发现FM-1.1,MB- 1.1,MB-2.1,PT-1.2,PT-2.2这5个菌株具有较低的还原糖含量。因此,筛选得到耐糖度较高的FM- 1.1,PT-2.2及MB-1.1这3个酵母菌株,用于下一步的紫外诱变育种筛选。
样品溶液的吸光度与还原糖含量见表3。
2.3 耐糖与产酒精特性试验结果
紫外诱变后的酵母菌株经过耐糖性试验,可在35 °Bx的YEPD培养基和YEPD琼脂培养基内生长,而在40 °Bx的YEPD琼脂培养基上酵母菌的生长情况较差;在产酒精试验中,得到的菌种均为深红色,无明显差别,即菌株都有较好的产酒精性能。对35 °Bx的YEPD培养基中酵母菌进行糖度测定。
不同菌种35 °Bx培养基的残糖量见表4。
由表4可看出,PT-2.2紫外驯化40 s,FM-1.1紫外驯化40 s,MB-1.1紫外驯化50 s的菌种残糖量最少,紫外诱变的最优时间为40~50 s。将上述3个残糖量最少的菌株分别编号为PT-2.2-40,FM-1.1- 40,MB-1.1-50,用于下一步酵母菌株发酵特性检测试验。
2.4 产气能力测定结果
产气能力见图2。
由图2可知,按5 h的产气量排序,顺序大小为FM-1.1-40>PT-2.2-40>MB-1.1-50,且3个菌株都可在10 h充满小管。根据排气量测定结果,FM-1.1- 40与PT-2.2-40这2个酵母菌株的产气能力更强。
2.5 CO2最大失重的测定结果
CO2最大失重见图3。
由图3可知,CO2失重随时间变化呈增长趋势,各酵母菌株的CO2最大失重依次为FM-1.1-40> PT-2.2-40>MB-1.1-50,其中前3 d,每日的CO2最大失重呈线性相关,其斜率可以反映失重的速度,因此每日CO2最大失重速率的菌株依次为FM-1.1-40,PT- 2.2-40,MB-1.1-50,最终发酵结束后各个菌株的失重依次为4.8,4.6,4.5 g。可见各个菌株的CO2最大失重相差不大,同时用于下一步的耐受性试验。
2.6 酒精耐受性測定结果
酵母耐酒精试验见图4。
由图4可见,酵母菌的生长活力受酒精度的影响,随着酒精度的提高而逐渐下降,当酒精度大于10%Vol时FM-1.1-40,PT-2.2-40,MB-1.1-50菌株的生长均受到了抑制,而FM-1.1-40菌株的抑制程度略小于PT-2.2-40菌株和MB-1.1-50菌株,因此其耐酒精的能力比其他2个菌株要高,在酒精度为7%Vol时3个菌株的耐受度都表现良好。
2.7 耐酸性能的测定结果
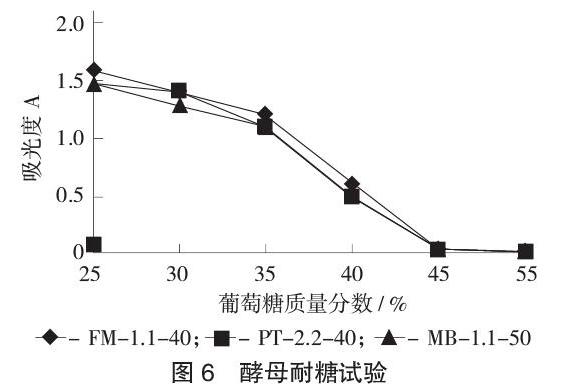
酵母耐糖试验见图5。
酵母菌最适pH值一般在4.5~5.5,此范围的酸性环境下酵母菌有着较强的发酵能力,但当酵母菌在过低pH值的情况下其生长会受到抑制作用。
由图5可知,PT-2.2-40菌株,FM-1.1-40菌株,MB-1.1-50菌株在pH值2.5~4.0时均能正常生长,但当pH值≤2.0时,其生长受到一定的抑制,几乎停止生长,而FM-1.1-40受抑制程度会比其他2个菌株的低,因此其耐酸性的能力较强。
2.8 高糖耐受性测定结果
酵母耐糖试验见图6。
由图6可知,PT-2.2-40菌株,FM-1.1-40菌株,MB-1.1-50菌株在含糖量为25%时生长速度是比较快的,当葡萄糖质量分数增加时各菌种的生长均会受到一定的抑制,糖度越高,生长速度越慢,FM-1.1-40菌株在葡萄糖质量分数升高的过程中受到抑制的程度略小于其他2个菌株。当葡萄糖质量分数达到45%的时候,菌株停止生长。综合上述结果,最终通过筛选得到FM-1.1-40酵母菌株作为黄酒酿造过程中的发酵菌株。
2.9 诱变菌种与传统菌种黄酒发酵试验的对比结果
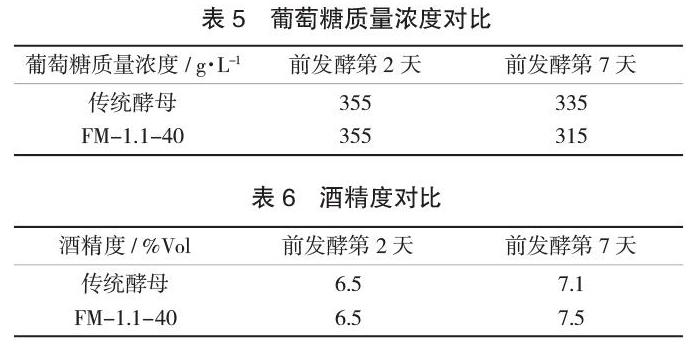
葡萄糖质量浓度对比见表5,酒精度对比见表6。
将筛选出的FM-1.1-40酵母菌株与传统酵母同时应用到黄酒酿造过程,对比发现前发酵第7天FM-1.1-40酵母菌株利用糖发酵产生酒精的能力比传统酵母的能力要高,可知驯化的酵母较传统酵母具有更优的降糖产酒精能力,后期将继续探究耐高糖酵母菌株应用于黄酒的酿造工艺的研究,进而生产一批低糖黄酒产品。
3 结论
以蜂蜜、葡萄、面包3种原料进行酵母菌富集菌株,通过梯度驯化与紫外诱变相结合的手段选育耐高糖且发酵特性优良的酵母菌株,经过相关性能研究获得具有耐高糖性能的酵母菌株FM-1.1-40,其最大耐受糖度为40%,耐受酒精度为10%Vol,可在pH值1.5的条件下生长。将筛选出的耐高糖酵母菌株应用到黄酒酿造过程中,糖类物质转化率提高11%,酒精度提高0.5%。因此,耐高糖酵母在黄酒降糖关键技术方面具有良好的应用价值,可考虑进一步应用于黄酒工业化的酿造过程。
参考文献:
李晓珺,白卫东,曹龙辉,等. 低糖型黄酒的研究开发与发展思考[J]. 中国酿造,2015,34(3):11-15.
齐向辉,王旭,林静,等. 耐高糖酵母的筛选鉴定及其产多元醇分析[J]. 食品与发酵工业,2014,40(10):16-21.
王昌魁,张利莉,贺江舟,等. 耐高温耐高糖酵母的筛选与驯化[J]. 江西农业学报,2008(5):100-101,109.
陈忠军,忻胜兵,杨小冲,等. 具有耐糖特性高发酵度酵母的紫外选育及其特性研究[J]. 食品科技,2018, 43(1):2-7.
陈英. 耐高糖酿酒酵母菌株的筛选及性状诱发基因的功能研究[D]. 南宁:广西大学,2018.
杜毓容,殷文政,黄靖然,等. 紫外-硫酸二乙酯复合诱变选育耐高渗(高糖)酵母菌[J]. 食品工业科技,2017,38(15):50-54.
杨昳津,俞剑燊,夏永军,等. 优良黄酒酵母的筛选及其抗逆性能分析[J]. 现代食品科技,2015,31(8):261-267.
Farideh Siavoshi,Marzieh Sahraee,Hoda Ebrahimi,et al. Natural fruits,flowers,honey,and honeybees harbor Helicobac-ter pylori positive yeasts[J]. Helicobacter, 2018, 23(2):140-143.
冯涛,王旭增,王一非,等. 葡萄园土壤中酿酒酵母的分离鉴定及其发酵葡萄酒香气成分分析[J]. 食品科学,2018,39(14):213-220.
王立,虞桠芳,钱海峰,等. 天然酵母面包研究现状及发展趋势[J]. 食品与机械,2016,32(9):201-208.
王志恒,冯翠娥,王冲,等. 宁夏玉泉营地区酿酒葡萄酵母菌的分离篩选及分子鉴定[J]. 中国酿造,2018,37(1):112-115.
李伟安,唐圣云,王戎,等. 酿酒酵母菌的耐高糖驯化研究[J]. 酿酒科技,2011(12):54-55.
胡晓冰,王振伟. TTC法在筛选西瓜果酒酵母中的应 用[J]. 酿酒科技,2011(2):69-70,73.
张莉,张兰,张玉,等. 酿酒酵母菌株的筛选与发酵特性分析[J]. 河南农业科学,2018,47(6):144-148.
李环,陆佳平,王登进. DNS法测定山楂片中还原糖含量的研究[J]. 食品工业科技,2013,34(18):75-77.
廖祥兵,陈晓明,肖伟,等. DNS法定量测定还原糖的波长选择[J]. 中国农学通报,2017,33(15):144-149. ◇
