25 ℃下Mg2+,NH4+//Cl-,SO42--H2O四元体系等温蒸发介稳相平衡研究
2020-03-26秦亚欠赵晓玲刘秀伍郭宏飞曹吉林
秦亚欠,赵 斌,赵晓玲,刘秀伍,郭宏飞,曹吉林
(河北省绿色化工与高效节能重点实验室,河北工业大学 化工学院,天津 300130)
1 引 言
硫酸镁是一种重要的无机化工产品,广泛应用于医药、轻工、食品、印染、化学和农业等领域,其产量的90% 是作为镁肥使用[1-2]。如今制取肥料级硫酸镁的方法有硫酸法[3]、盐湖苦卤法、苦卤复晒法、震荡转化法等[4]。其中,盐湖苦卤法与其他方法相比,具有工艺简单,成本较低,对环境友好等优点[5]。
中国青海柴达木盆地以其丰富的氯化钾和氯化镁著称,然而在利用盐湖氯化钾资源生产硫酸钾产品过程中,大量氯化镁资源没有得到有效利用。柴达木地区拥有风大,干旱,雨量少,蒸发量大的有利气候条件[6]。为了经济地开发盐湖的矿产资源,充分利用当地自然资源,介稳相平衡对于预测盐湖实际蒸发路径变得至关重要。所以,针对 Mg2+,NH4+//Cl-,SO42--H2O稳定相图指导氯化镁与硫酸铵反应制备无氯钾肥时,存在母液蒸发能耗大,成本高,生产工艺复杂等的问题,作者提出直接利用盐湖资源中氯化镁与硫酸铵转化反应生产硫酸镁铵复合肥的新思路。目前文献已经报道了0、25和60 ℃ 时Mg2+,NH4+//Cl-,SO42--H2O的稳定相平衡数据[7-8],但是该水盐体系的介稳相平衡研究还未见报道。鉴于此,本文对25 ℃ 时Mg2+,NH4+//Cl-,SO42--H2O四元体系介稳相平衡及其应用进行了研究。
2 实 验
2.1 实验试剂
实验所用的(NH4)2SO4,MgCl2·6H2O、MgSO4·7H2O、NH4Cl及分析所用试剂均为分析纯试剂,纯度均≥ 99%,详细的药品信息见表1。实验中用水均为二次蒸馏水,电导率小于5 μS⋅cm-1。

表1 所用药品厂家及纯度Table 1 Chemicals used in the study
2.2 实验方法
本实验采用等温蒸发法[9]。根据盐在25 ℃下水溶液中的溶解度和三元子体系的共饱点组成,计算出所需盐和去离子水的含量,并将其混入洁净干燥的聚乙烯容器(长18 cm,宽15 cm,高7 cm)中。在盐完全溶解后,容器被放置在恒温蒸发箱中进行等温蒸发实验。实验条件为相对湿度 30%~40%、温度(25±0.1) ℃。当有足够固相出现时,用钥匙从溶液中取出湿渣混合物。为了进一步识别析出的固相,需在自然条件下晾干并研磨成粉末,然后通过X射线衍射分析(XRD)来确定固相的晶体形态和共饱点。同时,通过吸液管从液相中取出约5 mL溶液,称量并定容至250 mL的容量瓶中,用于对液相的化学分析。剩下的溶液被继续蒸发,并达到一个新的介稳平衡点。重复上述同样的过程,直到溶液完全蒸发。
2.3 分析方法
EDTA络合滴定法[10]测定Mg2+的含量;甲醛滴定法测定NH4+的浓度[11];硫酸钡重量法[12-13]测定SO42-的浓度;硝酸银滴定法[14]测定Cl-的含量。固相鉴定采用湿渣法测定各离子含量并结合XRD确定共饱点。
3 结果与讨论
3.1 25 ℃时(NH4)2SO4-MgSO4-H2O体系的介稳相图
表2为25 ℃等温蒸发过程中获得的(NH4)2SO4-MgSO4-H2O三元体系介稳相平衡数据,依据表2数据绘制的介稳相图见图1。
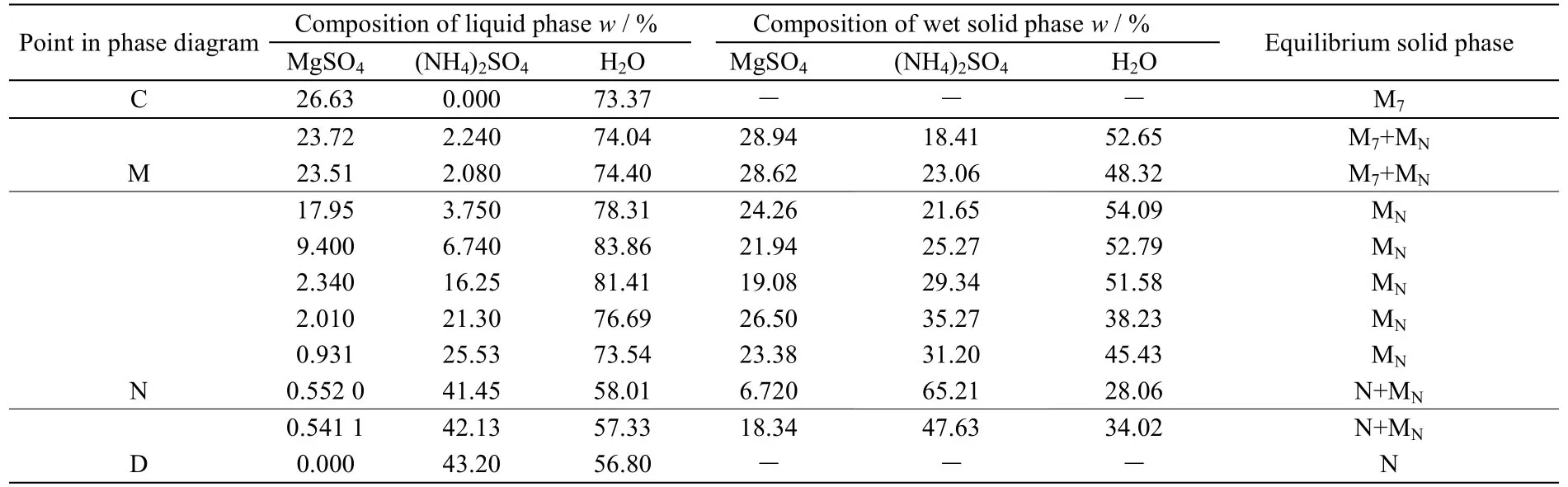
表2 25 ℃时(NH4)2SO4-MgSO4-H2O三元体系介稳相平衡数据Table 2 Metastable phase equilibrium data of the (NH4)2SO4-MgSO4-H2O ternary system at 25 ℃

图1 25 ℃时(NH4)2SO4-MgSO4-H2O三元体系介稳相图Fig.1 Metastable phase diagram of the (NH4)2SO4-MgSO4-H2O system at 25 ºC

图2 MgSO4·(NH4)2SO4·6H2O 的 XRD 谱图Fig.2 XRD pattern of the solid MgSO4·(NH4)2SO4·6H2O
参考张菁等[15]对四元体系 0 ℃ 时 Na2SO4-MgSO4-(NH4)2SO4-H2O的相平衡研究可知 25 ℃ 时MgSO4和(NH4)2SO4可以形成新的复盐 MgSO4·(NH4)2SO4·6H2O。图2 为 MgSO4·(NH4)2SO4·6H2O 的XRD谱图。
由图1可知,25 ℃ 时 MgSO4-(NH4)2SO4-H2O三元体系存在 2个共饱点、5个结晶区。点 M 为MgSO4·7H2O 和 MgSO4·(NH4)2SO4·6H2O 的共饱点,点 N 为(NH4)2SO4和 MgSO4·(NH4)2SO4·6H2O 的共饱点。结晶区分别为:MgSO4·7H2O 结晶区 EMCE,MgSO4·7H2O 和 MgSO4·(NH4)2SO4·6H2O 共结晶区 EFME,MgSO4·(NH4)2SO4·6H2O 结晶区 MNFM,(NH4)2SO4和 MgSO4·(NH4)2SO4·6H2O 共结晶区 ANFA,(NH4)2SO4结晶区ADNA。
3.2 25 ℃时MgCl2-MgSO4-H2O体系的介稳相图
表3为25 ℃ 等温蒸发过程中获得的MgCl2-MgSO4-H2O三元体系介稳相平衡数据,依据表3数据绘制的介稳相图见图3。图4为依据稳定相平衡数据[16]绘制的该体系稳定相图。

表3 25 ºC时MgCl2-MgSO4-H2O三元体系介稳相平衡数据Table 3 Metastable phase equilibrium data of the MgCl2-MgSO4-H2O ternary system at 25 ºC
由图3可知,25 ℃时MgCl2-MgSO4-H2O三元体系存在3个共饱点,7个结晶区。点L为MgSO4·7H2O和 MgSO4·6H2O 的共饱点,点 H 为 MgSO4·6H2O 和 MgSO4·5H2O 的共饱点,点 G 为 MgSO4·5H2O 和MgCl2·6H2O 的共饱点。ILDI为 MgSO4·7H2O 结晶区,JHLJ为 MgSO4·6H2O 结晶区,JLIJ为 MgSO4·7H2O和 MgSO4·6H2O 共结晶区,KHGK 为 MgSO4·5H2O 结晶区,KHJK 为 MgSO4·6H2O 和 MgSO4·5H2O 共结晶区,KGFK为MgSO4·5H2O和MgCl2·6H2O共结晶区,FGEF为MgCl2·6H2O结晶区。

图3 25 ºC时三元体系MgCl2-MgSO4-H2O的介稳相平衡相图Fig.3 Metastable phase diagram of the MgCl2-MgSO4-H2O system at 25 ºC
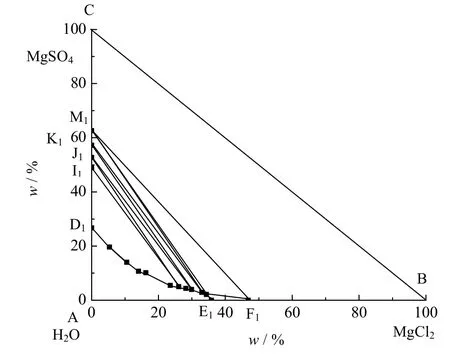
图4 25 ºC时三元体系MgCl2-MgSO4-H2O的稳定相平衡相图Fig.4 Stable phase diagram of the MgCl2-MgSO4-H2O system at 25 ºC
由图3和4对比25 ℃ 下三元体系MgCl2-MgSO4-H2O的稳定和介稳相图可知:介稳相图较稳定相图少1个共饱点,在介稳条件下,MgSO4·4H2O相区消失;在介稳相图中MgSO4·7H2O的相区明显变小,MgSO4·7H2O和MgSO4·6H2O的共结晶区明显变大。
图5为该三元体系共饱点对应的平衡固相的 XRD谱图。由谱图可知共饱点 G对应的平衡固相为MgSO4·5H2O和MgCl2·6H2O,共饱点H对应的平衡固相为MgSO4·6H2O和MgSO4·5H2O,共饱点L对应的平衡固相为 MgSO4·7H2O 和 MgSO4·6H2O。


图5 共饱点对应的平衡固相的XRD谱图Fig.5 XRD patterns of the equilibrium solid phase of the MgCl2-MgSO4-H2O ternary system
3.3 25 ℃时Mg2+,NH4+//Cl-,SO42--H2O体系的介稳相图
表4为25 ℃ 等温蒸发过程中获得的Mg2+,NH4+//Cl-,SO42--H2O四元体系介稳相平衡数据,依据表4数据绘制的介稳相图见图6。

表4 25 ºC时Mg2+, NH4+//Cl-, SO42--H2O四元体系介稳相平衡数据Table 4 Metastable phase equilibrium data of the Mg2+, NH4+//Cl-, SO42--H2O quaternary system at 25 ºC
由图6可知,25 ℃ 时Mg2+,NH4+//Cl-,SO42--H2O四元体系存在6个共饱点和8个结晶区。结合图7平衡固相对应的XRD谱图,由图可知,点 P1为 NH4Cl、(NH4)2SO4和MgSO4·(NH4)2SO4·6H2O 的共饱点,点 P2为MgCl2·NH4Cl·6H2O 、 MgSO4·(NH4)2SO4·6H2O和 NH4Cl的共饱点,点 P3为 MgSO4·7H2O、MgCl2·NH4Cl·6H2O 和 MgSO4·(NH4)2SO4·6H2O的 共 饱 点 ,点 P4为 MgSO4·6H2O、MgCl2·NH4Cl·6H2O 和 MgSO4·7H2O 的共饱点,点 P5为 MgSO4·6H2O、MgCl2·NH4Cl·6H2O 和MgSO4·5H2O 的共饱点,点 P6为 MgCl2·6H2O、MgCl2·NH4Cl·6H2O 和 MgSO4·5H2O 的共饱点,结晶区分别为:(NH4)2SO4结晶区 AKP1JA,MgSO4·(NH4)2SO4·6H2O 结晶区 KP1P2P3LK,NH4Cl 结晶区 JP1P2IBJ,MgCl2·NH4Cl·6H2O 结晶区P2P3P4P5P6HIP2,MgSO4·7H2O 结晶区 LDEP4P3L,MgSO4·6H2O 结晶区 EFP5P4E,MgSO4·5H2O 结晶区FGP6P5F,MgCl2·6H2O 结晶区 CGP6HC。

图6 25 ºC Mg2+,NH4+// Cl-,SO42- - H2O 四元体系介稳相图Fig.6 Dry salt metastable phase diagram of the Mg2+,NH4+//Cl-,SO42- - H2O quaternary system at 25 ºC

图7 共饱点对应的平衡固相的XRD谱图Fig.7 XRD patterns of the equilibrium solid phase of the Mg2+,NH4+//Cl-,SO42--H2O quaternary system
对比25 ℃下Mg2+,NH4+//Cl-,SO42--H2O四元体系的稳定[17]和介稳相图(见图8)可知:介稳相图较稳定相图少 1个共饱点,在介稳条件下,MgSO4·4H2O相区消失;在介稳相图中,NH4Cl相区变小,MgSO4·(NH4)2SO4·6H2O 和 MgSO4·7H2O 的相 区 明 显 变 小 ,MgSO4·6H2O 和MgSO4·5H2O的相区明显变大。
3.4 溶解度计算
3.4.1 活度系数关联式
目前,计算多组分水盐体系相平衡溶解度数据多采用Pitzer电解质溶液理论[18-19]。本文以Pitzer电解质溶液热力学模型理论为基础,对Mg2+,NH4+//Cl-,SO42--H2O四元体系及其子体系进行了溶解度的计算。
设一个溶液中含有nwkg的水和ni、njmol的i、j溶质离子,则此体系中总的超额Gibbs自由能的表达式[20]:

图8 25 ℃时Mg2+,NH4+//Cl-,SO42--H2O四元体系介稳和稳定相图Fig.8 Comparison of the metastable and stable phase diagrams of the Mg2+,NH4+//Cl-,SO42--H2O quaternary system at 25 ℃

将式(1)分别对ni、nA求偏导数,可得到电解质平均活度系数γMX的通式:

由式(1)~(4)可知,如若两、三离子作用参数θ、ψ已知,便可求的各个电解质的活度系数和水的活度。文献中[21]已给出25 ℃ 各电解质Pitzer参数数值(见表5)。
3.4.2 溶解度计算结果
根据实验所测得的 Mg2+,NH4+//Cl-,SO42--H2O四元体系及(NH4)2SO4-MgSO4-H2O,MgCl2-MgSO4-H2O三元子体系的介稳相平衡数据,依据同一温度时相同平衡固相的活度相等的原理,可关联出离子相互作用参数。计算结果见表6。
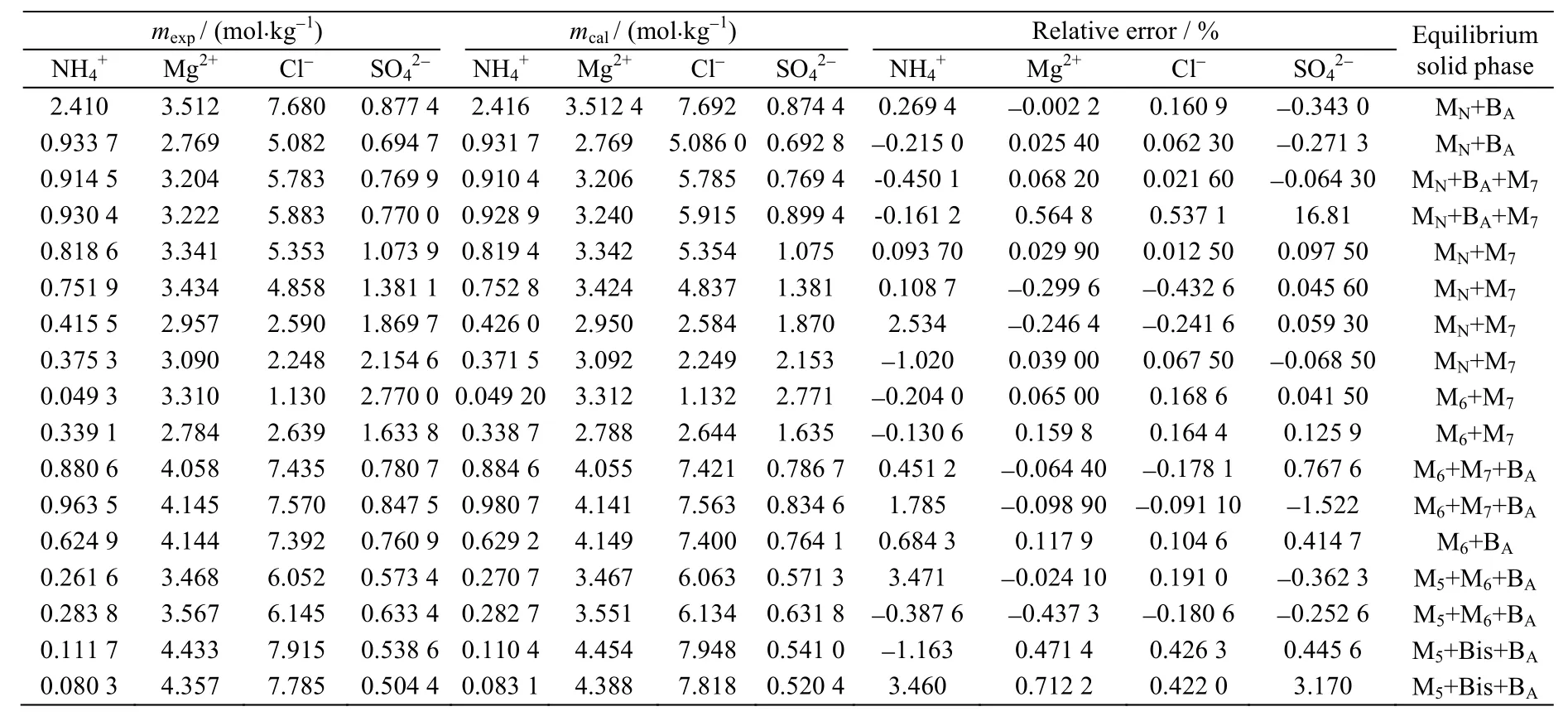
根据回归得到的离子相互作用参数(表 6)和公式(1)-(4),可以计算出Mg2+,NH4+//Cl-,SO42--H2O 四元体系及(NH4)2SO4-MgSO4-H2O,MgCl2-MgSO4-H2O三元子体系的介稳溶解度数据。结果见表7~9。表7~9数据表明,基本上溶解度的计算值与实验值是一致的,说明以Pitzer计算模型来预测该体系的溶解度数据是可行的[22]。

表5 (NH4)2SO4 MgSO4 NH4Cl MgCl2 Pitzer参数Table 5 Pitzer parameters of (NH4)2SO4, MgSO4, NH4Cl and MgCl2

表6 Pitzer离子相互作用参数Table 6 Pitzer interaction parameters
3.5 25 ℃时Mg2+,NH4+//Cl-,SO42--H2O四元体系介稳相图应用
将 25 ℃ 时 Mg2+,NH4+//Cl-,SO42--H2O体系介稳相图和稳定相图绘制在同一个图,如图8所示。
由图8可以看出,无论是在介稳或者稳定条件下,MgSO4·(NH4)2SO4·6H2O 都有很大的结晶区,并且两种条件下NH4Cl的结晶区有明显的差异,这都有利于以 MgCl2、(NH4)2SO4为原料生产氮镁复肥的工艺路线的设计。因此,本文设计了以 MgCl2、(NH4)2SO4为原料生产氮镁复肥的循环工艺路线。
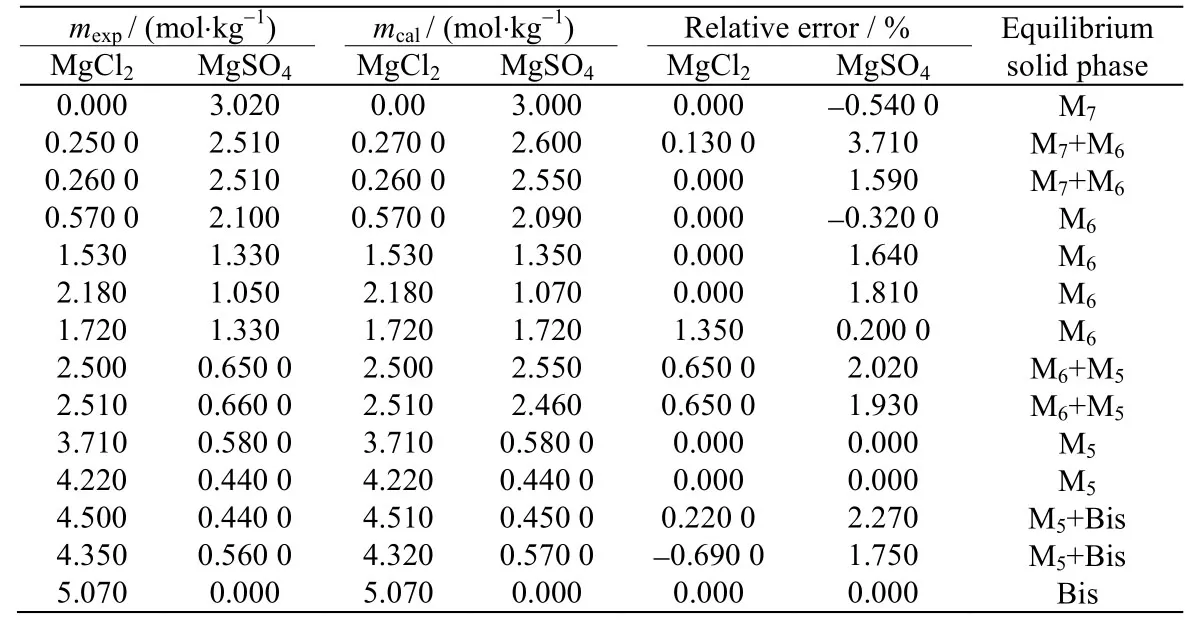
表7 25 ℃ MgCl2-MgSO4-H2O体系的溶解度实验值和计算值Table 7 Calculated and experimental solubility values of the MgCl2-MgSO4-H2O system at 25 ℃

表8 25 ℃ (NH4)2SO4-MgSO4-H2O体系的溶解度实验值和计算值Table 8 Calculated and experimental solubility values of the(NH4)2SO4-MgSO4-H2O system at 25 ℃

表9 25 ℃ Mg2+,NH4+//Cl-,SO42--H2O体系的溶解度实验值和计算值Table 9 Calculated and experimental solubility values of the Mg2+, NH4+//Cl-, SO42- - H2O system at 25 ℃
be continued
MgSO4·(NH4)2SO4·6H2O组成点在25 ℃四元体系干盐图上(图8)为MN。当向MgCl2中加入一定量的水和(NH4)2SO4后,体系的干盐组成点就落在 AC线上,且随着(NH4)2SO4加入量增大,体系点沿着CA由 C向 A移动。根据杠杆规则,当混合体系组成点为 M 时,析出固相后液相组成点为接近稳定体系MgSO4·(NH4)2SO4·6H2O 与 NH4Cl共饱线上的 a点时,在 25 ℃搅拌状态下进行等温溶解,析出的为MgSO4·(NH4)2SO4·6H2O固相。按照相图所标注的体系点M位置,经过稳定相平衡实验可测得剩余母液a的组成。
从体系M中分离出MgSO4·(NH4)2SO4·6H2O固相后,剩余溶液组成点a落在了介稳相图的NH4Cl的结晶区内,继续在25 ℃静态不搅拌条件下等温蒸发,则会有NH4Cl固相析出,a体系蒸发过程中液固相组成按介稳相图的规律变化。当液相点组成变化到接近介稳相图的MgSO4·(NH4)2SO4·6H2O与NH4Cl共饱线上b点时,停止等温蒸发,对应析出的NH4Cl被分离出去,剩余液相b为饱和溶液。当加入一定量的MgCl2和H2O搅拌溶解后体系点为N,N点落在稳定相图MgSO4·(NH4)2SO4·6H2O的结晶区里和MNa线上,在25 ℃搅拌状态下进行等温溶解,析出的为MgSO4·(NH4)2SO4·6H2O固相,剩余饱和溶液组成点为a。
4 结 论
(1) 测定了 25 ℃ 时 Mg2+,NH4+//Cl-,SO42--H2O 四元体系及(NH4)2SO4-MgSO4-H2O、MgCl2-MgSO4-H2O三元子体系的介稳相平衡数据,绘制了介稳相图,并将稳定和介稳相图进行了比较分析。由相图可知,25 ℃ 时(NH4)2SO4-MgSO4-H2O体系存在2个共饱点,5个结晶区;MgCl2-MgSO4-H2O体系存在3个共饱点,7个结晶区;Mg2+,NH4+//Cl-,SO42--H2O体系存在6个共饱点和8个结晶区,结晶区分别为:(NH4)2SO4结晶区,MgSO4·(NH4)2SO4·6H2O 结晶区,NH4Cl结晶区,MgCl2·NH4Cl·6H2O 结晶区,MgSO4·7H2O 结晶区,MgSO4·6H2O 结晶区,MgSO4·5H2O 结晶区,MgCl2·6H2O 结晶区。
(2) 利用 Pitzer模型对 Mg2+,NH4+//Cl-,SO42--H2O 四元体系及(NH4)2SO4-MgSO4-H2O、MgCl2-MgSO4-H2O三元子体系的介稳相平衡数据进行了理论计算。结果表明,计算值与实验值相吻合。通过对25 ℃ 下Mg2+,NH4+//Cl-,SO42--H2O四元体系介稳和稳定相图的比较分析,确定了在25 ℃ 下以MgCl2和(NH4)2SO4为原料,通过蒸发结晶过程生产硫酸镁铵复肥的工艺路线。
符号说明: