缺血预处理星形胶质细胞GDNF抑制p38MAPK 信号通路减轻神经元凋亡
2020-03-26李昕华徐晓燕刘艳华
李昕华,徐晓燕,刘艳华
(长春市中心医院,吉林 长春130051)
在神经元缺血损伤中星形胶质细胞通过多种途径起着内源性保护作用[1],缺血预处理能调动内源性保护机制,对后续的致死性缺血产生耐受[2,3]。胶质细胞源性神经营养因子(GDNF)对神经元的增殖、凋亡和轴突形成、突触发生及突触的可塑性等许多方面起调节作用,对受损的中枢神经系统神经元有着很强的保护作用[4,5]。本课题组前期研究发现缺血预处理后星形胶质细胞分泌GDNF增加,本实验通过提取缺血预处理后的星形胶质细胞培养基制备条件培养基(ACM),沉默GDNF基因后制备另一种条件培养基,利用不同的ACM孵育缺血预处理神经元,检测神经元凋亡及p38MAPK、p-p38MAPK的蛋白表达,探讨在缺血预处理中星形胶质细胞分泌GDNF的脑保护作用及作用机制。
1 材料和方法
1.1 材料
Wistar大鼠购自吉林大学动物实验中心。高糖DMEM 干粉培养基、胎牛血清及马血清购自美国GIBCO公司,EGFP表达质粒购自武汉晶赛生物技术公司,AnnexinV-FITC、PI购自南京凯基生物科技发展有限公司,兔抗单克隆p38 MAPK一抗、兔抗单克隆p-p38 MAPK一抗购自美国Cell Signaling公司,辣根过氧化物酶标记羊抗兔二抗购自美国Santa Cruz公司。
1.2 大鼠皮层神经元及星形胶质细胞氧糖剥夺模型制备
见本课题组前期研究[6,7]。
1.3 制备条件培养基并孵育神经元后测定神经元凋亡
取正常培养的星形胶质细胞培养基,离心15 min后取上清,即为ACM1;前期实验研究发现[8],OGD预处理及再缺血后星形胶质细胞分泌GDNF在再灌注24 h表达最高,取这一时间点的星形胶质细胞培养基,离心15 min后取上清,即为ACM2;利用EGFP表达质粒沉默GDNF基因,转染的星形胶质细胞缺血再灌注24 h后GDNF沉默效果最佳,选取此时的培养基,离心15 min后取上清,即为ACM3。将神经元分为对照组、预处理组、预处理+缺血组、缺血组四组,分别用3种条件培养基孵育4组神经元,24小时后AnnexinV-FITC/PI双标记流式细胞术(FCM)测定神经元凋亡率。将神经元用0.125%胰酶消化成单细胞悬液,取1 ml细胞悬液,离心弃上清后加入Binding Buffer 500 μl重悬,加入5 μl AnnexinV-FITC,混匀后加入5 μl PI ,反应15 min后用流式细胞仪检测。Cellquest软件分析结果,计算凋亡细胞的百分率。
1.4 神经元 p38MAPK、p-p38MAPK的检测
Western Blot法检测神经元p38MAPK、p-p38MAPK的表达,上述四组神经元用3种条件培养基孵育24小时后用Western blot法检测。将神经元用PBS洗涤2次,裂解细胞后收集上清蛋白质,用考马斯亮兰G250试剂盒测定蛋白浓度。配制SDS-PAGE胶,将蛋白加入加样槽后电泳,转膜,封闭,将第一抗体按1∶800稀释后加入放置NC膜的封闭袋中4℃静置过夜。将第二抗体按1∶1000稀释后放入封闭袋中,37℃孵育1 h。按照北京中杉金桥生物试剂公司的DAB显色试剂盒说明书进行操作,用凝胶图像分析系统扫描电泳结果,进行吸光度分析,计算p38MAPK、p-p38MAPK与GAPDH光密度的比值,得出蛋白质水平。
1.5 统计学分析

2 结果
2.1 各组神经元凋亡率检测结果
正常对照组和预处理组均可见极少量的坏死细胞和凋亡细胞,加入3种不同的ACM后凋亡率变化不明显(P>0.05)。预处理+缺血组和缺血组神经元凋亡率明显高于正常对照组和预处理组(P<0.05),加入ACM2后凋亡率较ACM1和ACM3两组均明显降低,差异有统计学意义(P<0.05)。结果见表1、图1。

表1 AnnexinV-FITC/PI FCM检测神经元凋亡率(n=36,%)
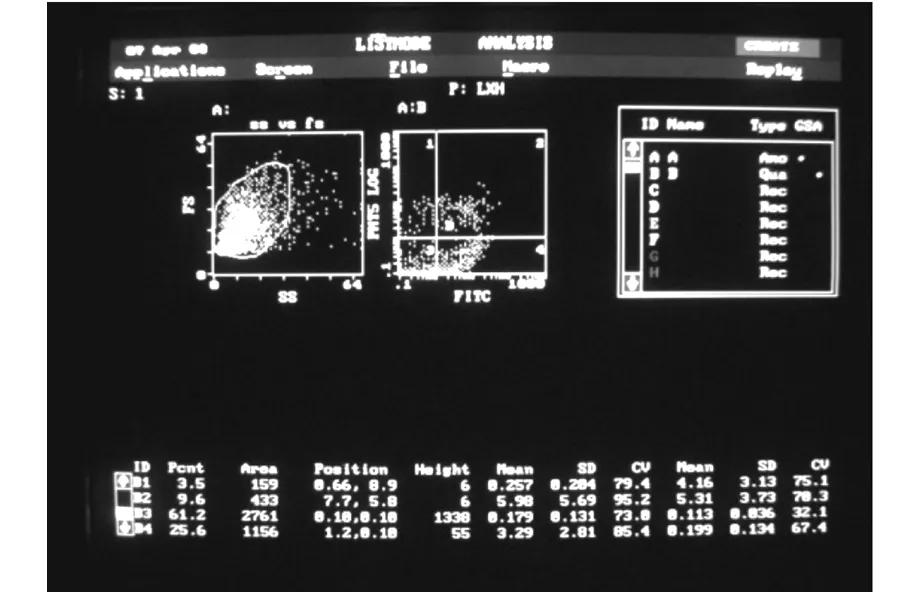
图1 ACM2预处理+缺血组FCM,可见神经元凋亡和坏死,早期神经元凋亡率较ACM3组低
2.2 各组神经元 p38MAPK蛋白表达
每组神经元的p38MAPK蛋白表达均无明显变化(P>0.05),结果见表2。
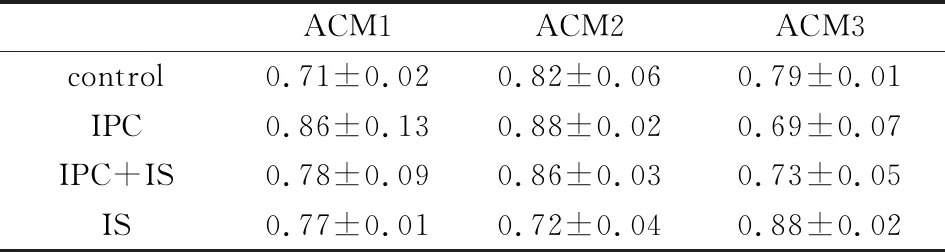
表2 神经元p38MAPK表达(n=36,%)
2.3 各组神经元p- p38MAPK的蛋白表达
预处理+缺血组及缺血组p- p38MAPK的蛋白表达均明显高于照组和预处理组,在任何一种条件培养基培养下都是如此表达趋势,差异有统计学意义(P<0.05)。预处理+缺血组p- p38MAPK的蛋白表达均较缺血组低,在任何一种条件培养基培养下都是如此表达趋势,差异有统计学意义(P<0.05)。加入ACM2组的p- p38MAPK蛋白表达低于ACM1和ACM3两组,ACM3组的表达较ACM1组稍高,但统计无显著性差异(P>0.05)。结果见表3,图2。

表3 神经元p-p38MAPK表达(n=36,%)

图2 ACM2孵育后各组神经元p-p38MAPK表达
3 讨论
缺血缺氧既可引起神经细胞坏死,也可造成神经细胞的大量凋亡[9]。本实验利用AnnexinV-FITC/PI双标记FCM检测凋亡率,结果表明神经元氧糖剥夺后发生坏死及凋亡,缺血缺氧通过诱导神经元凋亡及坏死从而产生脑损伤,而神经元坏死不可逆,因此,抗神经元凋亡在防治缺血性脑损伤可能发挥重要作用。ACM2能显著减少缺血神经元的凋亡,说明预处理使星形胶质细胞分泌GDNF通过减少神经元凋亡发挥脑保护作用。
丝裂素活化蛋白激酶(MAPK)包括ERK通路、 p38MAPK通路、c-jun氨基末端激酶通路等。p38 MAPKs因通过细胞外应激和细胞内因子刺激而激活,故被称为应激激活蛋白激酶,p38 MAPK信号通路与脑缺血再灌注损伤及神经系统退行性疾病有密切关系[10,11]。p38 MAPK经过典型的3级激酶级联反应磷酸化激活p38(p-p38MAPK),随即作用于其下游因子或蛋白:tau蛋白、NFAT、ATF-2/6、PRAK等[11],影响靶基因的转录或翻译,调节中枢神经系统的多种病理、生理过程。组织或细胞发生缺血再灌注损伤时可见多种细胞因子参与,而细胞因子的产生与p38MAPK激活密切相关,再灌注产生的氧化物能激活p38MAPK,进而增加细胞因子的产生,造成组织或细胞缺血再灌注损伤,p38MAPK抑制对缺血再灌注损伤起到保护作用[12]。研究显示,p38MAPK信号通路在神经元凋亡过程中起重要调控作用,激活p38MAPK信号通路可促进神经元凋亡,抑制p38MAPK信号通路可抑制神经元凋亡,减轻脑损伤[13]。本实验发现在对照组、预处理组、预处理+缺血组及缺血组中神经元p38MAPK均无变化,在任何一种培养基中的表达也均恒定,但在预处理+缺血组及缺血组p- 38MAPK的蛋白表达均增多,说明在神经元缺血及缺血预处理后p38MAPK通过级联反应活化为p-p38MAPK从而参与细胞凋亡。在任何一种条件培养基培养下预处理+缺血组p-p38MAPK均较缺血组低,提示缺血预处理通过激活p38MAPK信号通路减轻神经元凋亡发挥脑保护作用。加入ACM2组的p-p38MAPK蛋白表达低于ACM1和ACM3两组,说明缺血预处理后星形胶质细胞分泌GDNF抑制p38MAPK信号通路的激活从而减少神经元凋亡,起到神经保护作用。
