EBNA2基因在霍奇金淋巴瘤中的表达及临床意义
2020-03-26王佳选李冰玉
王佳选, 李冰玉, 李 迅
(新疆医科大学第三临床医学院乳腺内科, 乌鲁木齐 830011)
霍奇金淋巴瘤(HL)是恶性淋巴瘤中的一种,但该病的发病原因目前尚不明确。既往研究表明HL的发生除与遗传易感性、饮食习惯等有关,还与EB病毒(EBV)感染密切相关[1]。根据现有的研究资料,EB病毒相关的肿瘤呈现地域分布趋势的原因尚未明了,目前一致认为这种现象可能与病毒自身、周围环境和(或)遗传等因素有关[2],但也有研究认为不同地区不同的EBV亚型也可能与EBV相关肿瘤的发生相关[3]。EB病毒核心抗原2(EBNA2)作为EBV感染B细胞后最先表达的蛋白之一,是B细胞转化所必需的,在EBV相关肿瘤发生中发挥重要的作用[4]。同时Qu等[5]实验也证明EBNA2能促进B淋巴细胞的生长和增殖。关于EBNA2基因的研究,目前多集中于鼻咽癌人群高发地区[6],本研究采用不同标本检测EBNA2基因,并分析EBNA2基因在EBV阳性HL中的表达及临床意义。
1 材料与方法
1.1 一般资料选取2017年1月-2018年12月就诊于新疆医科大学第三临床医学院且病理诊断为EB病毒编码RNA(EBER)阳性HL患者36例的全血及蜡块标本,其中男性22例(61.1%)、女性14例(38.9%),男女比例为1.57∶1;年龄范围9~74岁,中位年龄36岁;对所有患者全血标本及蜡块切片标本进行EBNA2基因检测。
1.2 HL相关预后因素判定标准根据德国HL研究组(GHSG) 关于早期HL的不良预后标准进行分组,标准如下:血沉增快(血沉≥30 mm/h,伴有 B 症状;血沉≥50 mm/h)、大肿块及大纵隔(大肿块定义为肿块直径>10 cm,大纵隔定义为纵隔肿瘤最大横径与第 5、6 胸椎间胸廓横径之比>35%)、结外病变、受累区域>2个,分为早期有不良预后因素组(含有任意一个不良预后标准的早期霍奇金淋巴瘤)和早期无不良预后因素组。根据国际预后评分(IPS)标准对晚期HL进行危险分层,标准如下:男性、年龄≥45 岁、白细胞计数≥15×109/L、淋巴细胞绝对计数<0.6×109/L 或淋巴细胞比例<8%、白蛋白水平<40 g/L、血红蛋白水平<105 g/L、Ann Arbor Ⅳ期。其中每含1个危险因素计1分,按分数高低可分为晚期低危组 (IPS评分0~1分)、晚期中危组(IPS评分2~4分)和晚期高危组(IPS评分≥5分)。
1.3 仪器与试剂主要仪器:高速冷冻离心机(上海力申科学仪器有限公司 Nefμqe 15R);核酸蛋白定量仪(北京凯奥 K5500);PCR仪(ABI 9700);测序仪(ABI 3730xl)。主要试剂:反式2K DNA标记(全式金 BM101);全血基因组DNA提取试剂盒(北京君诺德生物技术有限公司2503C);反式快速Taq DNA聚合酶(全式金 L20621)。
1.4 研究方法取病人外周血标本4 mL,EDTA抗凝,采用蛋白酶K消化法和异丙醇法提取细胞DNA。石蜡包埋组织DNA的提取均按照QIAamp DNA FFPE组织试剂盒 (QIAGEN GmbH, Hilden, Germany) 说明进行,采用酚-氯仿-异戊醇法常规提取DNA。采用巢式PCR技术对编码片段的基因序列进行扩增:F22-5′“ACGGTCCCCGACTGTATTTTAT”3′,R22-5′“TTTTGGCAAGCCTTCCTT”3′,反应体系为25 μL,包括2×PCR混合 12.5 μL,Primer F(10 μmol/L) 0.5 μL,Primer R(10 μmol/L) 0.5 μL,模板DNA 1.0 μL,无水核酸酶10.5 μL。PCR反应程序为:94℃初始退火3 min,94℃脱脂30 s、57℃退火30 s、72℃延伸90 s,共扩增35个循环,72℃最后延伸5 min,4℃下冷却。提取的DNA经琼脂糖电泳检测DNA的完整性,合格的DNA A260/A280为1.7 ~ 2.0,同时电泳时基因组应该在2000 bp以上有一条单一明亮的电泳条带。本研究所获基因序列均使用Chromas软件查看峰图文件。
1.5 统计学分析数据分析由SPSS 23.0软件完成,采用卡方检验检测EBNA2基因与EBV阳性HL患者各临床特征间的关系。P<0.05为检验水准,差异具有统计学意义;若理论频数<5时,应用确切概率法。
2 结果
2.1 全血及蜡块标本检测EBNA2基因结果本实验所有的测序片段都是用F22/R22引物扩增的,EBNA2 PCR扩增产物长度为788 bp(图1)。本实验36例EBV阳性的HL患者全血样本中,共12例检测出EBNA2(33.3%),其余24例全血标本未检出(图2)。36例EBV阳性的HL患者蜡块样本中,共3例检测出EBNA2样本(8.3%),其余33例蜡块标本均未扩增成功(图3)。
2.2 EBNA2基因表达与HL临床特征关系鉴于本实验蜡块中检出阳性标本较少,仅选取全血标本进行统计分析,结果示:EBNA2基因表达与EBV阳性HL患者性别、Ann Arbor 分期、病理组织学类型、有无巨大肿块和风险评分组差异均无统计学意义(P>0.05),见表1。
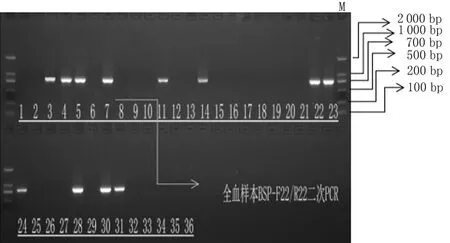
图1 EBNA2 PCR扩增产物基因序列部分图谱
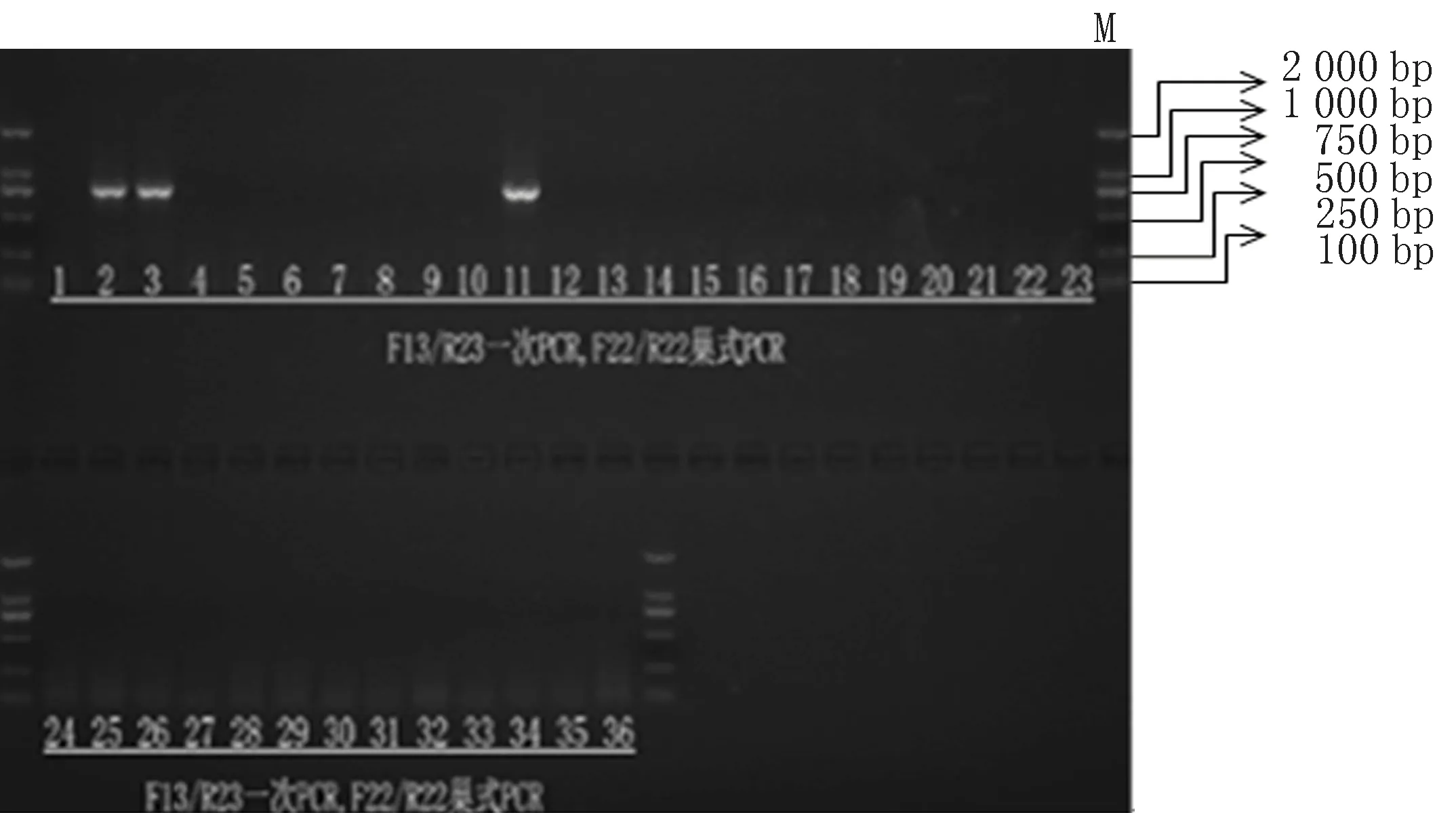
图2 全血标本中EBNA2 PCR扩增结果

图3 蜡块标本中EBNA2 PCR扩增结果

表1 EBNA2基因与EBV阳性HL临床特征的关系
3 讨论
HL占淋巴瘤的9%~10%,是一组疗效相对较好的恶性淋巴瘤,其5年生存率超过85%[7]。李喜等[8]研究发现EBV与多种类型淋巴瘤发病密切相关,EBV诱导的B细胞可以通过转化改变内源性逆转录病毒元件的活性,从而影响宿主基因调控网络和致癌潜力[9]。已有研究发现,EBNA2在干扰EBV感染细胞的免疫原性方面起主导作用[10]。路素丽[11]研究发现EBNA2在正常人淋巴细胞不表达,在转化细胞和诱发淋巴瘤细胞中阳性表达。Qu等[12]研究发现EBNA2能促进B淋巴细胞的生长和增殖,在EB病毒诱导的疾病中起着重要作用。
路素丽等[13]采用免疫组织化学法在HL蜡块组织中发现有EBNA2表达。Palma等[14]使用巢式PCR方法在墨西哥HL蜡块标本中检测出EBNA2。同时文献[15-17]在鼻咽癌不同标本中均成功检测出EBNA2基因。Lee等[18]在对肿瘤患者的B淋巴母细胞系研究中发现EBNA2的血清学分型结果与基因分型结果完全一致。本研究采用巢式PCR方法于EBV阳性的HL患者不同样本中检测出EBNA2基因,其中全血和蜡块标本分别检出12例、3例,表明EBNA2基因可在EBV阳性的HL中表达。但本实验结果低于Palma等[14]研究HL中EBNA2检出率70.8%。高于路素丽等[13]研究在恶性淋巴瘤中EBNA2检出率10%。总体来看,本实验EBV阳性HL患者全血标本EBNA2基因的检测可能优于蜡块标本。
在现有标本下,本实验表明EBNA2基因的表达与EBV阳性HL患者性别、Ann Arbor 分期、病理组织学类型、有无巨大肿块、风险评分组差异均无统计学意义。这与Salahuddin等[19]研究EBNA2基因型与HL的组织学类型差异无统计学意义(P=0.82)相符。与舒君等[20]研究EBNA2的阳性表达率与淋巴瘤患者的性别和年龄差异无统计学意义相符,与肿瘤的组织类型及临床分期差异有统计学意义(P<0.05)。同时舒君等[20]研究表明淋巴瘤的发生可能与EBNA2基因多态性具有一定相关性。Stuhlmann等[21]研究发现,EBNA2基因表达阳性的弥漫大B细胞淋巴瘤(DLBCL)患者的总生存率明显低于EBNA2阴性的DLBCL患者。目前有关EBNA2基因与HL相关性的研究较少,但由于本实验标本较少、标本保存条件不恰、血液或组织标本留置时间过长、EBNA2突变率大及检测技术局限等原因可能影响结果,需扩大样本及更精确的实验,期望后续本试验能进一步探索EBNA2基因在HL中的作用。
