PC12细胞氧糖剥夺不同时间段再灌注后内质网应激及细胞凋亡
2020-03-25郑菊刘雨霞张文萍吴昌学李毅齐晓岚官志忠肖雁
郑菊 刘雨霞,2 张文萍 吴昌学 李毅 齐晓岚 官志忠 肖雁
(1贵州医科大学分子生物学重点实验室 地方病与少数民族疾病教育部重点实验室,贵州 贵阳 550004;2赣南医学院赣南医学炎症与免疫中心;3贵州医科大学学报编辑部)
血管性痴呆(VD)指各种脑血管疾病引起的脑功能障碍而产生引起的后天性智力障碍综合征,占老年痴呆的49%,发病率仅次于阿尔茨海默病〔1〕。脑卒中后缺血-再灌注(I/R)是诱发VD的主要原因之一。脑缺血主要是神经元供应的能量减少,低能量破坏神经元正常蛋白质的折叠,导致蛋白质在内质网中未折叠或错误折叠,未折叠或错误折叠的蛋白质一旦累积,它们将激活跨膜受体以诱导未折叠的蛋白反应(UPR)和内质网应激(ERS)〔2〕。对于这种疾病,恢复血液供应通常作为主要治疗方法,然而,恢复血液供应不可避免地导致I/R损伤〔3〕。目前,脑I/R损伤主要包括以下几个方面:酸中毒,氧自由基释放,细胞内钙超载,氧化应激,细胞凋亡和炎症性损伤再灌注期间损伤也能导致UPR及ERS。研究证实未折叠反应能够缓解ERS,但是当UPR不能缓解ERS时会引起细胞凋亡甚至死亡〔4〕。本研究中我们对肾上腺髓质嗜铬细胞瘤(PC12)细胞体外构建氧糖剥夺(OGD)再灌注(OGD/R)模型,模拟脑I/R损伤的神经元损伤,观察神经元内质网关键蛋白葡萄糖蛋白(GRP)78和蛋白激酶R样内质网激酶(PERK)及凋亡蛋白半胱氨酸蛋白酶(caspase)-3随着OGD不同时间段再灌注24 h的变化,探讨OGD/R后ERS的发生与细胞凋亡的关系。
1 材料与方法
1.1材料
1.1.1细胞 大鼠PC12细胞系购自中国科学院上海生命科学研究所。
1.1.2试剂 改良伊戈尔高糖培养基(DMEM)高糖培养基、无糖的DMEM、0.25%胰酶消化液均购自Gibco公司;胎牛血清购自BI公司;GRP78抗体、caspase-3抗体及辣根过氧化物酶(HRP)标记的抗兔二抗均购于CST公司;聚氰基丙烯酸正丁酯(BCA)蛋白定量试剂、超敏电化学发光液(ECL-Plus)购于Thermo Fisher Scientific公司;Annexin V-FITC、PI凋亡试剂购于BD公司;聚偏氟乙烯(PVDF)膜购于Millipore公司;细胞裂解液(RAPI)及蛋白酶抑制剂(PMSF)均购自CST公司。4',6-二-2-苯基吲哚(DAPI)购自碧云天。
1.1.3仪器 ELX800UV 酶标仪,Bio-Tec公司;Western印迹跑胶装置电源,北京百晶科技公司;GeneGnome XRQ 化学发光成像仪,SYNGENE公司;FACS Verse 流式细胞仪,BD公司;正置荧光显微镜,日本尼康。
1.2方法
1.2.1PC12细胞培养及分组 按89∶10∶1(DMEM∶血清∶双抗)比例配成完全培养基,取冻存的PC12细胞悬液加入含有3 ml完全培养基培养瓶中,置于37℃,5%CO2培养箱中培养,24 h换液。培养2~4 d传代;待第二代细胞均匀铺满80%,取1×106个/孔种板于6孔板中。待第三代PC12细胞处于对数生长期时对细胞进行OGD/R。根据OGD的时间不同,将细胞分为五个组:control、3 h/24 h(OGD 3 h再灌注12 h)组、6 h/24 h(OGD 6 h再灌注24 h)组、9 h/24 h(OGD 9 h再灌注24 h)组、12 h/24 h(OGD 12 h再灌注24 h)组。
1.2.2PC12细胞OGD/R模型制备 49.5 ml无糖DMEM中添加入500 μl双抗,配成含有1%双抗的无糖培养基。取对数生长期细胞进行OGD:弃去板内完全培养基,1×磷酸盐缓冲液(PBS)洗2次,再用无糖培养基洗1次,每孔加入无糖培养基2 ml。将六孔板置于37℃,1%O2,5%CO2,94%N2的三气培养箱中进行OGD(control组用1×PBS洗后每孔加入2 ml完全培养基,置于37℃,5%CO2培养箱中培养),剥夺相应的时间段(3、6、9、12 h)后,弃去无糖培养基,1×PBS洗3次,换2 ml完全培养基,置于37℃,5%CO2培养箱中复糖复氧培养24 h。
1.2.3细胞凋亡率检测 模型制备好后,根据流式试剂盒说明书处理细胞,用预冷的1×PBS洗2次,不含二氨基乙烷四乙酸(EDTA)的胰酶消化细胞,收集细胞。1×PBS洗涤细胞离心1 000 r/min/5 min后弃掉上清液,用蒸馏水将10×结合缓冲液稀释为1×结合缓冲液,向每管细胞中加入100 μl 1×结合缓冲液,然后向每管细胞中分别加入5 μl Annexin V-FITC及5 μl PI,PI单染组加入5 μl PI,Annexin V-FITC单染组加入5 μl FITC,所有细胞均避光染色15 min。最后向每管细胞中加入400 μl 1×结合缓冲液,混匀过滤并1 h内上机。
1.2.4Western印迹检测细胞中GRP78、PERK、caspase-3的表达 模型制备同上,用预冷的1×PBS洗3次,每个孔加入100 μl的裂解液,用双蒸水将10×RAPI稀释为1×RAPI,按PMSF:RAPI=1∶100的比例加入PMSF,放在冰上裂解1 h,14 000 r/min离心10 min收集上清液。BCA蛋白定量法测定蛋白浓度,运用Western印迹法检测各组细胞中GRP78、PERK、caspase-3蛋白表达水平及其内参的蛋白表达情况,GeneGnome XRQ中曝光,Image J软件分析条带灰度值。
1.2.5免疫荧光检测 将PC12细胞以5×104个/孔种植在放有爬片的12孔板中,待细胞长到80%后模型制备同上。用预冷的1×PBS洗3次并用4%的多聚甲醛固定15 min。然后用0.25%Triton X-100使细胞通透10 min,室温下用1×PBS缓冲液配置3%牛血清白蛋白封闭30 min。将细胞加入GRP78(1∶200)抗体4℃孵育过夜,次日孵育荧光二抗1 h,洗涤载玻片并用DAPI染色细胞核,最后正置荧光显微镜下拍摄荧光图片。
1.3统计学方法 采用SPSS22.0软件进行方差分析,Spearman相关分析。
2 结 果
2.1OGD/R后PC12细胞中GRP78蛋白的表达 用OGD/R模拟I/R损伤,检测不同时间段中细胞GRP78蛋白的表达水平来反映ERS,选取了OGD 5个不同时间段(0、3、6、9、12 h,其中0 h是control组)并再灌注24 h。Western印迹结果显示,β-actin为内参,与control组相比较,6 h/24 h、9 h/24 h、12 h/24 h这三个时间段的GRP78蛋白的表达水平明显增加(P<0.01,P<0.05),6 h/24 h组GRP78蛋白的表达水平升高最为明显,表明OGD/R成功诱导ERS。与3 h/24 h组相比较,6 h/24 h、9 h/24 h、12 h/24 h组的GRP78蛋白表达水平增加(P<0.01,P<0.05)。在此结果的基础上,挑选control组和6 h/24 h组做免疫荧光,用正置荧光显微镜直接观察GRP78蛋白的表达量,与control组比较,6 h/24 h组中GRP78蛋白的表达量增多。见图 1、图2及表1。
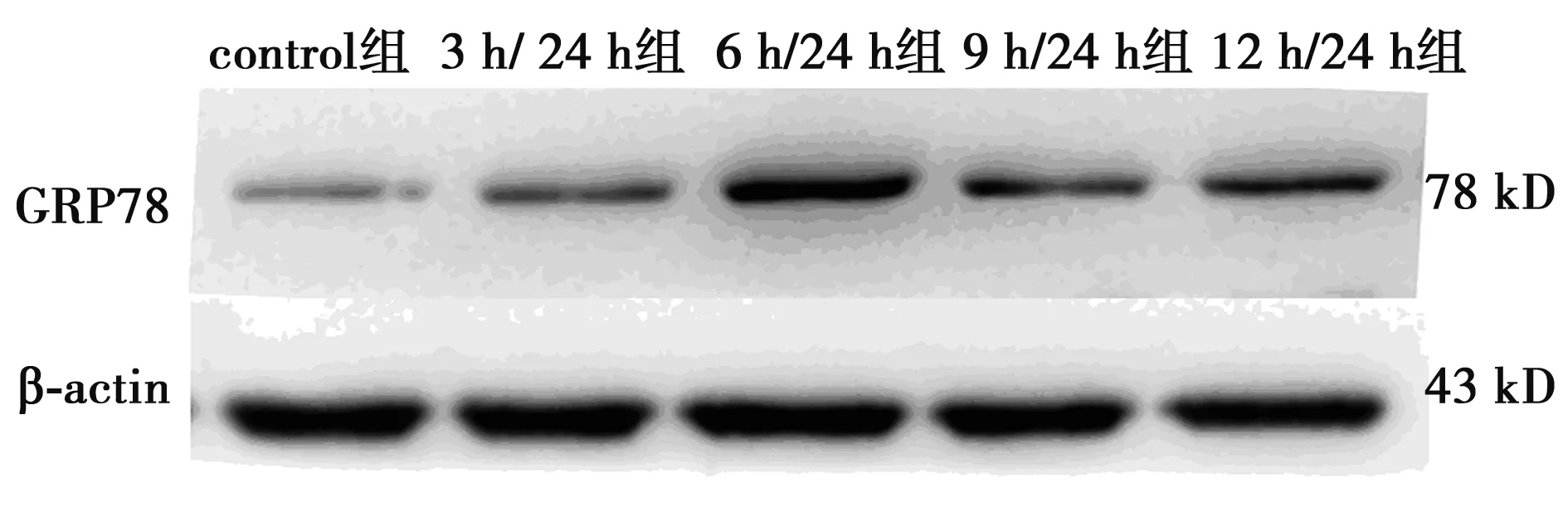
图1 OGD/R后PC12细胞中GRP78蛋白的表达
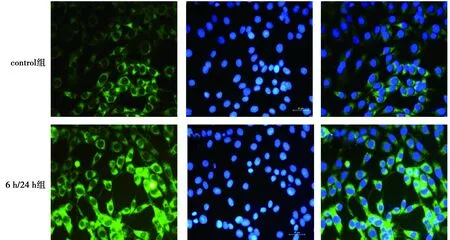
绿光为GRP78,蓝光为细胞核图2 GRP78蛋白荧光图(×400)
表1 各组细胞GRP78、PERK、caspase-3蛋白表达水平及凋亡率
与control组相比:1)P<0.05,2)P<0.01;与3 h/24 h组相比:3)P<0.05,4)P<0.01
2.2OGD/R后PC12细胞中PERK蛋白的表达 应用Western印迹检测OGD/R各组细胞中PERK蛋白,结果显示,各个实验组与control 组比较均无明显差异(P>0.05)。见表1、图3。
2.3OGD/R后PC12细胞中caspase-3蛋白的表达 OGD/R后caspase-3蛋白的表达水平,与Control组相比较,6 h/24 h、9 h/24 h、12 h/24 h这三个时间段 caspase-3蛋白表达水平显著增加(P<0.01),与3 h/24 h相比较,6 h/24 h、9 h/24 h、12 h/24 h 这三个时间段caspase-3蛋白的表达水平显著增加(P<0.01)。见表1、图4。
2.4流式细胞仪Annexin V-FITC、PI染色法检测细胞凋亡 流式细胞术分析细胞凋亡在四个象限中进行(Q4:死细胞;Q3:晚期凋亡细胞;Q2:早期凋亡细胞,Q1:正常细胞)。细胞凋亡率是Q2和Q3中凋亡细胞的百分比之和。与control组比较,3 h/24 h、6 h/24 h、9 h/24 h、12 h/24 h组凋亡率增加(P<0.01),与3 h/24 h组比较,6 h/24 h、9 h/24 h、12 h/24 h凋亡率明显增加(P<0.01)。见表1、图5。
2.5GRP78蛋白与caspase-3蛋白表达的相关性 GRP78蛋白与caspase-3蛋白在OGD/R24 h的表达呈正相关(r=0.562,P<0.05)。见图6。

图3 OGD/R后PC12细胞中PERK蛋白的表达

图4 OGD/R后PC12细胞中caspase-3蛋白的表达
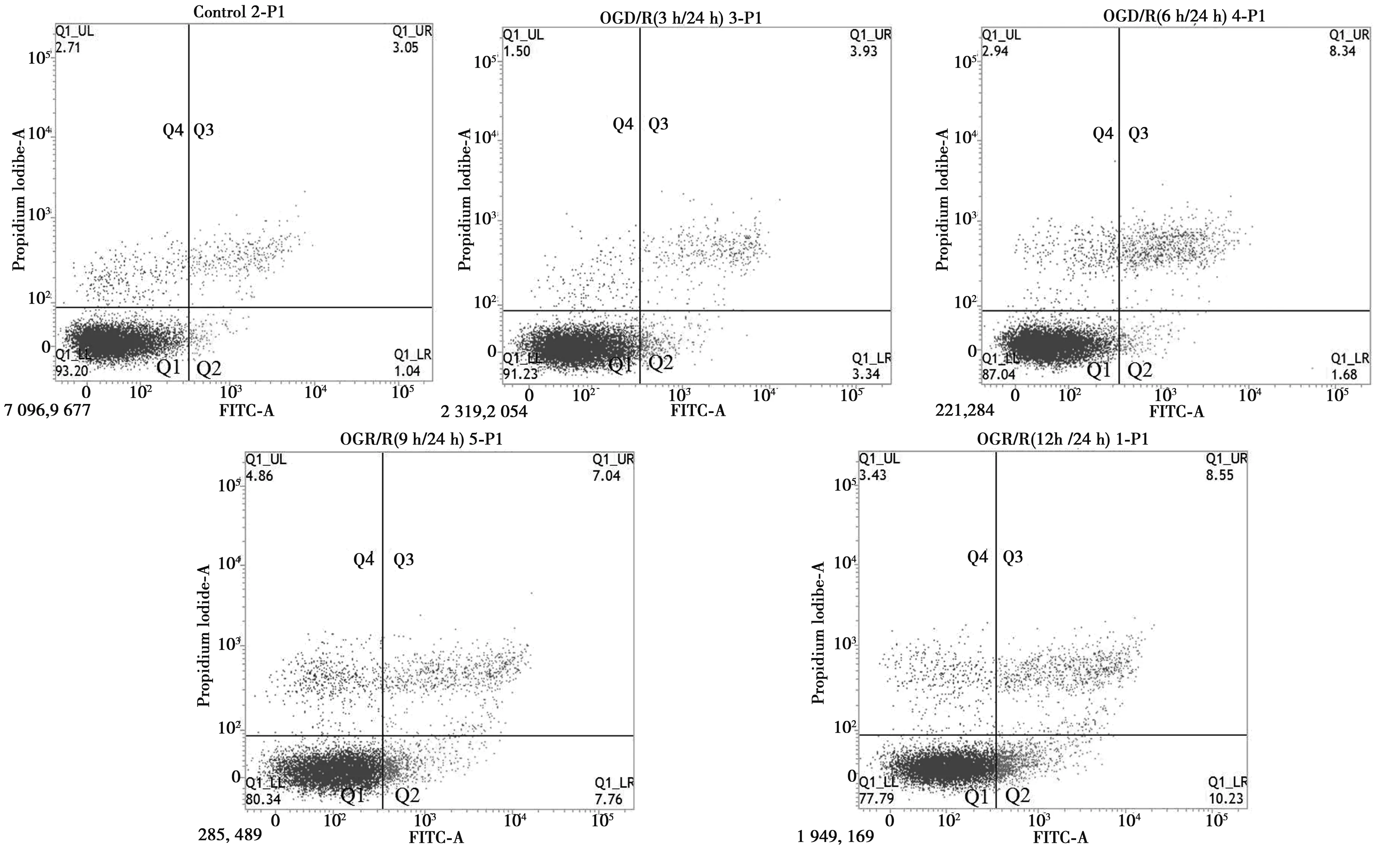
图5 PC12细胞凋亡检测

图6 PC12细胞中GRP78蛋白与caspase-3蛋白表达相关性
3 讨 论
VD 是由于缺血或出血性脑血管病及全脑缺血、缺氧引起的认知障碍,主要是由于记忆和认知功能缺损为主,可伴有语言、运动、视空间技能及人格障碍〔5〕。大部分VD是由脑缺血引起,尽管大脑只占了总体重的2%左右,但它消耗的体内氧气几乎占20%,因此大脑对缺氧缺糖特别敏感,一旦发生脑缺血将引起血液供应不足导致氧和葡萄糖剥夺,限制了能量产生所必需基质葡萄糖和氧气向大脑的输送,减少了三磷酸腺苷(ATP)的合成,造成低能量扰乱正常蛋白质的折叠,最终就会导致ERS和细胞凋亡〔6,7〕。有文献研究表明大鼠缺血2 h后灌注不同时间用2,3,5-氯化三苯基四氮唑(TTC)对大鼠脑切片进行染色,大鼠脑切片的TTC染色显示出不同程度的梗死,主要在纹状体和皮质中,再灌注早期时间点(即0 h,3 h和6 h)的损伤仅限于纹状体,然而,随着再灌注时间点的增加,它延伸到皮质区域,观察到最大的梗死出现在再灌注24 h〔8〕。近几年,脑I/R引起的ERS和凋亡是基础医学研究的热点之一。
脑I/R时引起内质网Ca2+的储存耗竭和氧化应激激活内质网应激,一旦内质网应激被激活,PERK与GRP78由紧密结合状态解离〔9〕。相关文献报道在创伤性大脑损伤中,GRP78的表达随着时间的延长先升高再减少〔10〕,与本研究结果一致,而在3 h/24 h组中GRP78没有明显变化,可能缺血3 h对PC12细胞是一个短暂性的亚致死性时间,再灌注不会导致太大的损伤。GRP78在缺血性脑中表达是上升的,同时,GRP78蛋白的表达增加标志着内质网应激的发生,本研究表明6 h/24 h时引起了内质网应激。PERK 属于内质网应激 PERK/elF2α 信号转导通路的启动蛋白,并被胞质内结构域的自身二聚化和磷酸化激活〔11〕,在本实验中PERK蛋白的表达无明显变化。另外,脑缺血再灌注的过程中由于大量自由基的产生氧化细胞膜的磷脂中不饱和脂肪酸导致膜损伤,随后通过坏死或凋亡模式导致的细胞死亡〔12〕。caspase和Bcl-2家族成员在调节I/R期间启动的多种细胞凋亡途径中是至关重要的,对caspase敲除小鼠的研究为caspase在神经细胞死亡中的关键作用提供了无可争辩的证据,缺乏caspase-3和caspase-9的小鼠显示出神经细胞凋亡不容易发生〔13〕。本研究结果表明随着OGD时间的延长细胞的凋亡率逐渐增加,呈动态变化。有研究表明缺血2 h再灌注0.5 h,视前区的缺血区部分凋亡细胞,随着再灌注时间的延长,凋亡细胞散在分布于大脑的各个区域;再灌注12 h凋亡细胞数量达到高峰;持续再灌注24 h,此时可见凋亡细胞的各种形态〔14〕,说明了细胞凋亡是一个动态的发展过程。
GRP78蛋白的表达增加标志着OGD再灌注能够引起内质网应激的发生,但同时GRP78是一种分子伴侣能够减少细胞的凋亡〔15〕,但随着OGD时间延长,导致应激强度增加,内质网功能遭到破坏,GRP78的表达不但没有继续升高,反而下降,就会引起细胞的凋亡不断增加。
