以生活之美,启化学之光张运飞
2020-03-24李红英
李红英
一、教学背景分析
1.教材分析
“醛”是人教版化学选修五的内容,以乙醛为代表,介绍了乙醛的分子结构和物理性质,从结构引出乙醛的重要化学性质:乙醛的加成及氧化反应,这样就自然而然地把乙醛、乙醇、乙酸串联了起来。
2.学情分析
学生在人教版化学必修二已经学过了葡萄糖的特征反应及银氨溶液和新制氢氧化铜悬浊液的反应,对醛基的还原性有了大概了解。在选修五中又初步接触和掌握了烯烃和醇的性质,对有机反应中氧化还原的本质有了一定了解;对官能团决定有机物的化学性质有了一定认识,具备了根据有机物分子结构初步预测物质化学性质的简单实验能力。
二、教学过程设计
教学环节1.科技引领,体验方法
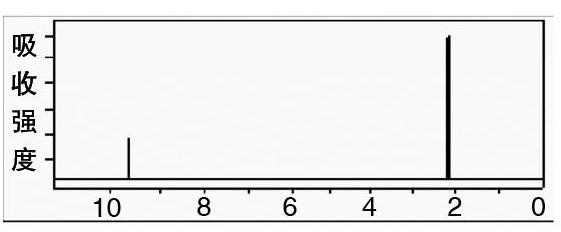
新课引入:某有机物A的分子式为C2H40(A的核磁共振氢谱如图所示),引导学生尝试写出结构简式,并指认两个吸收峰的归属。
A的核磁共振氢谱
教学环节2.发现乙醛,了解乙醛
教师先用PPT展示葡萄酒及其主要成分表,引导学生发现乙醛,并思考葡萄酒中的乙醛是从哪儿来的。随后,在PPT中引入乙醛自说,让学生充分认识乙醛。
教学环节3.观察模型,认知符号
教师展示乙醛的球棍模型、比例模型。学生先观察模型,再书写分子式、结构式和结构简式。教师巡视学生书写情况,并及时进行点评。
教学环节4.观察结构,预测性质
教师让学生观察乙醛的分子结构,指出官能团。学生观察后进行汇报。教师随后提问:“醛基是很重要的官能团,请根据结构特点及所学知识预测乙醛的化学性质,可以发生什么反应?”学生进行讨论,预测其性质,如具有还原性,可以发生氧化反应;具有氧化性,可以发生还原反应。
教学环节5.设计实验,验证性质
设计实验:乙醛具有还原性,可以与强氧化剂高锰酸钾反应,使高锰酸钾酸性溶液褪色。
学生实验1:乙醛与KMnO4酸性溶液反应。
实验现象:KMnO4溶液褪色。
实验结论:乙醛能被KMnO4酸性溶液氧化,说明乙醛具有还原性。
乙醛在一定温度和催化剂存在的条件下,能被空气中的氧气氧化为乙酸。教师引导学生写出该化学反应方程式,让学生指出其断键位置。随后,教师启发学生思考葡萄糖的特征反应,并告诉学生葡萄糖可以发生银镜反应,可以与新制的氢氧化铜悬浊液发生反应。
教学环节6.实验探究,符号表达
学生实验2:探究CH3CHO与新制Cu(0H)2悬浊液的反应。
(1)配制Cu(0H)2悬浊液。向洁净的试管中加10%的NaOH溶液2ml,滴入4~6滴2%的CuSO4溶液,振荡。
(2)乙醛的氧化。向Cu(0H)2懸浊液中滴入0.5 ml的乙醛溶液,振荡后用酒精灯加热至沸腾。
实验现象:先出现蓝色絮状沉淀→后出现红色沉淀。
学生认真阅读实验步骤,掌握实验操作,观察实验现象,及时记录。教师强调实验操作要领及实验安全,并提出问题:蓝色沉淀是什么物质?它的反应方程式怎么表示?学生回答并书写方程式。教师提问:红色沉淀是什么物质?反应物是什么?反应方程式怎么表示?学生思考并书写方程式后,教师引导、点评。
学生实验3:探究CH3CHO与银氨溶液的反应。
在洁净的平底烧瓶中加入3滴管2%的AgNO3溶液,边振荡试管边向其中滴入2%的稀氨水,直至生成的沉淀恰好溶解;再加入2滴管的乙醛溶液,并逐滴加入氢氧化钠溶液,直至刚好产生沉淀,轻轻摇晃烧瓶,直至银镜生成。
学生要认真阅读实验步骤,掌握实验操作,细心观察实验现象,并及时记录实验过程。教师应强调实验操作要领及实验安全,根据教材引导学生了解白色沉淀产生及消失的原理。教师向学生讲解教材上关于此实验的一句话:银氨溶液的主要成分是Ag(NH3)2OH,它是一种弱氧化剂,能把乙醛氧转化成乙酸,乙酸又与氨反应生成乙酸铵,而Ag+被还原成金属银。让学生尝试写出该化学反应方程式后,教师向学生讲解乙醛氧化反应的相关知识。
三、教学反思
本节课的教学设计是围绕两条线索进行的。一是生活线,注重学科素养教学。二是结构线,注重学生思维教学。教师应精心设计好“过渡”与“衔接”,搭建自主、合作、探究的学习平台,将“宏观、微观、符号”三种认识方法融入学生学习过程,以此提升化学教学的质量。
作者单位 陕西省西安市七十中学陕西省宝鸡市斗鸡中学
