高糖抑制平滑肌细胞胶原合成参与糖尿病静脉病变发生
2020-03-24陈红星黄楷刘兴州刘静吴晓莹王家欢杨川严励任萌
陈红星 黄楷 刘兴州 刘静 吴晓莹 王家欢 杨川 严励 任萌
糖尿病下肢血管病变包括下肢动脉病变和慢性下肢静脉病变。其中慢性下肢静脉病变在近年受到越来越多的关注[1]。慢性静脉病变指静脉系统出现任何形态学和功能异常的一组综合症候群,包括毛细血管扩张、网状静脉、水肿、脂性硬皮病、皮肤色素沉着、静脉曲张、静脉性溃疡等,其中以慢性下肢静脉疾病最常见,在全球的患病率达69.94%,其中9.1%的患者有活动性或陈旧性溃疡[2-3]。近几年来有研究显示64%~70.7%的糖尿病患者中存在深静脉功能不全,其发生率显著高于普通人群[4],而在慢性静脉功能不全患者中糖尿病的发病率也显著高于普通人群(17.8% vs 8.6%)[5]。此外,合并糖尿病的患者慢性静脉疾病病情通常更严重[6]。有研究显示,糖尿病足患者下肢静脉压力增高、静脉血流动力学受损,但糖尿病下肢静脉病变的发生机制目前尚未明确[7]。
血管平滑肌细胞(SMC)和细胞外基质(ECM)在静脉的生理病理过程中具有重要的作用,它们共同构成静脉壁的中膜,I型胶原(COLⅠ)是这一层的主要成分。SMC根据局部信号在分化(收缩型)和去分化型(合成型)之间进行转换,在血管发育、修复和适应过程中至关重要[8]。而在血管ECM中胶原和弹性蛋白含量最高,构成ECM的骨架结构,参与维持静脉血管的形态和物理性质。通常认为, I型胶原(COLⅠ)使组织具有刚性,而Ⅲ型胶原(COLⅢ)赋予组织伸展性,静脉壁COLⅠ/COLⅢ比例失调是慢性静脉功能不全的主要病理变化之一[3]。基质金属蛋白酶(MMPs)是一种催化ECM蛋白降解的中性内肽酶,其中MMP2属于明胶酶,可以消化I型、Ⅱ型和Ⅲ型胶原,基质金属蛋白酶组织抑制剂(TIMPs)是参与控制MMPs在组织中局部活性的特异性抑制剂。MMPs/TIMPs共同维持ECM的稳态[9-10]。
本研究通过建立糖尿病大鼠模型,对其大隐静脉(SV)进行HE染色、Masson染色,观察糖尿病静脉的组织学改变;通过高糖培养静脉平滑肌细胞(SMCV),检测SMCV的活性,探讨高糖对SMCV活性的影响;通过检测高糖处理后SMCV细胞内外COLⅠ、COLⅢ的表达,观察高糖对SMCV胶原合成分泌的影响;通过进一步检测细胞内COLⅠ、COLⅢ、MMP2/TIMP1转录水平和MMP2/TIMP1蛋白水平的改变,探讨高糖影响SMCV胶原表达的可能机制。
材料与方法
一、材料
(一)实验动物与细胞
4周龄雄性SD大鼠12只,随机分为糖尿病组(DM组)6只,正常组(NC组)6只,所有动物由广东省动物中心提供。大鼠大隐静脉原代平滑肌细胞购自武汉普诺赛生命科技有限公司,经α-SMA免疫荧光鉴定,细胞纯度>90%。
(二)主要试剂
DMEM培养基、胎牛血清、0.25%胰酶购自Gibco公司,链脲佐菌素(streptozotocin,STZ)购自SIGMA公司,HE染液套装、Masson染液套装均购自武汉赛维尔生物科技有限公司,Cell Counting Kit-8(CCK-8) 购 自APExBio公 司,RIPA裂 解液购自江苏碧云天公司,BCA蛋白定量试剂盒、PAGE凝胶制备试剂盒购自雅酶公司,兔抗α-平滑肌肌动蛋白(α-SMA) (14395-1-AP)抗体购自武汉三鹰生物技术有限公司,荧光(Cy3)标记羊抗兔IgG(BA1032)购自武汉博士德生物工程有限公司,TritonX-100(ST795)、DAPI(C1002)购自江苏碧云天公司,兔抗TIMP1(ab109125)购自Abcam公司,兔抗MMP2(10373-2-AP)购自Proteintech公司,兔抗COLⅠ(GB13022-2)、兔抗COL Ⅲ(GB11023)、兔抗 β-actin(GB11001)、山羊抗兔二抗(G1213)购自武汉赛维尔生物科技有限公司,大鼠Ⅰ型胶原(COLⅠ)ELISA Kit、大鼠Ⅲ型胶原(COLⅢ)ELISA Kit均购自武汉华美生物(CUSABIO)公司,RNA提取试剂盒购自上海奕杉生物科技有限公司,PrimeScript™RT Master Mix(Perfect Real Time) 试 剂 盒、TB Green®Premix Ex Taq™II均购自TAKARA公司。
二、主要方法
(一)糖尿病动物模型建立
适应性饲养1周,分组后禁食不禁水12 h,DM组大鼠给予65 mg/kg的链脲佐菌素(STZ)腹腔注射(STZ溶解在枸橼酸盐缓冲液中,使用前配备),NC组大鼠腹腔注射等量生理盐水,注射一周后分别尾静脉取血检测随机血糖,DM组血糖水平≥16.7 mmol/L视为造模成功。造模成功后,所有大鼠每周检测一次血糖、体重,保证DM组大鼠血糖稳定在16.7 mmol/L以上。
(二)大鼠SV取材
糖尿病大鼠造模成功后第5周(5W)、第6周(6W)分别取DM组和NC组大鼠各3只,4%水合氯醛0.3 mL/100g腹腔注射麻醉大鼠,脱毛,75%酒精消毒后沿左后肢内侧中部切开皮肤,可见深红色大隐静脉,自隐静脉裂孔取SV0.5 cm[11],用无菌PBS水漂洗三次,放于4%多聚甲醛固定备用。
(三)HE染色
将大鼠SV石蜡包埋,切片,常规HE染色,中性树胶封固。Nikon NI-U正置成像显微镜200倍下观察其形态结构变化,并进行图像采集,以肌层内外缘作为血管中膜的内外缘(见图1A),用Image J软件测量血管壁中膜厚度。
(四)Masson染色
石蜡切片后经二甲苯脱蜡至水后根据Masson染色套装说明书进行染色,中性树胶封片,Nikon NI-U正置成像显微镜200倍下观察,采集图像。胶原纤维呈蓝色,肌纤维、纤维素和红细胞呈红色。用Image J软件测量血管壁胶原纤维的分布和含量。
(五)细胞免疫荧光染色
在细胞培养皿中将细胞贴壁成功的载玻片用PBS浸洗3 min×3次;4%多聚甲醛固定15 min,PBS浸 洗3 min×3次;0.5%TritonX-100(PBS配制)室温通透20 min;PBS浸洗后,山羊血清室温封闭30 min;α-SMA一抗(1∶100)4℃孵育过夜;PBST浸洗3 min×3次,荧光(Cy3)标记羊抗兔IgG(1∶100)室温孵育1 h,PBST浸洗后DAPI避光孵育5 min,PBST浸洗5 min×4次,用含抗荧光淬灭剂的封片液封片,然后在倒置荧光显微镜(Olympus IX71)下观察并采集图像,采用Image J软件分析染色阳性的细胞比例。
(六)细胞培养及处理
将SMCV细胞分为NC组、DM组分别置于糖浓度4.5 g/L、7.2 g/L含10%胎牛血清的DMEM,37℃、5%CO2培养箱中培养,收集培养72 h的SMCV细胞,加入RIPA裂解液冰上孵育30 min,12 000×g,4℃离心30 min,取上清液按BCA蛋白检测试剂盒说明书操作,检测并计算单位细胞蛋白含量,两组配平后按比例加入SDS-PAGE蛋白上样缓冲液,95℃加热10 min后储存至-80℃冰箱备用。按照RNA提取试剂盒说明书提取细胞内RNA,按照PrimeScript™ RT Master Mix 试剂盒说明书逆转录成cDNA备用。
(七)CCK8检测细胞活性
取SMCV以3 000个/孔的密度接种于96孔培养板中,细胞贴壁后分别加入葡萄糖浓度4.5 g/L、5.4 g/L、7.2 g/L、9 g/L含10%胎牛血清的DMEM,37℃、5%CO2培养箱中培养 0、1、2、3、4 d 后每孔分别加入CCK8液10 uL继续培养箱孵育2 h(培养2 d后换液一次)后置于酶联免疫检测仪(TECAN Spark10M)中,在450 nm波长处检测各孔的光密度值(OD值)。各组均设3个复孔,重复实验3次。
(八)Real-time qPCR检测mRNA水平
利用SYBR Green法在LightCycler480荧光定量PCR仪(Roche Diagnostics公司)上完成Collagen typeⅠalpha 1 chain(COL1A1)、Collagen typeⅢalpha 1 chain(COL3A1)、TIMP1、MMP2 mRNA 表达的检测。各基因引物采用NCBI Primer-BLAST设计(见表1),以β-actin内参,所有引物均由广州天一辉远基因科技有限公司合成,实验结果采用2-CT法进行分析。
(九)Western blot 检测细胞内蛋白水平
按说明书配备10%PAGE凝胶,SDS-PAGE分离蛋白后湿转至硝酸纤维素膜,室温5%脱脂牛奶封闭1 h,1∶1 000吐温室温摇床清洗(10 min/次)3次后,放于一抗稀释液中4℃摇床孵育过夜(以β-actin作为内参),清洗3次,二抗室温摇床孵育2 h,ECL显影。一抗稀释:抗TIMP1抗体(1∶5 000)用5%脱脂牛奶稀释,抗MMP2抗体(1∶1 000)、抗COLⅠ抗体(1∶500)、抗 COL Ⅲ抗体(1∶500)、抗 β-actin抗体(1∶2 000)以5%BSA稀释。

表1 RT-qPCR 引物序列
(十)ELISA 检测细胞上清蛋白水平
收集在糖浓度4.5 g/L(NC组)、7.2 g/L(DM组)含10%胎牛血清的DMEM,37℃、5%CO2培养箱中培养72 h的SMCV细胞培养上清,4℃ 1 000×g离心20 min后严格按照试剂盒说明书检测细胞上清COLⅠ、COLⅢ蛋白水平。
(十一)统计学分析
结 果
(一)糖尿病大鼠模型的建立
糖尿病大鼠STZ腹腔注射一周后,DM组随机血糖(29.13±1.69)mmol/L,后续每周检测血糖均≥16.7 mmol/L,造模成功,NC组大鼠血糖无明显变化(均<11.00 mmol/L),DM组大鼠出现明显糖尿病症状(多饮、多食、多尿、体重减轻),NC组大鼠无明显变化。
(二)糖尿病大鼠SV形态变化
HE染色发现,造模5周后两组大鼠血管形态无明显变化,6周后DM组大鼠SV管壁中膜厚度为(8.23±0.67)μm,对 比NC组(12.07±0.71)μm明显变薄(t=3.943,P=0.017)。DM组管腔面积为(16 527.66±3 379.05)μm2,相对于NC组(7 316.68±983.98) μm2管腔变大(t=-2.617,P=0.059) (见图1)。
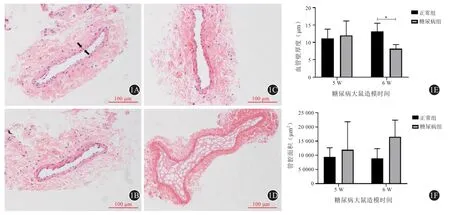
图1 大鼠大隐静脉HE染色结果
Masson染色发现,造模6周后DM组大鼠SV平滑肌细胞排列紊乱,萎缩与增生并存,其胶原含量为(37.58%±6.40%),低于NC组(53.44%±1.31%) (t=2.429,P=0.072) (见图2)。
(三)SMCV细胞鉴定结果
SMCV细胞经a-SMA免疫荧光染色后,红色荧光为a-SMA 阳性,分析显示阳性细胞率>90%,即细胞纯度>90%(见图3)。
(四)高糖培养后SMCV细胞活性改变
CCK8实验结果显示,用不同高糖浓度DMEM培养的SMCV细胞均出现不同程度活性抑制,对比NC组(4.5 g/L),5.4 g/L组及7.2 g/L组SMCV在培养2、3、4 d后均出现明显的活性降低(P<0.05),9 g/L组培养3、4 d后均出现明显的活性降低(P<0.001) (见图4)。
(五)高糖培养后SMCV内胶原及MMP2/TIMP1 mRNA表达差异
RT-qPCR结果显示培养72 h后DM组与NC组SMCV细胞内COL1A1 mRNA表达无明显差异(P>0.05),DM组COL3A1 mRNA相对表达量(0.56±0.14)对比NC组(1.08±0.08)明显降低(t=3.271,P=0.031),TIMP1 mRNA 相对表达量(1.32±0.10)对比NC组(0.96±0.04)明显升高(t=-3.42,P=0.027)升高,MMP2 mRNA相对表达量(0.65±0.10)对比NC组(1.01±0.08)明显降低(t=2.88,P=0.045) (见图5)。
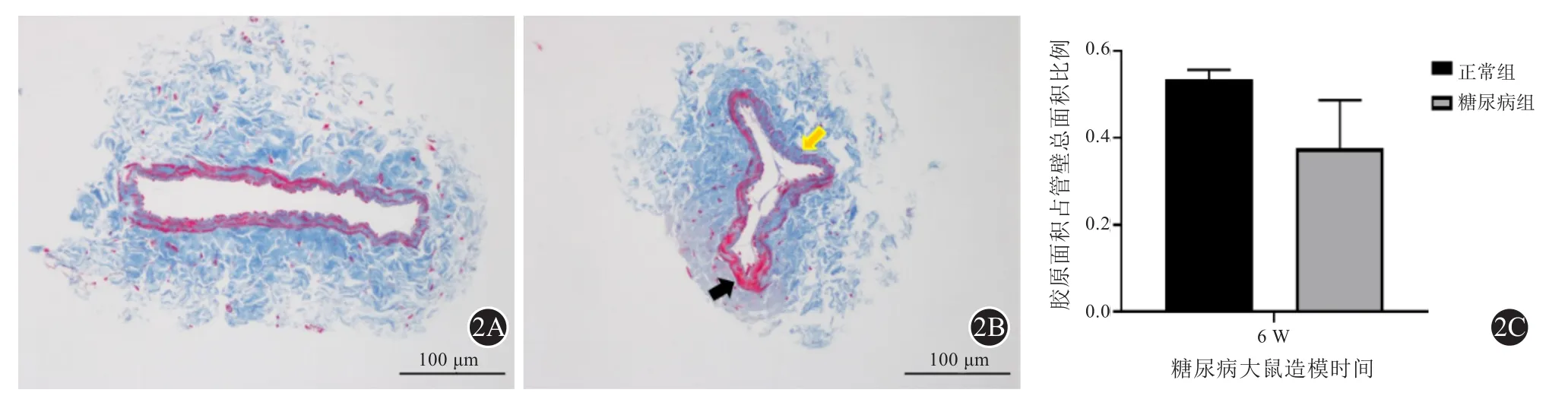
图2 大鼠大隐静脉Masson染色结果
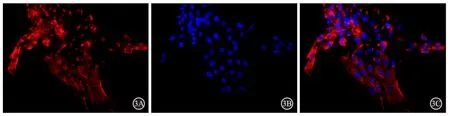
图3 SMCV a-SMA免疫荧光染色结果
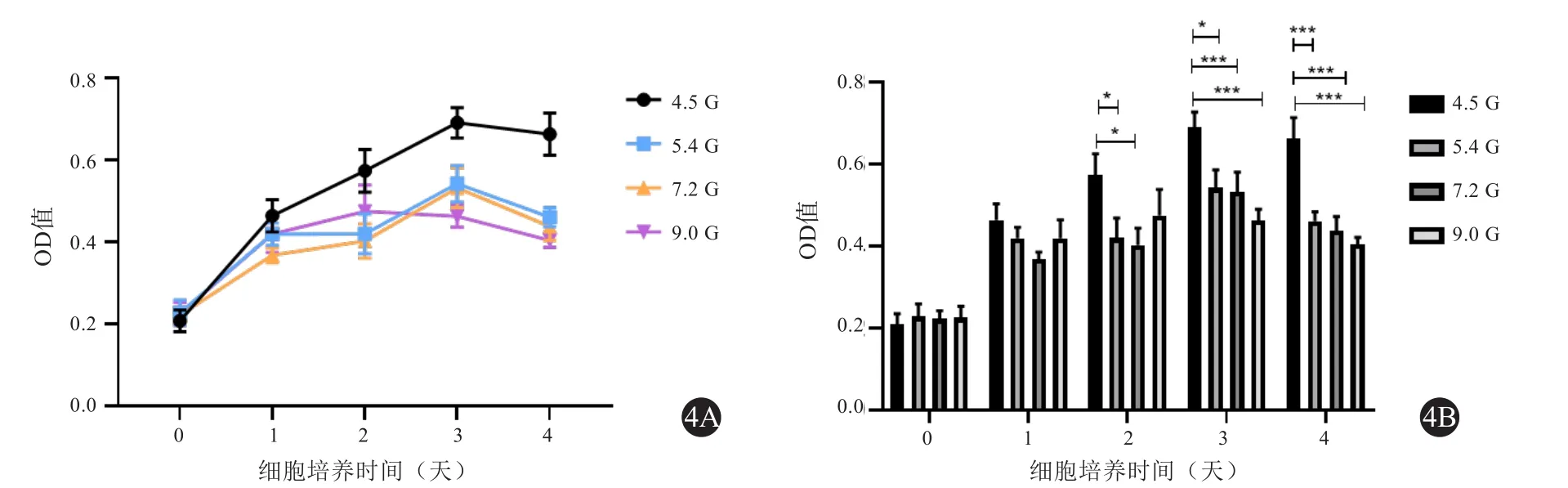
图4 高糖处理后SMCV CCK8实验结果
(六)高糖培养后SMCV细胞内胶原及MMP2/TIMP1蛋白表达水平改变
Western Blot结 果 显 示 培 养72 h后DM组SMCV细胞内COLⅠ蛋白表达下降,COLⅢ蛋白表达无明显差异,TIMP1降低,MMP2升高(见图6)。
(七)高糖培养后SMCV细胞外胶原水平改变
ELISA结果显示培养72 h后DM组SMCV细胞上清中COLⅠ表达水平明显低于NC组水平(4 592.35±523.87 pg/mL vs 7 857.38±797.93 pg/mL,t=3.421,P=0.027);COLⅢ表达水平低于NC组,但无统计学差异(2 648.10±413.96 pg/mL vs 3 158.35±653.56 pg/mL,P>0.05);COLⅠ/COLⅢ比例明显低于 NC 组(1.76±0.08 vs 2.59±0.26,t=3.043,P=0.038)(见图6)。
讨 论
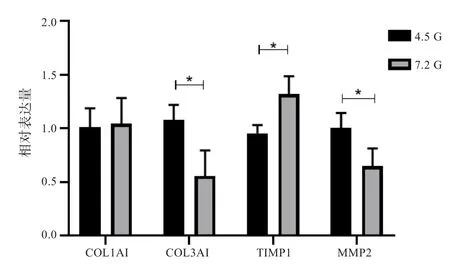
图5 高糖培养72 h后SMCV细胞内mRNA检测结果(*P<0.05)
本研究发现糖尿病大鼠模型在成模6周后出现SV管壁中膜变薄、管腔增大,并伴随胶原含量减少。体外实验发现,高糖能显著抑制SMCV细胞活性。高糖刺激后SMCV细胞内COLⅠmRNA无明显变化,COLⅢmRNA表达下降,细胞内外COLⅠ蛋白表达均显著降低,COLⅢ蛋白表达无明显差异,COLⅠ/COL Ⅲ表达比例下降;同时细胞内TIMP1表达下降,MMP2表达升高。我们进一步检测了细胞内MMP2/TIMP1转录水平,发现高糖刺激后SMCV内TIMP1 mRNA表达升高,MMP2 mRNA表达下降,与蛋白表达趋势不一致,提示高糖可能是通过转录后调控方式影响MMP2/TIMP1的表达。
糖尿病是一种慢性炎症性疾病,随着糖尿病患病率的逐年增高,糖尿病各种慢性并发症的发病率也逐渐提高。近年来,不断有研究证据表明糖尿病与慢性静脉功能不全关系密切[4-6],同时,慢性静脉功能不全病理过程中的静脉高压、血流淤滞、慢性炎症、毛细血管破坏等也可能在糖尿病足的发生发展中起到协同的作用[12]。此外,糖尿病是公认的冠状动脉血管重建术后预后不良的危险因素,通常具有较高的发病率和死亡率,而自体大隐静脉是冠状动脉旁路移植术的常用血管移植材料[13-14]。因此,明确糖尿病对下肢静脉组织形态及功能的影响,探索其病理变化机制具有重要的临床意义。
慢性静脉功能不全的大隐静脉管壁常表现为不均一性改变,肥厚部位常与平滑肌变少细胞外基质变少的变薄萎缩部位交替出现[3]。以往对使用SV进行冠状动脉搭桥的糖尿病患者研究显示,在糖尿病患者中大隐静脉的内皮相关血管舒张功能明显受损[15]。此外,Ivana LAZICH等研究发现,糖尿病患者的头静脉管腔面积显著增大,内、中膜增厚,内膜 /中膜比值增高[16];Chakraborty、 SK 等的研究发现,患妊娠期糖尿病的患者脐静脉变薄、管腔变大,管壁平滑肌纤维断裂变性[17]。这些研究均提示糖尿病患者与非糖尿病患者的静脉血管重构存在显著差异。本研究发现,糖尿病大鼠大隐静脉中膜厚度较正常组明显降低,管腔面积增大,胶原含量减少,证实糖尿病可以出现下肢静脉形态结构改变。
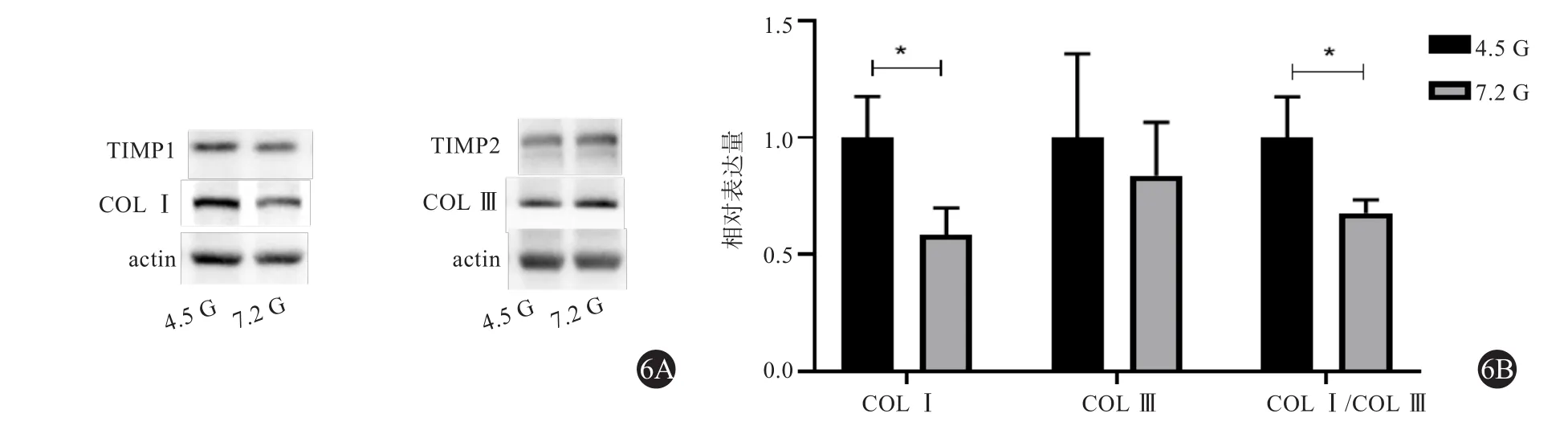
图6 高糖培养后SMCV细胞内外相关蛋白表达情况
以往研究发现,糖尿病患者的SMCV在形态学上与非糖尿病患者不同,并且在高糖或晚期糖基化终产物(AGEs)刺激下,来源于SV的SMC表型改变往往比来源于动脉的SMC改变更为明显[18]。Madi HA等人发现,相对于非糖尿病患者,糖尿病患者来源的SMCV表现为明显的菱形表型,细胞面积扩大,伴有F-actin细胞骨架的破坏、α-SMA网络的紊乱以及局灶性粘连的形成,对血清的反应更具有移动性,但增殖受损[8,19-20]。然而,也有研究表明AGEs的积累和AGEs受体(RAGE)的激活可促进糖尿病患者SMC的增殖,促进MAP激酶家族(ERK、p38和JNK)磷酸化水平、MMP2和MMP9的转录表达、蛋白表达水平[21]。在大鼠静脉移植研究中也发现,AGEs可以通过激活MAPKs通路同时促进SMCV的增殖和凋亡,进而促进移植静脉的粥样硬化[22]。本研究中,CCK8检测结果提示高糖刺激后SMCV细胞活性显著降低,此外,SMCV细胞内外COLⅠ蛋白表达均显著降低,COLⅢ蛋白表达无明显差异,COLⅠ/COLⅢ表达比例下降,进一步研究发现,高糖刺激后细胞内COLⅠmRNA无明显变化,COLⅢmRNA表达下降,TIMP1蛋白表达下降,MMP2蛋白表达升高,提示高糖可能通过调控MMP2/TIMP1表达来抑制SMCV胶原表达参与静脉病变。而刺激后SMCV内TIMP1 mRNA表达升高,MMP2 mRNA表达下降,与蛋白表达变化趋势不一致,提示高糖可能是通过转录后调控方式如通过MicroRNA诱导基因沉默的机制调控MMP2/TIMP1及COL Ⅰ的表达参与静脉病变。
综上所述,本研究证实糖尿病下肢静脉中膜变薄,管腔增大,胶原减少。在体外实验中,高糖可以使SMCV细胞活性降低,COLⅠ蛋白表达下降、COLⅠ/COLⅢ蛋白表达比例下降,但其COLⅠmRNA表达无明显变化,而细胞内TIMP1蛋白表达减少,MMP2蛋白表达增多,可以推测高糖可能是通过转录后机制调控MMP2/TIMP1水平,影响SMCV细胞COLⅠ/COLⅢ的表达,抑制平滑肌细胞胶原合成,参与静脉病变,其具体调控机制尚需进一步研究证实。
