纳米药物的研究进展
2020-03-24许银银
刘 君,许银银,李 萌,钱 海*
1 中国药科大学 药物科学研究院,南京 211198;2 上海复星星泰医药科技有限公司,上海200120
在过去的几十年中,纳米技术的发展为很多重大疾病的治疗提供了新机会。与传统药物相比,纳米药物递送系统显示很多优势,例如改善溶解度,提高生物利用度,减小毒副作用,能通过血脑屏障等[1]。纳米药物能够提高难溶性药物的有效性、安全性和耐受性,在药物递送系统中起着非常重要和独特的作用[2]。因此,将一些难溶性或细胞毒性药物设计成可以工业化生产的纳米制剂具有重要的意义。但是目前获批上市的纳米药物并不多,大部分正在进行临床研究。本文对纳米制剂的种类及对应的已上市的纳米产品、制备方法、评价指标等予以综述,为纳米药物工业化研发提供参考和理论支持。
1 纳米药物的发展
20 世纪60 年代科学家首次提出脂质体的概念,经过了30 年研究第一个纳米药物阿霉素脂质体Doxil®才于1995 年由美国FDA 批准上市[3]。近20 年来,纳米药物学迅速发展,每年有大量的纳米药物相关文献和专利被发表,纳米制剂新药申请也逐年增多。2014 年,美国FDA 的指导文件对纳米药物的定义给出了新的解读:纳米产品或纳米材料的粒径在1~100 nm 范围内者,它们特性(理化或生物学特性)改变是由其粒径改变所致,即使粒径达1 μm,也可视为纳米产品[4]。
美国FDA 的药品评价和研究中心(Center for Drug Evaluation and Research,CDER)分析了从1973~2015 年收到的359 个纳米药物申请,其中65%是新药申请,17%是药物的新应用申请,18%是仿制药申请。最多的是抗肿瘤脂质体制剂(33%),其次是纳米晶药物(23%)、乳剂(14%)、铁-聚合物复合物(9%)、胶束(6%),另外15%是其他种类的纳米药物,比如药物-蛋白复合物、药物-聚合物复合物、复合物纳米粒等。从1973~2015 年,94%的纳米药物是用于治疗,剩下6%是用于体内成像。绝大多数产品是用于肿瘤治疗(35%),用于炎症/免疫/疼痛疾病(18%)和感染(12%),26%应用在如贫血、影像学、肠外营养、内分泌/外分泌紊乱和心脏/血管疾病等,9%的申请应用于包括精神障碍、防晒霜、麻醉剂、维生素补充剂和恶性高热等[5]。纳米药物具有优越的市场前景、巨大的发展潜力,激起了科研机构和制药企业的研发热情。
2 纳米药物的分类及研发进展
从药代动力学/药效学观点来看,纳米药物可分成两类:一类是通过高强度机械力将活性药物成分本身粉碎至纳米级别,制备方法相对简单,药物负载量达到近100%;另一类是用来溶解、连接、缔合或包封递送活性成分的纳米载体[6],属于基质骨架型或囊泡型结构,制备过程复杂,药物负载量相对较低[7]。现对纳米药物的分类及其研发进展作一介绍。
2.1 纳米晶体药物
纳米晶体通常是指具有亚微米或纳米级的结晶(包括无定形)特征的活性药物成分[8]。纳米晶体药物是在离子型或非离子型稳定剂和水等附加剂的存在下,用高强度机械力将药物本身粉碎至纳米级别,无需载体材料[9]。通过将粒径减小到纳米级范围,纳米晶体药物表现出优异的性能属性,包括增强难溶性药物的溶解度,改善粘附性,提高细胞膜渗透性和生物利用度[10]。
纳米晶体从1988 年诞生,到目前为止,美国FDA、欧洲药品管理局和制药与医疗器械局已经批准了许多基于纳米晶体技术的新药产品。表1 列出了一些目前已上市及临床转化中的纳米晶体药物的剂型、活性成分、适应症、制备技术和上市时间等信息[11,12]。从表1 看出,大部分纳米晶体药物是口服剂型[13],且主要使用介质研磨法或高压均质技术制备的。
2.2 纳米载体药物
纳米载体药物是借助于载体材料将药物吸附、结合、分散或包裹其中,能够运输小分子药物、大分子蛋白质、基因药物。纳米载体可通过保护药物免受降解而增加其半衰期,并提高难溶性药物的溶解度和递送效率,在药物递送系统中显示出巨大的应用潜力[14]。纳米载体药物主要类型:纳米脂质体、聚合物纳米胶束、纳米颗粒、聚合物-药物偶联物等[15]。
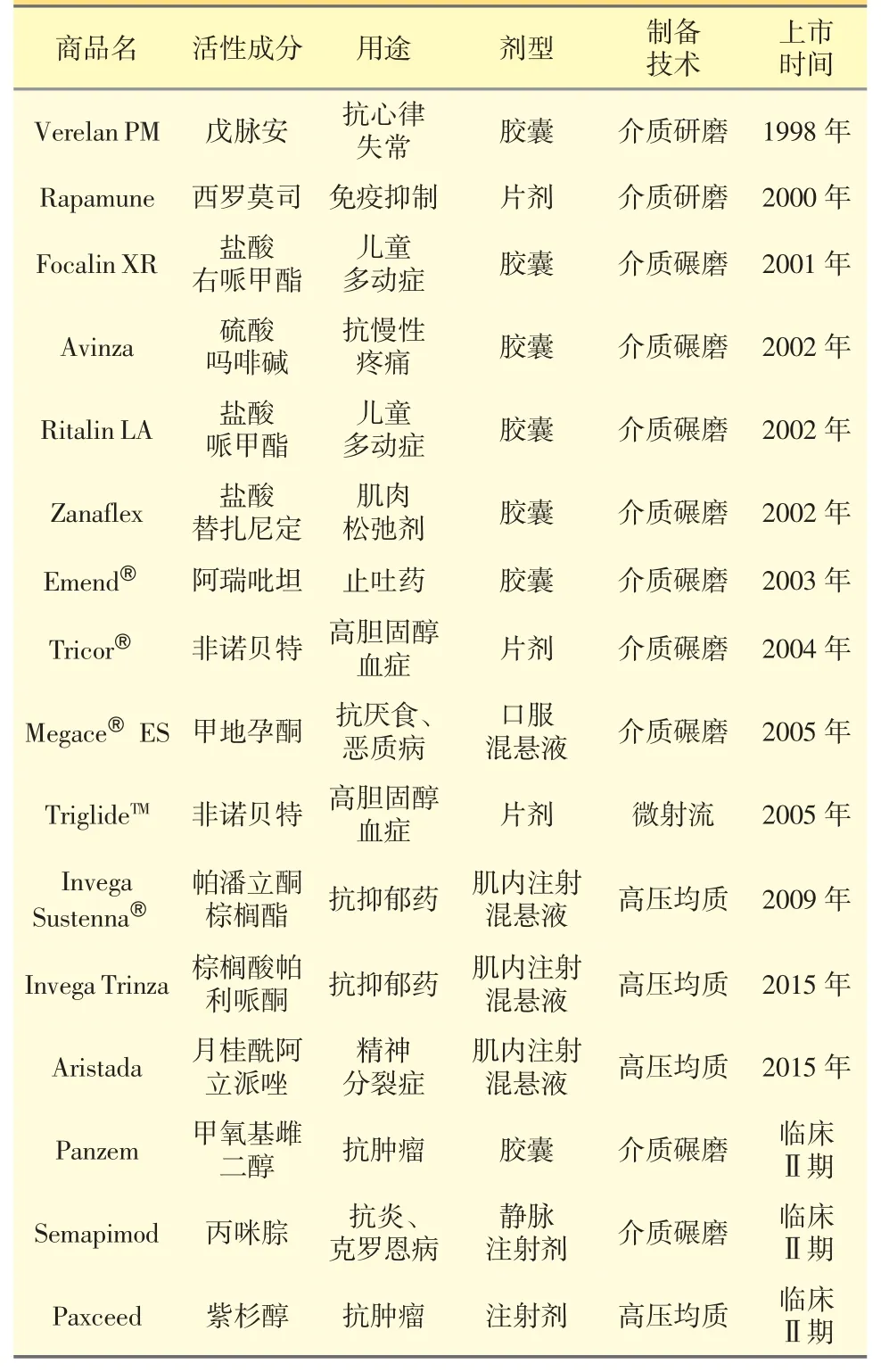
表1 已上市及临床转化中的纳米晶体制剂
2.2.1 脂质体 脂质体是由两亲性的磷脂组装成脂质双分子层结构的胶体囊泡,它不仅具有可包封多种亲水性药物和siRNA 的内室,还可在其疏水性的壳层中负载疏水性药物[16]。它具有生物相容性好、不易引起抗原或毒性反应的优点。使用聚乙二醇等聚合物进行表面功能化,延长了它们的循环时间[17]。
脂质体是抗肿瘤纳米药物的主要剂型之一,也是临床转化最成功的一类纳米药物[13]。药物评价和研究中心通过对2010~2015 年期间纳米药物申请的分析发现,脂质体占据向美国FDA 申请的纳米药物的70%,绝大多数(61%)脂质体包载的都是化疗药物[5]。纳米递药系统能同时荷载多个药物,并可改变原有药动学特征,确保所载的多个药物从给药开始到进入肿瘤细胞都能维持合适的比例,有利于药物间协同作用的发挥。Vyxeos 是美国FDA 于2017 年批准的第一个含有阿糖胞苷和道诺霉素两种原料药的脂质体产品。在针对急性髓系白血病的Ⅲ期临床研究中,比较了脂质体产品与标准阿糖胞苷-道诺霉素(5∶1)方案。与对照组(游离阿糖胞苷和道诺霉素)相比,Vyxeos 提高了整体存活率,并表现出类似的安全性[18]。表2 列出了从1995 年至今FDA、EMA 批准上市的多种脂质体新药产品及其活性成分、适应症和上市时间等[19]。2015 年到2018 年期间国内也有5 家药企的脂质体注射液成功上市,分别是南京绿叶制药的注射用紫杉醇脂质体,上海上药新亚药业的注射用两性霉素B 脂质体,石药集团、常州金远和上海复旦张江的盐酸多柔比星脂质体注射液。虽然,目前的脂质体产品设计、工艺可能还需要进一步的改进,但磷脂质量差、封装效率低、制造工艺复杂、稳定性差等问题却已经成功地被解决。此外,药用辅料级别的磷脂已经实现了规模化生产。对于治疗用脂质体的生物相容性、生物降解性和毒性安全性的认识也促进了未来脂质体产品的开发[20]。

表2 已上市的脂质体纳米药物
2.2.2 聚合物胶束与纳米颗粒 聚合物胶束是由两亲性嵌段共聚物形成的纳米尺寸的球状胶束,具有疏水性核心和亲水性外壳,疏水性核心可包封水溶性差的药物,亲水性外壳允许负载亲水性药物并使胶束维持稳定状态。聚合物纳米胶束常用于递送难溶性药物,提高药物溶解度和渗透性,延长药物循环时间,可用于静脉内给药[14]。目前,已获得临床批准的聚合物纳米胶束有Genexol-PM®和Paclical®,活性成分均为紫杉醇,分别用于治疗转移性乳腺癌和卵巢癌。此外,多种纳米胶束正在进行临床试验,比如已完成临床Ⅲ期试验的紫杉醇纳米胶束NK105®,正在进行临床Ⅲ期试验的顺铂纳米胶束NC-6004®,处于临床Ⅱ期的NK012®和NK911 以及已经完成临床Ⅰ期试验的NC-4016。这些纳米胶束多由生物相容性良好的聚乙二醇-聚氨基酸嵌段聚合物制备而成[13]。
聚合物纳米颗粒是指纳米囊、纳米球或固体球形的聚合物颗粒,可以通过沉淀、乳化、凝聚等方法制备。常用的聚合物包括天然聚合物如白蛋白、葡聚糖、透明质酸盐和壳聚糖,以及合成聚合物如聚谷氨酸和聚乙醇酸、聚乙二醇、聚己内酯、聚乳酸、聚天冬氨酸等[21]。聚合物纳米颗粒可以将药物包封或物理包埋于聚合物基质内,减少其与健康细胞的相互作用,从而降低药物的毒性。目前,已获批上市的产品有用于治疗胰腺癌、转移性乳腺癌的白蛋白-紫杉醇纳米颗粒Abraxane®和用于治疗肝细胞性肝癌的阿霉素纳米颗粒Transdrug®,还有多种纳米颗粒抗癌药物正在临床试验过程中,包括处于临床Ⅱ期的米托蒽醌纳米颗粒DHAD-PBCA-NPs、喜树碱纳米颗粒CRLX101、多烯紫杉醇纳米颗粒Docetaxel-PNP、BIND-014、ABI-008,雷帕霉素纳米颗粒ABI-009;处于临床Ⅰ期的ABI-010、ABI-011、CALAA-01 及Nanoxel[14]。国内由石药集团欧意药业有限公司和江苏恒瑞医药股份有限公司研发的的注射用紫杉醇(白蛋白结合型)仿制药也分别于2018 年2月和2018 年8 月获批上市。
2.2.3 聚合物-药物偶联物 聚合物-药物偶联物(polymerdrug conjugates,PDCs)是指活性药物分子与聚合物通过化学共价键偶联形成的纳米药物[22]。聚合物材料要具有水溶性好、无毒和无免疫原性等特点,主要包括聚乙二醇、多糖类聚合物(如透明质酸、葡聚糖等)和聚谷氨酸等。目前,仅有培门冬酶注射剂(Oncaspar 获得上市),但多种PDCs 纳米抗癌药物正处于临床试验中,如已完成前列腺癌临床Ⅲ期和乳腺癌临床Ⅱ期试验的聚谷氨酸与紫杉醇的偶联物Xyotax®;已完成非小细胞肺癌临床Ⅲ期和黑色素瘤临床Ⅱ期试验的负载紫杉醇用于实体瘤治疗的Taxoprexin®;已完成临床Ⅰ期试验负载喜树碱用于非小细胞肺癌的XMT-1001,活性成分为阿霉素的葡聚糖-药物偶联物AD-70 以及正在进行临床Ⅰ期试验的Prothecan[13]。
3 纳米药物的工业化制备技术
目前上市的纳米药物大多是纳米晶体药物或脂质体,工业上常用介质研磨法、高压均质法、喷雾干燥法来制备纳米晶体药物;常用高压均质法、冷冻干燥法及挤出法等制备脂质体药物。
3.1 介质研磨法
介质研磨法是在机械研磨室中装载研磨珠、分散介质(通常为水)、表面活性剂和待纳米化的药物,药物颗粒通过机械研磨产生的剪切力和碰撞力而减小尺寸[23]。影响纳米化效果的因素有研磨珠的尺寸、药物的硬度、表面活性剂的浓度与温度,以及分散介质的粘度等[24]。目前工业转化比较成功的纳米晶体药物大部分是使用介质研磨法制备的,包括最早上市的戊脉安胶囊Verelan®PM、阿瑞吡坦胶囊Emend®、非诺贝特片剂Tricor®以及甲地孕酮口服悬浮液Megace®ES 等。介质研磨法由于产业化设备易得、批间差异小等优点,更易应用于工业化生产。
介质研磨法的主要缺点是制备过程中研磨珠的磨损和溶蚀会造成产品污染。最近,Funahashi I 等[25]提出了一种使用冰珠代替传统硬珠(如金属或陶瓷)的无污染的新型湿介质研磨方法。使用由冰制成的珠粒作为研磨介质代替氧化锆珠粒,并且使用冰锥进行搅拌以消除研磨介质碎裂/磨损造成的污染。研究表明,冰珠的直径对铣削性能有很大影响,最佳直径约为1500 μm。此外,在研磨过程中需要将温度保持在0 ℃~-2 ℃,以维持研磨功能。研磨所得的纳米悬浮液经喷雾干燥可用于开发口服剂型,如颗粒剂、片剂和胶囊剂。
此外,制备技术的可转移性是纳米药物实现工业化生产的重要条件。Hagedorn M 等[26]研究了湿介质研磨从小到中等规模,再到大规模药物生产的可转移性,提出了参数比研磨能可以预测所得纳米悬浮液的药物粒度分布,指导搅拌研磨机之间进行批量的缩小和放大。比研磨能是研磨机净输入能量与悬浮液中固含量重量的比值。在该研究中,使用了最近开发的适用于非常小批量的双离心机Dual centrifugation(DC)对药物进行研磨,DC 与普通离心的区别在于离心过程中样品的额外旋转使得药物颗粒在小瓶内与研磨珠一起快速有力地运动,为悬浮液引入了非常高的比研磨能,从而实现有效的混合、均质化和高效研磨,最终可得到与搅拌研磨机相当的纳米颗粒。中试规模使用了批量大小为1.5kg 的设备型号为Delta Vita 300 的搅拌研磨机,以比研磨能为3.33kWh·kg-1研磨270 min,生产规模使用了批量大小为30 kg 的设备型号为Delta Vita 10000 的搅拌研磨机,通过计算达到相当的比研磨能所需输入的能量设置研磨参数,实际比研磨能为3.03 kWh·kg-1,两者获得了粒径分布类似的药物颗粒,并且与双离心机研磨90 min 得到的药物颗粒粒径相类似。证明了参数比研磨能对纳米研磨批量放大具有指导作用,说明小批量的双离心机可作为筛选工具用于纳米晶体药物的处方开发。Lestari MLAD 等[27]使用低能湿球磨法(LE-WBM)制备小批量的纳米悬浮液(10 g),用于筛选合适的表面活性剂并预测药物的可研磨性,研究发现,使用低能量湿球磨法或120 g批量的高能球磨法以分批模式处理药物时,在相同的研磨时间和研磨速度下获得了粒度相当的颗粒。对于在再循环模式下使用高能湿球磨法制备的2 kg 批量时,调整研磨速度也可获得与小批量粒度相当的颗粒。
3.2 高压均质法
高压均质技术既可用于规模化制备纳米混悬液,又可用于脂质体的工业化生产。微射流高压均质技术是一种新型高压均质技术,它集合了微射流、撞击流和传统高压均质技术的优势于一体,同传统阀式高压均质相比,具有更高的均质效率,粒径更小、分布更窄,更适合纳米药品规模化生产。微射流高压均质技术基于射流原理,将药物悬浮液放入高压均质腔中,使物料在动力单元的增压作用下快速地通过百微米级的不锈钢孔道,形成超音速射流(>500 m·s-1),在高压均质腔内壁处产生剧烈的剪切、碰撞、空穴作用以及另一端的对射作用。双股射流对射致瞬间相对速度加倍,产生对射爆炸效应,从而使药物颗粒分解破碎[28]。微射流高压均质制得的纳米晶体混悬液还可以通过干燥固化,进一步制备成胶囊、片剂或冻干粉剂等。目前上市的帕潘立酮棕榈酯肌肉注射混悬液Invega Sustenna、棕榈酸帕利哌酮肌肉注射混悬液Invega Trinza、月桂酰阿立派唑肌肉注射混悬液Aristada,以及非诺贝特片Triglide®,均是以高压均质化技术制备而成。
早在1990 年就有使用微射流高压均质机规模化制备脂质体的报道,研究发现,在微射流高压均质机作用下,脂质体的平均尺寸可以从640nm 减小至160nm,并且可以从100mL 实验室规模扩大到4000 mL 生产规模[29]。Duong VA 等[30]最近使用改良的冷高压均质法成功制备了负载盐酸昂丹司琼的纳米脂质体缓释制剂,可延长其止吐的治疗效果。高压均质技术制备的脂质体具有粒径小、分布窄的优点,且包封率高,可实现规模化、连续化生产。目前工业上常用的微射流高压均质设备有:实验型微射流超高压均质机、Nano DeBEE 实验型微射流高压均质机、MiniDeBEE 小试型超高压均质机、DeBEE 2000 中试型超高压均质机、DeBEE 3000 生产型超高压均质机、Will 生产型微射流均质机等。
3.3 冷冻干燥法
冷冻干燥法所制备的脂质体具有粒径小(200 nm 以内)、稳定性好、灭菌贮存方便等优点,特别适合于对热敏感的药物脂质体的制备[31]。上海艾力斯医药科技有限公司的发明专利CN200610028725.7 中公开了一种稳定的脂质体组合物,由饱和磷脂和胆固醇作为成膜脂质,加入维生素E 作为抗氧剂,以蔗糖作为冻干赋形剂,采用薄膜蒸发-冷冻干燥的方法制备,这种脂质体可作为抗癌药物紫杉醇的载体[32]。南京绿叶制药有限公司的发明专利CN106924195 中公开了一种用冻干法制备注射用紫杉醇脂质体组合物:先将处方量的紫杉醇原料、磷脂、胆固醇溶于乙醇中,50 ℃~60 ℃恒温除去溶剂,加入溶有处方量的氨基酸和甘露醇或葡萄糖的水溶液,溶解后,定量分装加入容器内,放置冷冻干燥机中,将溶液在0.5~2 h 迅速降至-50 ℃~-80 ℃,并保温4~8 h,得到冻结体,真空处理,使真空度小于10 pa,再将冻结体在0.1~2 h 升温至-5 ℃,保温1~4 h,然后将冻结体在1~2 h 升温至30 ℃~35 ℃,保温3~6 h,通入氮气、氦气或氩气,得紫杉醇脂质体制剂[33]。冷冻干燥法已应用于多种脂质体产品的工业化生产,2017 年8 月经美国FDA 批准的道诺霉素/阿糖胞苷脂质体Vyxeos 就是使用冷冻干燥法制备的[34]。
3.4 挤出法
挤出法是通过加压使大小不一的多室或大单室脂质体通过特定孔径大小的聚碳酸酯膜与不锈钢微孔滤板,由于剪切力的作用导致其发生形变而破裂,破裂的双层膜立即重新组合,形成粒径均一集中的小单室脂质体。挤出法不接触有机溶媒,且制备工艺简单、重现性好[35]。脂质体挤出膜为聚碳酸酯膜,不溶于大多数有机溶剂(氯仿、二氯甲烷、N-甲基-2-吡咯烷酮除外)和水,不吸附蛋白和提取物,可确保样品不被污染,具有化学高抗性和热稳定性,适用于脂质体制备。与过滤除菌用膜弯曲孔道不同,脂质体挤出膜孔道为直道,具有明确的孔径大小,不容易阻滞大脂质体的通过,膜孔垂直更有利于纳米级脂质体的挤出制备。目前世界上有Whatman、Millipore 等公司生产的聚碳酸酯膜较为常用。脂质体挤出器可分为手动型、气动型、在线式3 种。手动型脂质体挤出器主要处理范围是0~1 mL,适合超小体积的实验阶段应用;气动型脂质体挤出器主要处理范围是0~5000 mL,适合中小量样品处理;在线型脂质体挤出器主要处理范围是0~1000 L,适合中试以及放大生产[36]。挤出法还可与其他方法联用制备脂质体,比如微射流高压均质机与脂质体挤出器通过标准的高压接口与高压管路串联在一起,物料经微射流高压均质以后,通过特定孔径的脂质体挤出膜,增加了脂质体挤出器的样品处理效率,高效获得粒径小且分布窄的脂质体,达到更好的纳米化效果。
4 纳米药物的评价指标与技术要求
普通药物制成纳米制剂产生的的纳米效应不仅带来了许多治疗优势,其理化性质的改变使药物的体内分布行为也发生了变化,可能会带来新的不良反应[37]。故应明确纳米药物的评价指标、技术要求,对有效性、安全性、可控性进行评估。
4.1 纳米药物的质量控制
纳米药物的理化性质会影响其质量、稳定性及体内分布,EMA 现有法规及指导原则规定,需要对纳米材料的化学组成、粒子尺寸、形态学、质量浓度、比表面积、表面化学、表面电荷、粘度等理化性质进行表征。为保证产品质量和批间一致性,美国FDA 提出,需要对纳米药物的生产过程进行质量控制,确定关键工艺参数,并对每批产品的包封率、降解产物、可能引入的杂质和溶剂残留进行控制。关于纳米药物的稳定性,除了同传统药物一样需要进行常规的长期及加速稳定性考察,还需对空白纳米载体进行相关的影响因素稳定性试验[38]。体外释放度与体内溶出相关,是评价纳米制剂质量的重要指标,也是确保有效性的重要指标。纳米制剂体外释放度评价方法有取样分离法、透析法、流通池法、弗朗茨扩散池法、结合法,还有电化学法、非电化学法、微渗析法等新方法[39]。体外释放方法应该能够区分产品生物等效性的差异。
4.2 纳米药物的临床研究
同种药物的传统制剂与纳米制剂的药动学性质也会有所不同,美国FDA 提出纳米药物需进行以下药动学试验:单剂量药动学试验、多剂量药动学试验以及预期治疗剂量范围内的剂量比值试验、纳米药物和非纳米药物之间的对比试验[38]。还应收集和分析血液、尿液和粪便样品中的母体药物以及代谢物,并确定与该药物的治疗和毒性相关的主要代谢物[40]。EMA 提出,纳米制剂的仿制药需要进行生物等效性试验,以证明其与原研产品的临床治疗效果一致[41]。
4.3 纳米药物的安全性评估
尺寸的减小,使纳米药物可以透过血脑屏障,可能会造成潜在毒性。美国FDA 推荐纳米药物的安全评估应包括危害识别、剂量反应评估、暴露评估和风险表征,研究原料药和载体材料可能的杂质及杂质的毒性,至少需要进行急性毒性试验、多剂量毒性试验、基因毒性试验以及亚慢性毒性试验、体外哺乳动物细胞基因突变试验、染色体畸变试验及体外微核试验。此外,纳米药物许多毒副作用是与剂量相关的,因此纳米药物的体内毒性测试需要注意对剂量的考察[38]。
5 问题与展望
纳米制剂能否成功开发,取决于其从实验室规模到工业规模的可转移性,因此,应该加强纳米药物的基础研究,包括纳米药物制备的相关设备研发,关注过程表征、设备选择、处方研究和稳定性研究四个方面,以解决产品重现性问题。另外,纳米药物相关标准和方法尚未完全明确,EMA 和FDA虽已发布了一系列指导原则,但尚未有具体的规程或法规来指导行业开展研究,国内暂未发布纳米药物相关指导原则,现有的药物审评原则无法完全适用于纳米药物。监管机构仍需针对纳米药物的工业化研发进行广泛研讨,加强对其质量控制和管理,深入开展体内外相关性及毒理安全性评价研究,广泛收集市场上的监测信息,促进纳米药物的快速发展。
