玉米泛素结合酶基因家族分析及低氮胁迫下亚家族UBC2的表达分析
2020-03-23陈曙赵秋芳陈宏良,金辉
陈曙 赵秋芳 陈宏良, 金辉


摘 要:泛素結合酶是泛素/蛋白酶体途径的重要组成部分,在蛋白质的泛素化过程中具有重要作用。本研究利用生物信息学对玉米泛素E2家族成员进行系统进化及基因结构分析。系统进化分析显示,玉米泛素结合酶基因可分为6个亚家族,各亚家族成员数目差异较大。基因数目最多的亚家族是UBC1,为22个。成员数最少的是UBC3,仅为5个。以亚家族UBC2为研究对象,发现UBC2中一共存在4对旁系同源基因,分别是ZmUBC3/ZmUBC70、ZmUBC8/ZmUBC34、ZmUBC31/ZmUBC53以及ZmUBC45/ZmUBC66。对UBC2中成员进行基因结构分析发现,互为旁系同源的基因其基因结构相似。ZmUBC45/ ZmUBC66含有外显子数量最多,为9个,而ZmUBC31/ZmUBC53外显子含量最小,仅为4个。基因基序分析结果显示,ZmUBC3/ZmUBC70含有基序数量最多(8个),ZmUBC8/ZmUBC34与ZmUBC31/ZmUBC53基序含量最小(均为3个)。基因启动子作用元件分析显示,泛素E2基因启动子元件类型可分为光响应、激素响应和胁迫响应元件、组织表达相关元件以及周期性调控相关元件5大类。基因不同组织表达分析显示,被检测基因在玉米雌花中均有很高的表达量,在根和茎中表达量最低。低氮胁迫结果显示,所有被检测基因在低浓度NO3处理下,其基因相对表达量在1 h降至最低,随后逐渐上升。在低浓度NH4+处理条件下,各基因表达量逐渐降低,在24 h达到最低值。以上结果表明,泛素结合酶亚家族UBC2基因受低氮胁迫的影响其表达量发生了变化。
关键词:泛素结合酶;系统进化分析;生物信息学;低氮胁迫反应
中图分类号:Q786 文献标识码:A
Abstract: Ubiquitin-binding enzyme is an important component of the ubiquitin/proteasome pathway, playing an important role in protein ubiquitination. In this study, bioinformatics tools were used to systematically analyze the maize gene structure and evolution relationship of ubiquitin E2 family members. Phylogenetic analysis showed that the maize ubiquitin-binding enzyme genes could be divided into six subfamilies. The number of the members in each subfamily is different. Subfamily UBC1 contained the largest numbers (22 genes), while the least number of members was UBC3, only five genes. Based on the subfamily UBC2, it was found that there were four paralogous genes in UBC2, namely ZmUBC3/ZmUBC70, ZmUBC8/ZmUBC34, ZmUBC31/ZmUBC53 and ZmUBC45/ZmUBC66. Gene structure analysis revealed that the paralogous genes were similar in structure. ZmUBC45/ZmUBC66 contained the largest number of exons (9 exons) while ZmUBC31/ZmUBC53 only had four. Gene motif analysis results showed ZmUBC3/ZmUBC70 contained eight motifs while ZmUBC8/ZmUBC34 and ZmUBC31/ZmUBC53 only had three. Gene promoter element analysis revealed that there were five component types, which were photo response elements, hormone response elements, stress response elements, tissue expression related components, and periodic regulation related components. Gene expression analysis indicated that all the tested genes had high expression levels in the female flowers but the lowest expression in roots and stems. The low nitrogen stress test suggested that the relative expression of all the tested genes decreased rapidly to a minimum at 1th hour, then increased slowly. Under low concentration of NH4+ treatment, the expression level of each gene gradually decreased and reached the lowest value at the 24th hour point. The results suggested that the maize ubiquitin-binding enzyme genes may be involved in the response of low nitrogen stress pathway.
Keywords: ubiquitin-binding enzyme; phylogenetic analysis; bioinformatics; low nitrogen stress response
玉米是世界主要粮食作物之一,也是我国种植面积最大、用途最广、总产量最高的作物。其在整个生长周期中会受到各种外界不利因素的影响,严重时会造成减产甚至死亡。植物在长期的自然进化过程中形成了一套完整的防御机制,能确保自身顺利繁衍下去。泛素化过程是真核生物体内普遍存在的一种特异性降解蛋白途径,能调控细胞周期、DNA修复、逆境胁迫以及蛋白质的胞内定位等诸多生物学过程[1]。泛素E2家族是植物泛素/蛋白酶体系统中的重要组成部分,含有一个具有140~220 aa的UBC保守催化结构域,能够通过UBC结构域与E3的RING结构域相互作用并特异性识别底物蛋白[2]。目前已在多种物种中鉴定出了泛素结合酶基因,其中酵母中14个[3]、拟南芥中37个[4]、水稻中48个[5]、番茄中52个[6]、人类50个[7]等。研究表明,E2基因在植物的生长发育、DNA修复以及逆境胁迫等方面具有重要的作用。E2基因通过与蛋白Mms2p/Uevla形成复合物,在UBC保守结构域的赖氨酸催化位点上形成泛素链,进而对受损核酸进行修复[8]。在拟南芥中,AtUBC13与E3连接酶RNF8 协同产生RNF8- UBC13复合物,定位受损核酸并将其泛素化并传递信号至RAP80 修复蛋白,对受损DNA进行修复[9]。番茄果实中E2基因的启动子区能够与果实成熟调控因子(RIN)相结合,将E2基因沉默后发现,番茄成熟时果实着色发生了改变[10]。在拟南芥中,AtUBC1与AtUBC2在叶和花中大量表达,并能够结合和激活基因Flowering Locus C,抑制拟南芥的开花[11]。一些研究者还发现,棉花中GhUNC1与GhUNC2基因能够通过选择性降解调控生长素运输过程的蛋白,继而延迟植株的衰老[12]。在逆境胁迫中,E2基因同样具有重要的作用。将拟南芥进行缺铁处理,过表达AtUBC13基因后,拟南芥根部对铁元素的吸收效率明显提高,将AtUBC13敲除后,植株则表现出了明显的缺铁症状[13]。将大豆Gm?UBC2基因转入到拟南芥中过表达发现,拟南芥对干旱及盐胁迫的耐受性增强[14]。此外,Eunsook等[15]发现绿豆中的VrUBC1基因参与对细胞渗透压的调控过程。Mural等[16]发现E2基因能够调节增强植物自身的免疫能力从而提升对植物病原菌的抗性。
氮素作为植物重要的信号分子,在植物的生长以及逆境胁迫中都有着重要的作用。植物根系吸收的氮素形态主要由铵态氮和硝态氮两种形式,在氮素缺乏时,植物自身会激活根系的“觅食反应”,改变根部结构来增强对土壤环境中的氮素感知和吸收能力[17]。有研究表明,蛋白的泛素化过程参与了植物缺素后的信号转导途径[18]。在低氮环境下,拟南芥AtUBC8蛋白在细胞核中与NLA基因编码的一类RING型的泛素连接酶进行互作,来调控植株缺氮后的适应性反应,将NLA基因Ring结构域突变后,AtUBC8基因无法定位NLA基因并进行互作,nla突变体表现出对低氮溶液超敏现象[19]。同样在拟南芥中,PHO2作为磷转运负调控因子,通过与AtUBC24结合参与到对植物体内磷代谢途径中,在pho2突变体中,植株地上部分磷含量超常积累,无法对体内磷素进行运输和再分配,植株表现出磷中毒现象[20]。目前对于植物E2家族基因的功能的研究已有较多报导,但大部分主要集中在模式植物拟南芥上以及植物抗逆胁迫方面,对于泛素结合酶E2在植物缺素胁迫响应中的功能的研究尚不多见。已有研究对玉米E2家族基因进行了鉴定和分类[21],为进一步研究E2基因在玉米吸收氮素的途径中的作用,本研究通过生物信息学、qRT-PCR方法对该家族成员进行了基因结构及表达模式的初步研究。
1 材料与方法
1.1 实验材料及处理方法
供试材料为玉米自交系Mo17,由中国热带农业科学院玉米研究中心提供。种子播种于25 cm×20 cm的塑料盆中,所用土壤为基质营养土(营养土∶蛭石=3∶1),萌发后置于恒温光照培养箱中培养。调整培养箱恒定温度为(26±6)℃,光照时间为12 h。待幼苗长至三叶期时,剔除弱苗及死苗,挑选出生长状态一致的健壮苗。以不作处理为对照,2个低氮处理分别为:(1)将幼苗置于1/50低氮Hoagland培养液(KNO3代替NH4NO3,且NO3浓度为对照组的1/50,溶液其它元素含量与对照均一样)中培养;(2)将幼苗置于1/50低氮Hoagland培养液(NH4Cl代替NH4NO3,NH4+ 浓度为对照组的1/50,溶液其它元素含量与对照均一样)中培养。分别取上述2种处理方式下对照组(0 h)和处理组1、6、24 h的幼苗叶片,每个时间点随机选取5株混合取样,放入液氮中速冻,并立即放入?80 ℃冰箱保存备用。所有实验均设3个重复。
1.2 玉米泛素结合酶基因的基因结构及系统进化分析
用生物信息学的方法对玉米泛素结合酶基因家族成员进行鉴定发现,泛素E2家族中共有75个泛素结合酶基因,根据其在染色体的位置将其依次命名为ZmSUS1-ZmSUS75[21]。本研究利用ME?ME4.0(http://meme-suite.org/tools/meme)工具分析玉米UBC家族蛋白的保守基序。利用在线软件Gene Structure Display Server2.0(GSDS2.0)分析玉米E2基因的内含子/外显子结构。运用MEGA6软件,采用邻接法(Neighbor-joining),使用P-距离模型,重复次数设置为1000,构建系统进化树。
1.3 玉米泛素E2基因家族成員启动子作用元件分析
从Ensembl Plants(http://plants.ensembl.org/ Zea_mays/Info/Index)中搜索UBC家族成员的基因编号,获取基因上游约1500 bp的片段序列,将序列导入PlantCARE(http://bioinformatics.psb. ugent.be/ webtools/plantcare/html/)中,可获得目的基因启动子上的每一个作用元件,从而预测基因的潜在生物学功能。
1.4 不同组织器官的表达模式分析
利用北京华越洋生物有限公司生产的RNA提取试剂盒提取玉米在抽雄期根、茎、叶、穗丝、雄花和幼果的总RNA,并通过逆转录试剂盒获取其cDNA,具体操作方法见说明书。并根据基因全长利用Primer premier 5.0软件设计荧光定量PCR引物(交由生工生物工程(上海)有限公司合成)。表1为组织器官特异性表达以及低氮胁迫下相对定量所用的对应引物,内参基因为18S rRNA。荧光定量所用仪器为罗氏LightCycler?96实时荧光定量PCR仪,逆转录反应选用M-MLV逆转录酶(TaKaRa公司生产),荧光定量PCR试剂盒选用TaKaRa公司生产的SYBR Green Master Mix。反应体系为10 L,其中SYBR Green Master Mix酶混合液5 L,上下游引物各1 L,cDNA模板0.8 L,其余不足部分补足ddH2O至10 L。反应程序为:95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸40 s,循环数为40个,每个样品设3个重复,并利用2ΔΔCT计算各基因相对表达量大小。
1.5 低氮胁迫下泛素E2家族基因成员的表达分析
以低氮条件处理后的对照组及实验组的不同时间点下的叶片cDNA为模板,以18S rRNA为内参基因,选用引物见表1,反应体系及PCR扩增程序同1.4中一样。
1.6 数据处理
利用Excel 2010软件处理数据并作图,利用SPSS 20.0软件进行数据差异显著性分析。
2 结果与分析
2.1 玉米泛素结合酶蛋白家族的系统进化分析
对玉米E2家族75个成员构建系统发育树(图1)。结果显示,玉米E2蛋白家族可分为UBC1~ UBC6共6个亚家族,不同亚家族之间成员数目差异较为明显,UBC1成员数目最多,为22个,UBC3最少,仅为5个。不同亚家族间旁系同源蛋白数量差异明显,亚家族UB1中旁系同源蛋白数量为9对,亚家族UBC2中为4对,亚家族UBC3中为2对,亚家族UBC4中为6对,亚家族UBC5中为3对,亚家族UBC6中为5对,说明生物在进化的过程中逐渐产生了功能有差异性的同源蛋白。
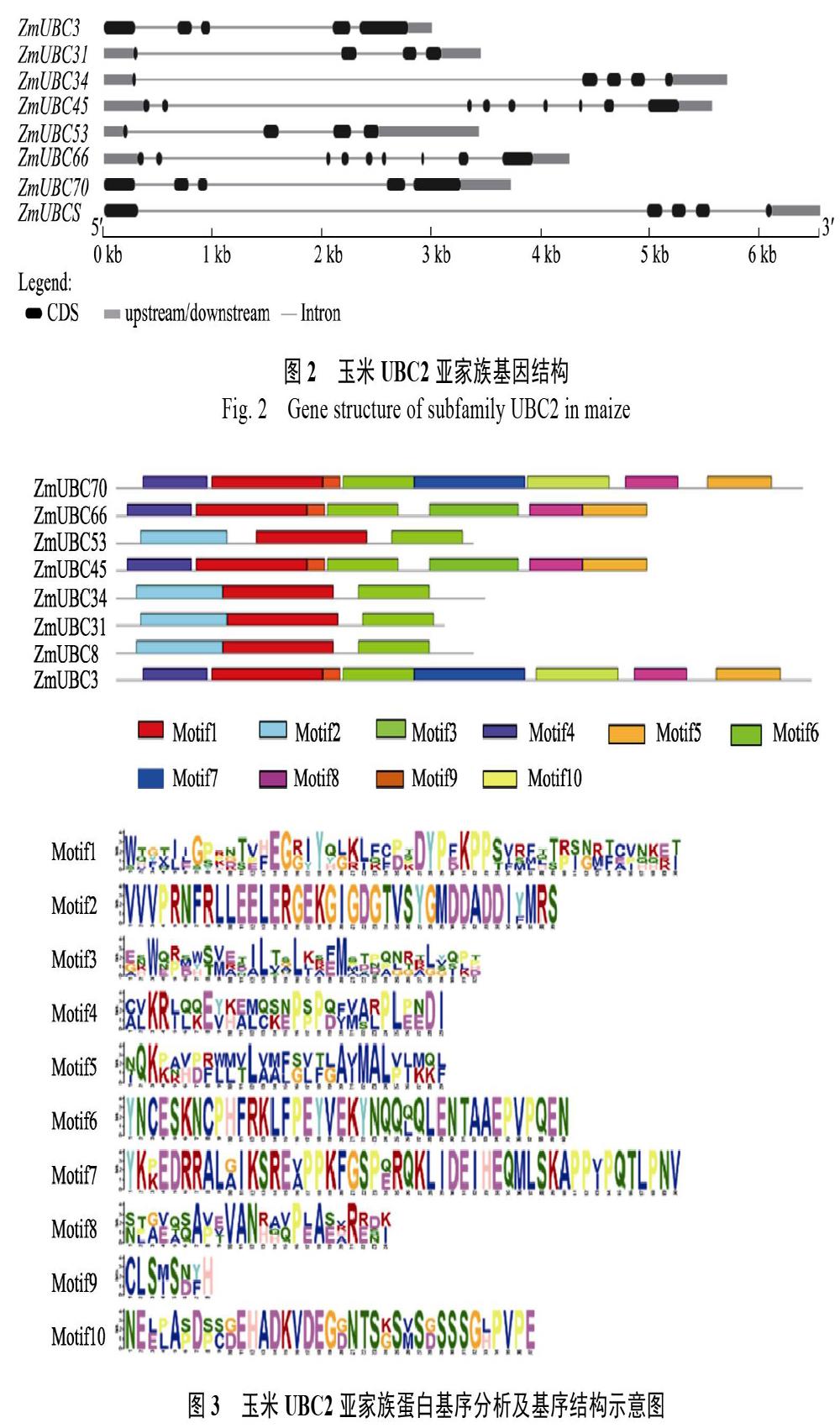
为了解不同亚家族成员之间的基因结构及表达模式的差异性,本研究选择UBC2亚家族成员作为研究对象进行基因结构、基序以及后续的基因表达差异性分析(图2)。进化关系显示,UBC2亚家族中存在4对旁系同源基因,其分别是ZmU?BC3/ZmUBC70、ZmUBC45/ZmUBC66、ZmUB?C31/ ZmUBC53以及ZmUBC8/ZmUBC34。内含子/外显子作为家族基因进化的重要印迹,对基因的结构和功能有着重要的影响。基因结构分析表明,UB?C?2
图1 玉米E2家族蛋白系统进化树
Fig. 1 Unrooted dendrogram of all maize E2 proteins
亚家族中互为同源基因的成员含有相似的基因结构,ZmUBC45/ ZmUBC66含有外显子数量最多,为9个,ZmUBC31/ ZmUBC53外显子含量最少,为4个。对玉米UBC2亚家族成员蛋白保守基序进行预测,预测结果也基本支持了玉米E2基因家族系统发育分析的分类以及UBC2亚家族基因结构分析结果。
基因保守基序预测结果如图3所示,互为同源基因的成员其基序数量相同,基序排列顺序相似。基序含量最多的同源基因对是ZmUBC3/ZmUBC70,基序数量为8个,缺少motif2与motif6。ZmUBC8/ZmUBC34与ZmUBC31/Zm?UB?C53基序含量最少,均为3个,含有motif1、motif2以及motif3。以上结果表明,同一亚家族中不同基因的结构及基序存在一定的差异,其差异可能在基因的功能特异性中具有重要的作用。
2.2 玉米泛素结合酶家族基因的启动子作用元件分析
基因启动子元件分析结果显示,玉米E2基因启动子含有元件主要可分为5大类,依次为光响应元件、胁迫响应元件、激素响应元件、组织表达相关元件以及周期性调控相关元件(表2)。不同成员含有的元件类型和数量均有差别。Zm?UB?C3不含有组织表达及周期性调控相关元件,而ZmUBC34、ZmUBC45及ZmUBC66则含有上述5大类元件。所有成员均含有光、激素、胁迫相关响应元件,不同成员所含数量差异较大,表明玉米UBC2亚家族基因成员间功能差异明显。
进一步分析激素类启动子元件和胁迫响应元件类型发现,激素类启动子元件分为5类:分别为生长素(IAA)、赤霉素(GA)、水杨酸(SA)、脱落酸(ABA)和茉莉酸甲酯(MeJA)。前3类对植物主要起促进生长发育的作用,后2类主要功能为调控果实的成熟。从图4A中看出,UBC2亚家族成员所含有的激素元件类型主要为茉莉酸甲酯和脱落酸,表明E2基因家族参与了果实成熟的调控过程。胁迫类型元件主要分为缺氧性诱导与干旱和低温胁迫2大类(图4B)。缺氧性诱导元件数量最大,存在于所有被检测基因中,揭示了E2基因可能参与了玉米的缺氧性应答反应,如高海拔地區种植或玉米根部发生无氧呼吸等情况。
2.3 玉米E2基因在不同组织的表达分析
如图5所示,玉米泛素结合酶基因在被检测的不同部位中均有表达,且表达差异明显。Zm?UBC3、ZmUBC31、ZmUBC34、ZmUBC45、ZmUBC53和ZmUBC66在玉米雌花中的表达量最高,在茎和叶中表达量最低。ZmUBC8在苞叶中的表达量最高,在叶、雌花及雄穗中也有较高的表达量,在茎中表达量最低。ZmUBC70检测发现在叶中具有最高的表达量,在茎中表达量最低。
2.4 玉米E2基因在不同氮形态胁迫下的表达分析
为探究上述8个基因在不同氮形态胁迫下的表达模式,本研究利用硝酸钾和氯化铵分别代替原Hoagland中硝酸铵成分,检测目标基因在不同氮素胁迫下的响应情况。结果表明,在低浓度硝态氮胁迫下,被检测的8个基因表达水平均出现不同程度的下降,ZmUBC3、ZmUBC8、ZmUBC31、ZmUBC34、ZmUBC45、ZmUBC53、ZmUBC66在处理后的1h下降到了最低水平,随后在6、24 h内表达水平逐渐上升,但仍小于0 h(对照)时基因的表达量(图6)。ZmUBC70在6 h时表达量最低,在24 h表达水平有一定上升,但并不明显。而在低浓度铵态氮的胁迫下,被检测基因表达水平同利用硝态氮胁迫情况类似,基因表达下调,不同的是,在铵态氮胁迫下,基因表达水平逐步下降,在24 h时达到最低水平。以上结果说明,玉米中8个基因对于硝态氮胁迫响应速度要快于铵态氮。而上述被检测基因均来自于玉米泛素结合酶UBC2亚家族,表明玉米泛素结合酶可能参与了玉米对铵态氮和硝态氮的胁迫响应过程。
图5 玉米UBC2亚家族基因在不同组织的表达分析
Fig. 5 Expression analysis of maize UBC2 subfamily gene in different maize tissues
图6 UBC2亚家族基因在不同低氮形态胁迫下的表达分析
Fig. 6 Expression analysis of UBC2 Subfamily gene under different low nitrogen stress
3 讨论
生物信息学作为分析基因组结构和功能的重要工具,在基因家族成员鉴定、理化性质分析、系统进化分析、蛋白结构分析以及功能预测等方面具有重要作用。而泛素E2家族作为植物泛素家族中的重要组成部分,在植物的生长发育、形态建成以及生物和非生物胁迫中起到了重要的作用[16]。本研究通过生物信息学方法对玉米泛素UBC家族基因进行了分析。系统进化树分析发现,玉米泛素E2家族内部分为6个亚家族,暗示了基因功能的多样性,表明玉米E2基因在进化过程中是按照物种进化的特异性进行扩张。基因结构分析发现,同一个亚家族中不同UBC基因的内含子和外显子数量以及基因长度等均有一定的差异,但同属一个旁系同源基因对的基因其基因结构相似,内含子及外显子数量均一致。同样蛋白基序预测结果显示,互为旁系同源基因的成员其基序数量相同,排列顺序一致,而非旁系同源基因对的基因基序数量、结构差异明显。其说明泛素结合酶基因结构域的进化可能导致了基因结构的多样性。
泛素结合酶作为植物泛素/蛋白酶体系统的主要成分,在植物的生长发育、信号转导、蛋白运输以及生物或非生物胁迫应答中均起到了重要的作用。启动子是控制基因转录起始的关键性结构,位于基因5端的上游,能够调控RNA聚合酶与DNA模板的精准结合,并通过上下游顺式作用元件调控基因的表达[22]。本研究对启动子元件类型进行分析发现,泛素结合酶所含启动子元件类型主要分为光响应元件、激素响应元件、胁迫响应元件、组织表达调控元件以及周期性调控元件5大类。在激素类中,脱落酸与赤霉素顺式元件存在于所有被检测基因中,其说明泛素UBC基因可能参与了对植物的生长发育和果实的成熟调控过程。在逆境胁迫元件中,被检测UBC基因以缺氧性诱导元件居多,其暗示泛素UBC基因可能响应玉米低氧胁迫反应。
对基因的组织表达模式分析有助于了解基因的生物学功能。本研究中,在玉米抽穗期对UBC2亚家族中的8个基因进行组织器官表达分析,各基因在不同组织器官中进行了差异性表达。旁系同源基因ZmUBC45与ZmUBC66以及ZmUBC31与ZmUBC53具有相似的表达模式,其意味着旁系同源基因中的某个基因的表达已经不占据主导地位,可能产生了“冗余”现象。ZmUBC3/ZmUB?C70和ZmUBC8/ZmUBC34两对同源基因中,成员内部之间具有不同的表达模式,其表明这些基因家族成员可能正在加剧分化,产生了不同的生物学功能。
氮素作为植物生长发育所必需的大量元素之一,与植物体内蛋白、核酸、磷脂以及激素的合成密切相关[23]。研究发现,氮素作为植物叶绿素的重要组成部分,能够影响植物光合作用中的酶活性。此外,植物体内氮素水平能够影响ABA的含量,并协同ABA一起参与调节植物叶片气孔的开放过程,提升光合作用效率[24-25]。植物体内氮素还能够与土壤中水分发生正向交互作用,提升作物根系对水分的吸收效率,进而提升作物的抗旱水平,提高产量[26]。植物在生长发育过程中会受到各种逆境胁迫作用,同时也形成了抵御逆境胁迫的一系列机制。泛素结合酶作为植物泛素/蛋白酶体系统中的重要组分,对蛋白进行泛素化修饰和降解,在植物响应逆境中有着重要作用。为了解低氮胁迫下植物泛素基因的表达模式,本研究利用NH4+及NO3 两种形态的氮素营养对玉米幼苗进行低氮胁迫处理。检测结果显示,各基因表达模式相似,在低浓度KNO3溶液处理后1 h,基因相对表达量迅速降至最低,随后逐步上升。经低浓度NH4Cl溶液处理后,基因表达量逐步下降,这与Peng等[27]的研究结果有一定差别。Peng等[27]研究结果显示,对拟南芥进行低氮条件下处理4周后,泛素基因相对表达量均显示上调。猜测在低氮处理条件下,泛素基因的表达可能与实验材料处理时间的长短有关,随着处理时间的不断变长,泛素基因的表达量先降低后升高,最后趋于稳定。当然这些猜想需要通过后续进一步实验来论证。以上结果说明,玉米泛素结合酶UBC2亚家族基因在应对低浓度NO3和NH4+ 两种形态氮素胁迫时具有不同的应答模式,在受胁迫影响后基因表达水平迅速发生变化,推測该家族基因可能参与了玉米应答低氮胁迫响应途径。
參考文献
Unver T, Turktas M, Budak H. In Planta evidence for the involvement of a ubiquitin conjugating enzyme (UBC E2 clade) in negative regulation of disease resistance[J]. Plant Molecular Biology Reporter, 2013, 31(2): 323-334.
Huang L, Kinnucan E, Wang G, et al. Structure of an E6AP-Ubc H7 complex: insights into ubiquitination by the E2-E3 enzyme cascade[J]. Science, 1999, 286(5443): 1321-1326.
Michelle C, Vourch P, Mignon L, et al. What was the set of ubiquitin and ubiquitin-like conjugating enzymes in the eukaryote common ancestor?[J]. Journal of Molecular Evolution, 2009, 68(6): 616-628.
Kraft E, Stone S L, Ma L, et al. Genome analysis and functional characterization of the E2 and RING-type E3 ligase ubiquitination enzymes of Arabidopsis[J]. Plant Physiology, 2005, 139: 1597-1611.
Bae H, Kim W T. Classification and interaction modes of 40 rice E2 ubiquitin-conjugating enzymes with 17 rice ARM-U-box E3 ubiquitin ligases[J]. Biochemical and Biophysical Research Communication, 2014, 444(4): 575-580.
Wang Y, Wang W, Cai J, et al. Tomato nuclear proteome reveals the involvement of specific E2 ubiquitin-conjugating enzymes in fruit ripening[J]. Genome Biology, 2014, 15(12): 548.
Jiang Y H, Beaudet A L. Human disorders of ubiquitination and proteasomal degradation[J]. Current Opinion in Pediatrics, 2004, 16(4): 419-426.
Hoege C, Pfander B, Moldovan G L, et al. RAD6-dependent DNA repair is linked to modification of PCNA by ubiquitin and SUMO[J]. Nature, 2002, 419(6903): 135-141.
Wang B, Elledge S J. Ubc13?Rnf8 ubiquitin ligase control foci formation of the Rap80?Abraxas?Brcc36 complex in response to DNA damage[J]. PNAS, 2007, 104(52): 20759-20763.
Wang Y, Wang W, Cai J, et al. Tomato nuclear proteome reveals the involvement of specific E2 ubiquitin-conjugating enzymes in fruit ripening [J]. Genome Biology, 2014, 15(12): 548-567.
Xu L, Menard R, Berr A, et al. The E2 ubiquitin-conjugating enzymes, AtUBC1 and AtUBC2, play redundant roles and are involved in activation of FLC expression and repression of flowering in Arabidopsis thaliana[J]. The Plant Journal, 2009, 57(2): 279-288.
Zhang X D, Jenkins J N, Callahan F E, et al. Molecular cloning, differential expression, and functional characterization of a family of class I ubiquitin-conjugating enzyme (E2) genes in cotton (Gossypium)[J]. BBA - Gene Structure and Expression, 2003, 1625(3): 269-279.
Li W, Schmidt W. A lysine-63-linked ubiquitin chain-forming conjugase, UBC13, promotes the developmental responses to iron deficiency in Arabidopsis roots[J]. The Plant Journal, 2010, 62(2): 330-343.
Zhou G A, Chang R Z, Qiu L J. Overexpression of soybean ubiquitin-conjugating enzyme gene GmUBC2 confers enhanced drought and salt tolerance through modulating abiotic stress-responsive gene expression in Arabidopsis[J]. Plant Molecular Biology, 2010, 72(4-5): 357.
Eunsook C, Chang-Woo C, Hyun-Ah S, et al. Overexpression of VrUBC1, a mung bean E2 ubiquitin-conjugating enzyme, enhances osmotic stress tolerance in Arabidopsis[J]. PloS One, 2013, 8(6): e66056.
Mural RV, Liu Y, Rosebrock TR, et al. The tomato Fni3 lysine-63-specific ubiquitin-conjugating enzyme and suv ubiquitin E2 variant positively regulate plant immunity[J]. Plant Cell, 2013, 25(9): 3615-3631.
Xuan W, Beeckman T, Xu G. Plant nitrogen nutrition: sensing and signaling[J]. Current Opinion in Plant Biology, 2017, 39: 57-65.
Lin W Y, Lin S J, Chiou T J. Molecular regulators of phosphate homeostasis in plants[J]. Journal of Experimental Botany, 2009, 60(5): 1427-1438.
Peng M S, Hannam C, Gu H L, et al. Amutation in NLA, which encodes a RING-type ubiquitin ligase, disrupts the adaptability of Arabidopsis to nitrogen limitation[J]. The Plant Journal, 2007, 50(2): 320-337.
Chiou T J, Aung K Y, lin S L, et al. Regulation of phosphate homeostasis by microRNA in Arabidopsis[J]. Plant Cell, 2006, 18: 412- 421.
陈 曙, 赵秋芳, 陈宏良, 等. 玉米泛素结合酶基因家族的生物信息学及表达分析[J]. 南方农业学报, 2018, 49(8): 1476-1483.
Gao H, Wang Y, Xu P, et al. Overexpression of a WRKY transcription factor TaWRKY2 enhances drought stress tolerance in transgenic wheat[J]. Frontiers in Plant Science, 2018, 9: 997-1016
Straub T, Ludewig U, Neuhaeuser B. The kinase CIPK23 inhibits ammonium transport in Arabidopsis thaliana[J]. The Plant Cell, 2017, 29(2): 409-422.
Tambussi E A, Nogués S, Araus J L. Ear of durum wheat under water stress: Water relations and photosynthetic metabolism[J]. Planta, 2005, 221(3): 446-458.
馮建灿, 胡秀丽, 毛训甲. 叶绿素荧光动力学在研究植物逆境生理中的应用[J]. 经济林研究, 2002(4): 14-18, 30.
戢 林, 李廷轩, 张锡洲, 等. 氮高效利用基因型水稻根系形态和活力特征[J].中国农业科学, 2012, 45(23): 4770-4781.
Peng M S, Bi Y M, Zhu T, et al. Genome-wide analysis of Arabidopsis responsive transcriptome to nitrogen limitation and its regulation by the ubiquitin ligase gene NLA[J]. Plant Molecular Biology, 2007, 65 (6): 775-797.
