花粉管通道法转化荔枝的初步研究
2020-03-23王树军孙进华李焕苓王果李芳王家保
王树军 孙进华 李焕苓 王果 李芳 王家保


摘 要:为开拓荔枝转基因育种新途径,以GUS基因作为报告基因,用花粉管通道法转化授粉后24 h的‘新球蜜荔荔枝雌花,并统计座果率、成苗率、转化率。结果显示:共获得303株实生苗,经PCR检测和GUS染色法证实外源基因整合到4株荔枝苗基因组中,转化率为1.32%。此研究结果为荔枝生物技术育种提供了一种简单有效的途径。
关键词:荔枝;花粉管通道;转基因;育种
中图分类号:S667.1 文献标识码:A
Abstract: In order to develop a new gene transformation pathway for litchi, the female flowers of Xinqiumili (24 h after pollination) were transformed by the pollen tube pathway method, using GUS as a report gene, and the fruit set percentage, seeding rate, and conversion rate were counted. A total number of 303 seedlings were obtained, and four positive transformed plants were verified according to PCR analysis and GUS staining, the transformation rate was 1.32%. This study would provide a simple and efficient way for the biotechnology breeding of litchi.
Keywords: litchi; pollen tube path; transgenic; breeding
荔枝(Litchi chinensis Sonn.)是華南重要的特色水果,其产业在区域农业经济中占有重要地位。但采前蒂蛀虫危害和采后果皮褐变等问题限制了荔枝产业的发展。培育多抗、优质耐贮的新品种是解决荔枝产业发展的根本途径。由于荔枝遗传基础狭窄,缺乏抗性资源,使荔枝抗性育种进展缓慢。但现代植物转基因技术的兴起与发展为荔枝育种提供了新方向。目前,已见报道的成功案例均是通过农杆菌介导法[1]和基因枪法[2]实现荔枝转基因育种,但这2种方法均必须经过繁琐的组织培养和再生过程,周期较长。Zhou等[3]在1983年首次提出花粉管通道法,该法巧妙利用有花植物授粉后形成的花粉管外通道,将外源DNA直接导入胚囊,对还处于融合期没有形成细
胞壁的受精卵细胞或者是早期的胚胎细胞进行转化。花粉管通道法操作简单,技术成本低廉,不依赖于组织培养,直接从萌发的种子获得实生苗筛选转化株,是一种简便、高效的转基因方法[4]。自创立以来已在辣椒[5]、蝴蝶兰[6]、铁皮石斛[7]、黑杨[8]、番木瓜[9]等植物育种中得到应用。本研究首次采用花粉管通道法对荔枝遗传转化进行探索,旨在寻找一种适用于荔枝的简便、高效遗传转化方法,为加速荔枝生物技术育种进程提供基础。
1 材料与方法
1.1 材料
本研究在中国热带农业科学院试验基地果园进行,选取‘新球蜜荔品种为材料。在第1批雄花将谢,雌花即将大量开放时期,选择花期相对一致、花穗多、树体健壮的荔枝树作为转基因母树。农杆菌菌株选用EHA105,植物表达载体选用包含GUS基因的pCAMBIA1301质粒。
1.2 方法
1.2.1 农杆菌菌液的制备 用热激转化法将质粒pCAMBIA1301转入农杆菌EHA105感受态细胞,恢复培养后在添加了卡那霉素(Kan)100 mg/L和利福平(Rif)100 mg/L的LB固体培养基上涂板,利用菌落PCR方法鉴定出阳性单菌落后培养,液体培养基为LB+Kan 100 mg/L+Rif 100 mg/L,在200 r/min,28 ℃条件下培养过夜。按1∶100的比例,转接到含有Kan 100 mg/L+Rif 100 mg/L的1 L液体LB培养基中,在相同条件下扩大培养至OD600为0.8。将获得的农杆菌菌液5000 r/min离心10 min,收集菌体。然后用1 L转化缓冲液重悬菌体至OD600值为0.8。农杆菌转化缓冲液配方为:1/2 MS+100 ?mol/L AS+Silwet L-77(0.05% V/V)+蔗糖(5 mg/L)+0.0l mg/L 6-BA,pH调至5.8。
1.2.2 农杆菌转化液对花粉萌发的影响 在雄花盛花期,摘取带有淡黄色雄花的花穗,保湿带回实验室后,用镊子将淡黄色雄花花朵摘下,置于40 ℃的烘箱内12 h,使其干燥散粉后,利用80目筛子收集金黄色花粉于2 mL离心管内备用。
花粉萌发培养基的制备参照李焕苓等[10]方法,取10 g蔗糖和1 g琼脂加入到0.5 mg/L硼酸水溶液100 mL,加热溶解。待培养基温度冷却至不烫手,滴加1滴至曲面载玻片上,培养基凝固冷却后备用。此外,分别制备1/2 MS、1/2 MS+ 100 ?mol/L AS、1/2 MS+Silwet L-77 (0.05% V/V)、1/2MS+100 ?mol/L AS+Silwet L-77(0.05% V/V)4种液体培养基以及OD600为0.1、0.2、0.4、0.6、0.8、1.0的农杆菌菌液,用于重悬适量花粉,摇匀后静置5 min,滴加1滴花粉液在冷却的硼酸固体培养基上,将载玻片放置在28 ℃且保湿的环境中。3 h后在Nikon ECLIPSE Ti显微镜下观察载玻片上的花粉萌发情况。
1.2.3 花粉管生长的荧光显微观察 选取盛花期的花穗疏花,待雌花柱头微微露白,去雄并套袋隔离。雌花柱头开裂即将弯曲时进行人工授粉并继续套袋隔离。授粉后1~10 h,每隔1 h取样1次;授粉后10~30 h,每隔2 h取样1次;授粉后30~48 h,每隔6 h取样1次。每次取10个雌蕊,用卡诺氏固定液固定12 h后转入70%乙醇中低温保存备用。荧光显微观察前,用8 mol/L NaOH软化雌蕊4~5 h,蒸馏水冲洗后,在0.05%苯胺蓝溶液中染色4 h。压片后,在ZEISS Stereo Lumar.V12显微镜356 nm波长下观察,分别观测柱头上花粉的萌发和花粉管在花柱内的生长情况。
1.2.4 侵染转化 选好试验树后,对花穗进行疏花和去雄处理,保留柱头未开裂的雌花,套袋隔离。待雌花柱头开裂,将贮藏的花粉用授粉笔点授于雌花柱头,套袋隔离。根据花粉管生长的荧光显微观察结果确定适宜的转化时机。将制好的农杆菌转化液倒入大烧杯中,浸没授粉后的雌花花穗10 s。同时,选择一些雌花用刀片从花柱基部切割柱头后用农杆菌转化液浸没10 s。对处理的花穗挂牌做标记并做套袋处理,侵染结束1周后去除套袋。待果实成熟后统计座果率,公式如下:
座果率=果实数量/转化雌花数量×100%。
取种子洗净,播种,4周后统计成苗率,公式如下:
成苗率=成苗数量/播种种子数量×100%。
1.2.5 PCR检测 取播种后长成的实生幼苗叶片提取DNA,做PCR检测。引物F和R根据潮霉素基因设计(引物序列:F: 5-AAAAGTTCGACA GCGTCTC-3;R: 5-GCGACCTCGTATT?GG?GA?A? T?C-3),PCR反应程序为:94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min, 35次循环;72 ℃延伸5 min。统计阳性转化率,公式如下:
转化率=阳性苗数量/成苗数量×100%。
1.2.6 GUS组织化学染色 取转化2周后的部分幼果以及PCR检测结果为阳性的实生幼苗的根和叶片,切成小块,用无菌水清洗之后置于GUS染液[50 mmol/L pH 7.0磷酸钠缓冲液、0.1 mmol/L K3[Fe(CN)6]、0.1 mmol/L K4[Fe(CN)6]、1 mmol/L Na2EDTA、0.1% Triton-100、20%甲醛、0.5 mg/mL X-Gluc加入中、37 ℃染色过夜,酒精脱色后在OLYMPUS SZX7显微镜下观察染色结果。
2 结果与分析
2.1 农杆菌转化液对花粉萌发影响研究
花粉管通道法大致有4种:柱头涂抹法、浸泡法、断口滴加法和注射法[11-14]。在应用花粉管通道法转化外源基因时,应根据不同物种花的特性及开花习性选择适合的方法[15]。柱头涂抹法、子房注射法、断口滴加法,均適合用于子房较大的开花植物[16]。而荔枝花小而密,宜选择浸泡法。花粉能正常萌发是花粉管通道法成功应用的前提条件,因此首先开展了农杆菌转化液对‘妃子笑花粉萌发影响的研究。显微观察并统计发现:经1/2 MS和1/2 MS+AS重悬后的花粉萌发率分别为34%和32%,而经过1/2MS+Silwet L-77、1/2 MS+ AS+Silwet L-77和不同浓度的农杆菌菌液重悬后的花粉萌发率均为0%。由此推断,转化液中的乙酰丁香酮(AS)不影响花粉萌发,但Silwet L-77和不同浓度的农杆菌菌液均会抑制花粉萌发(图1,图2)。综上可见,农杆菌转化液包裹荔枝花粉会抑制花粉萌发,导致无法形成花粉管通道。因此,花粉管通道法中农杆菌就只能借助荔枝雌花授粉后已形成的花粉管通道到达胚囊。
2.2 花粉管生长的荧光显微观察
选取‘新球蜜荔的雌花为母本,以‘妃子笑、‘新球蜜荔的花粉为父本,开展荔枝花人工授粉授精过程的研究,进行花粉管通道生长的荧光显微观察。结果显示,‘新球蜜荔雌花授粉后约8 h,花粉管伸长可达花柱道基部,约授粉16~18 h以后,花粉管穿过花柱道基部继续向子房延伸。根据观察结果确定授粉后24 h的雌花为理想的实验材料(图3)。
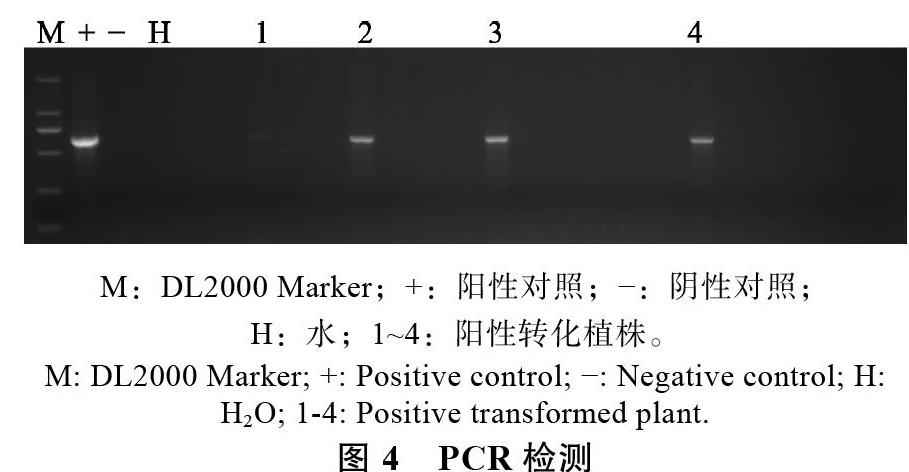
2.3 PCR检测
本研究共获得376粒花粉管通道法转化荔枝种子,播种后得到实生苗303株。提取幼苗叶片DNA后,经PCR检测证实获得4株转化株(图4),转化率为1.32%。此外,本研究还比较了柱头切割对荔枝花粉管通道法的影响(表1),结果显示,切割柱头处理不能有效提高转化效率,但会明显降低座果率。
2.4 GUS组织化学染色
随机取转化2周后的20颗幼果进行GUS染色,染色结果显示有1颗幼果的胚可见蓝色斑点。播种获得的实生苗进行PCR检测后,随机取阳性幼苗的根和叶片进行GUS染色。染色结果显示,
荔枝转基因育种的新途径具有重要的意义。农杆菌介导法和基因枪法均必须经过周期较长的组织培养过程,而利用自身的生殖系统作为载体的花粉管通道法在转基因育种中却可避免繁琐的组织培养和再生过程,能够直接通过花粉管通道转化目的基因,且还可克服远缘杂交的一些障碍,是一种便捷、有效的育种途径。因为该方法在应用中是通过收获种子,播种后直接获得转化植株,因此,要选择核大、丰产的荔枝品种进行实验,如‘新球蜜荔。
花粉管通道法早期的应用主要是将提取并纯化的含有目的基因片段的质粒DNA涂抹于雌花柱头或通过微量注射器注入子房。但由于‘新球蜜荔雌花盛开的季节海南正处高温天气,且实验是在田间活体开展,裸露的质粒DNA在阳光强烈的高温环境下易降解,难以达到转化目的。因此,本研究在探明花粉管通道萌发生长规律的基础上,选择授粉后24 h为最佳的转化时机,借助农杆菌携带质粒DNA进行转化,并初步鉴定获得转基因实生幼苗。借助花粉管通道使用农杆菌侵染的转化方法,首先要排除农杆菌自身造成的检测干扰。因此,本研究选择载体pCAM?B?I?A?1301中含有内含子的GUS基因作为报告基因,因为农杆菌等原核生物细胞在基因转录过程中没有剪接内含子的能力,所以含有内含子的基因只能在真核生物细胞中表达而不能在原核生物细胞中表达[20],从而避免农杆菌自身的GUS染色干扰。
花粉管通道法结合农杆菌介导转化的实验受外界环境条件影响较大。结果表明,本研究中荔枝的座果率较低,可能是与花期恰遇连续阴雨天气有关。座果率是影响花粉管通道法转化的关键因素之一。在实际的操作中可通过采取一些有效措施来提高座果率,比如选择晴天进行实验,避开中午高温天气进行实验,转化侵染后套袋等。因为花期雨水会导致落果,而睛天中午强烈的太阳强紫外线会降低农杆菌活性,套袋则既可避免雨水打湿,又可避免阳光直射。另外,部分研究表明,花粉管通道法转基因操作步骤中会有切割柱头的处理,目的是缩短侵染路径,但荔枝花较小,柱头本身较短,所以影响不明显。本研究发现,切割柱头并不能有效提高转化效率,反而会明显降低座果率,还会数倍增加工作量,降低实验效率。
本研究先通过潮霉素抗性基因PCR检测初步确定了4株转基因实生幼苗,为不影响幼苗的正常生长,仅在叶片和根部随机取样进行GUS染色,结果均呈阳性,这进一步证明外源基因整合到了荔枝基因组内。但由于GUS基因表达的丰度差异,显色部位多集中在叶脉和根尖。至于是否能稳定遗传,还需要对实验植株的下一代进行验证。
综上所述,本研究首次将花粉管通道法用于将外源基因导入荔枝,但是转化效率不理想,后续研究将在本实验基础上优化转化体系,对影响因素进行深入细致研究,以期建立简便、高效、稳定的荔枝花粉管通道法转基因技术体系。
参考文献
曾黎辉. 农杆菌介导荔枝(Litchi chinensis Sonn.)遗传转化体系的建立及导入LEAFY基因研究[D]. 福州: 福建农林大学, 2002.
桑庆亮. 荔枝(Litchi chinensis Sonn.)基因枪转化系统的建立与优化研究[D]. 福州: 福建农林大学, 2002.
[3]Zhou G Y, Weng J, Zeng Y, et al. Introduction of exogenous DNA into cotton embryos[J]. Methods in Enzymology, 1983, 101:433-448.
陈 彦, 孙宽莹, 张 涛. 通过改良农杆菌介导的floral-dip法和花粉管通道法转化紫薇[J]. 浙江大学学报(农业与生命科学版), 2012, 38(3): 250-255.
郭向萌, 周晓君. 花粉管通道法介导辣椒总DNA获得转基因小麦[J]. 江苏农业科学, 2018, 46(8): 36-38.
张 莉, 王 佳, 郑 枫, 等. 子房注射法转化‘紫宝石蝴蝶兰的研究[J]. 热带作物学报, 2018, 39(4): 669-674.
冼康华, 付传明, 何金祥, 等. 花粉管通道法介导的铁皮石斛转基因技术[J]. 广西植物, 2017, 37(9): 1101-1110.
赵鑫闻. 利用花粉管通道技術将外源银白杨DNA导入黑杨[J]. 植物学报, 2016, 51(4): 533-541.
王关林, 方宏筠. 植物基因工程[M]. 北京:科学出版社, 2002: 481-496.
李焕苓, 方星星, 王家保, 等. 海南不同荔枝优株花粉生物学特性研究[J]. 中国南方果树, 2016, 45(6): 69-73.
杨丽娜. rolC基因转化‘美人指葡萄的研究[D]. 南京: 南京农业大学, 2008.
陶建敏. 葡萄无核育种技术研究及种质创新[D]. 南京: 南京农业大学, 2007.
陈洪伟, 康向阳, 李艳华, 等. 花粉管通道法导入外源DNA技术及其在林木育种中的应用[J]. 分子植物育种, 2006, 46(S2): 127-132.
冯莎莎, 杜国强, 师校欣, 等. DNA浓度及注射时间对苹果花粉管通道法基因转化率的影响[J]. 中国农学通报, 2007, 23(4): 64-66.
陈 彦. 花粉管通道导入外源DNA方法的研究[J]. 北方园艺, 2010(13): 226-228.
哈斯阿古拉, 牛一丁, 张 丽, 等. 花粉管通道法转基因技术在甜瓜品种河套蜜瓜上的应用[J]. 内蒙古大学学报(自然科学版), 2007, 38(4): 419-423.
Puchooa D. Expression of green fluorescent protein gene in litchi (Litchi chinensis Sonn.) tissues[J]. The Journal of Applied Horticulture, 2004, 6(1): 11-15.
Das D K, Rahman A. Expression of a rice chitinase gene enhances antifungal response in transgenic litchi (cv. Bedana) [J]. Plant Cell Tissue Organ Culture, 2012, 109(2): 315-325.
Padilla G, Pérez J A, Perea-Arango I, et al. Agrobacterium tumefaciens-mediated transformation of 'Brewster' ('Chen Tze') litchi (Litchi chinensis Sonn.) with the PISTILLATA cDNA in antisense [J]. In Vitro Cellular & Developmental Biology Plant, 2013, 49(5): 510-519.
张岚岚, 刘小花, 陈昆松, 等. 一种植物表达载体的构建及其在金柑上的瞬时表达[J]. 果树学报, 2008, 25(3): 431-434, 449.
