玻璃化冷冻对小鼠卵母细胞透明带的影响
2020-03-23季珂萌成俊萍王勇杰张润祥白熙唐小川王晓丽
季珂萌,成俊萍,2,王勇杰,张润祥,白熙,唐小川,王晓丽*
(1. 广西大学动物科学技术学院,广西 南宁 530005;2. 广西壮族自治区人民医院,广西 南宁 530021)
近年来,卵母细胞的冷冻研究越来越受到研究者关注。冷冻保护剂对于卵母细胞的冷冻效果、细胞损伤情况至关重要,因此对于冷冻保护液配方的研究层出不穷,目前还没有可以让国内外相关研究学者统一使用的配方。而且卵母细胞保存过程仍存在许多缺陷。冷冻保存可降低卵母细胞质量,使卵母细胞透明带变硬,这些损伤可导致低受精率和发育潜力[1]。透明带(zona pellucida,ZP)在受精、早期胚胎发育和着床过程中起着重要作用[2],最早出现在初级卵泡中,由卵母细胞和卵泡细胞共同分泌。ZP特征反映了卵母细胞的发育潜力[3-4],与成熟期和受精期相关[5]。卵母细胞透明带厚度(zona pellucida thickness,ZPT)、透明带厚度变量(zona pellucida thickness variance,ZPTV)和透明带双折射(zona pellucida birefringence,ZPB)是检测卵母细胞透明带的主要参数[6-8]。本研究通过比较卵母细胞的存活率、受精率、卵裂率和囊胚形成率,探讨了四种冷冻保护液配方在小鼠卵母细胞中的应用效果。此外,还检测了ZPT、ZPTV、ZPB和超微结构,以进一步评估卵母细胞玻璃化的损伤。为改进玻璃化冷冻方法,提高玻璃化冷冻复苏后卵母细胞受精率提供研究思路和理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
4~5周龄雌性昆明白小鼠购自广西医科大学实验动物中心。
1.1.2 玻璃化冷冻载体(cryoleaf)的制备
以0.25 mL普通麦管为材料,将麦管有棉塞的部分剪去,然后一分为二。取其中一根麦管,在其一端用解剖刀剪成约20 mm长、2 mm宽的矩形薄片。
1.1.3 操作液
卵巢及卵丘卵母细胞复合体操作液:M2液。卵母细胞操作液及培养液:M199+5%FBS(胎牛血清)。
1.1.4 玻璃化冷冻液体
基础液(HM):TCM199+20%FCS;FS:0.3 g·mol/L聚蔗糖+0.5 mol/L蔗糖+HM;EDFS液:EG∶DMSO∶FS=1.5∶1.5∶7(V/V)的比例混匀。4组冷冻保护液配方如表1。
表1 4种冷冻液配方

组别平衡液冷冻液1HM+7.5%EG+7.5%DMSOHM+15%EG+15%DMSO+0.5 mol/L Su2HM+7.5%EG+7.5%DMSO+0.5 mol/L SuHM+15%EG+15%DMSO+0.5 mol/L Su3HM+10%EG+10%DMSOHM+20%EG+20%DMSO+0.5 mol/L Su4HM+10%EG+10%DMSOEDFS液
注:HM∶EG∶DMSO体积比V∶V∶V
解冻液①:HM+1mol/L Su;解冻液②:HM+0.5mol/L Su;解冻液③:HM
1.2 方法
1.2.1 卵母细胞采集
饲喂于25 ℃、自然采光条件下的4~5周龄的雌性小鼠,注射PMSG 10 IU/只,48 h后注射hCG 10 IU/只,13~16h后在输卵管膨大部中收集卵丘卵母细胞复合体(COCs)。将COCs移入含300 IU/mL透明质酸酶的M2液中,在37 ℃恒温台上轻轻吹打数次,收集形态正常有第一极体的卵母细胞于卵母细胞操作液中洗净后供实验用。
1.2.2 体外受精
取雄性小鼠附睾,挤刮出精液于平衡8 h的受精液 HTF液滴中,置于培养箱10 min,使精子分散上浮。然后用宽径枪头吸取液面精子移入下一个平衡好的HTF液中,放入培养箱1.5~2 h使精子获能。将精子悬液用HTF液稀释,观察受精活力并将浓度调至(1~2.5)×106个/mL。卵母细胞洗净后移入稀释后的精子悬液中,放入培养箱中5~6 h后,显微镜下观察,卵母细胞内看到第二极体和双原核出现则表示已受精。将受精成功的卵母细胞用操作液洗两次后移入培养液中,继续培养16~24后观察卵裂情况;5~7 d后观察囊胚情况。
1.2.3 卵母细胞玻璃化冷冻-解冻
冷冻:将试验所需的溶液及器具于37 ℃温箱中充分平衡。将卵母细胞移入预处理液中平衡5 min后,移入玻璃化冷冻液,在1 min内将卵母细胞移到cryoleaf上,并尽量吸走多余的冷冻液,迅速投入液氮中冷冻保存。解冻:将cryoleaf从液氮中取出后,迅速将其前段浸入解冻液①中1 min,在显微镜中回收卵母细胞后移入解冻液②中3 min,最后移入卵母细胞培养液。洗净后,挑选形态正常的卵母细胞置于卵母细胞培养液放入CO2培养箱(37 ℃,5% CO2,湿度100%)中培养10 min。
1.2.4 电镜样品制备及观察
各组卵母细胞经戊二醛前固定和四氧化锇后固定,用二甲胂酸钠水洗,乙醇梯度脱水,六甲基二硅胺烷干燥和真空干燥,最后采取多次短时的方式进行离子喷镀,在扫描电子显微镜(SEM,VEGA3 TESCAN)下观察采集图像。
1.2.5 ZPT和ZPB检测
各组透明带ZPB和ZPT检测方法如文献[7]所述;ZPTV计算 ZPTV=(透明带最厚值-透明带平均厚度值)/透明带平均厚度值×100
1.2.6 数据分析
ZPT、ZPTV和ZPB结果以(平均值±SEM)表示,SPSS软件根据方差齐性选择检验方法比较各组间的差异,P<0.05为差异有统计学意义。
2 结果
2.1 不同玻璃化冷冻保护液对卵母细胞的影响
卵母细胞分组后,除对照组外,各组分别经过玻璃化冷冻及复苏,发现解冻后的卵母细胞有部分出现胞质轻微固缩、破碎或过度胀大,细胞透明带脱落,体外受精后部分卵母细胞分裂不均匀或没有分裂(如图1)。恢复培养2 h后,体外受精,记录相关数据并进行统计分析,如表2所示,1-4组玻璃化冷冻复苏后存活率和受精率均显著低于对照组(P<0.05)。1组存活率显著高于4组(P<0.05),受精率显著高于2组(P<0.05),其余各组无统计学差异,卵裂率及囊胚率各组无统计学差异,但均低于对照组,且1组均高于其他冷冻液组。因此选用对卵母细胞发育潜力损伤最小的1组(HM+7.5%(DMSO+EG),HM+15%(DMSO+EG)+0.5 mol/L Su)进行后续的试验。
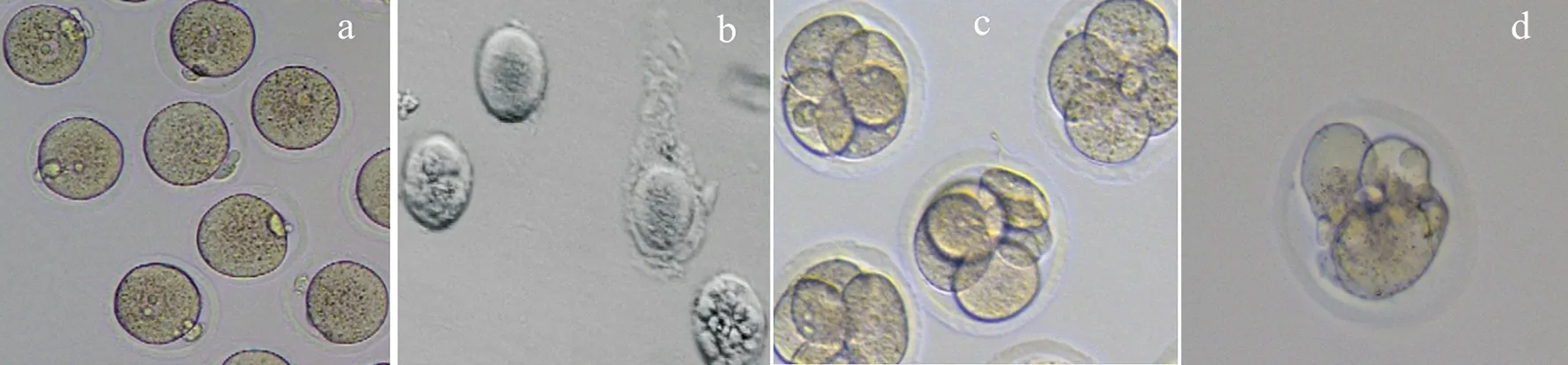
a:正常卵母细胞;b:解冻后透明带脱落;c:均匀卵裂;d:卵裂不均匀
图1 玻璃化冷冻对卵母细胞形态的影响
表2 不同玻璃化冷冻保护液对小鼠卵母细胞发育能力的影响(n=3)
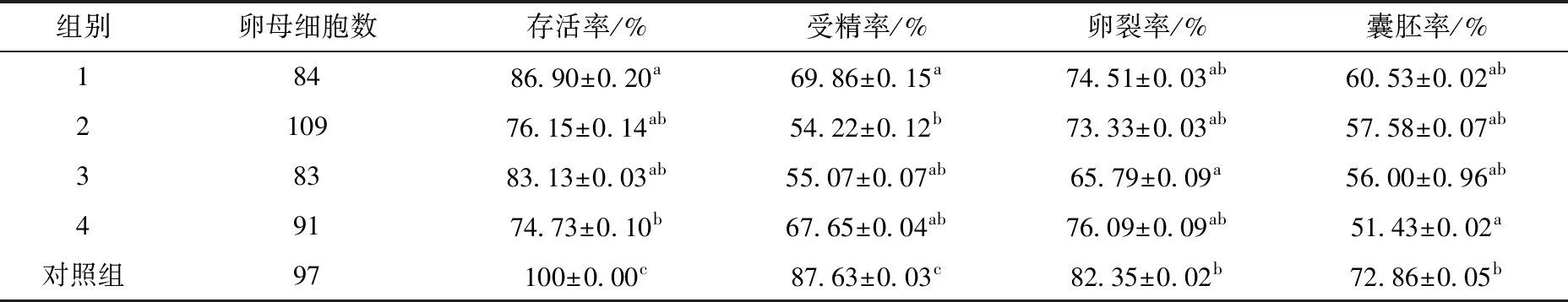
组别卵母细胞数存活率/%受精率/%卵裂率/%囊胚率/%18486.90±0.20a69.86±0.15a74.51±0.03ab60.53±0.02ab210976.15±0.14ab54.22±0.12b73.33±0.03ab57.58±0.07ab38383.13±0.03ab55.07±0.07ab65.79±0.09a56.00±0.96ab49174.73±0.10b67.65±0.04ab76.09±0.09ab51.43±0.02a对照组97100±0.00c87.63±0.03c82.35±0.02b72.86±0.05b
注:同一列中具有不同上标为显著差异,P<0.05。下同
2.2 玻璃化冷冻对透明带厚度、厚度变量和双折射分值的影响
选用2.1中对卵母细胞发育潜力损伤最小的冷冻液,分别检测对照组、冷冻液处理组(过冷冻液,不经冷冻程序)和冷冻组卵母细胞透明带ZPB和ZPT,并计算ZPTV。结果发现,见表3,冷冻组的ZPT值、ZPB值显著大于对照组和冷冻液处理组(P<0.05),冷冻液处理组的ZPT和ZPB与对照组相比差异不显著。三组的ZPTV差异不显著。
表3 玻璃化冷冻对小鼠卵母细胞ZPT、ZPTV和ZPB的影响
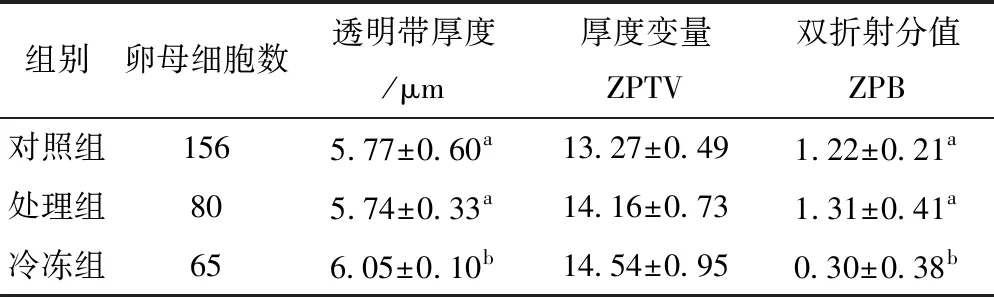
组别卵母细胞数透明带厚度/μm厚度变量ZPTV双折射分值ZPB对照组1565.77±0.60a13.27±0.491.22±0.21a处理组805.74±0.33a14.16±0.731.31±0.41a冷冻组656.05±0.10b14.54±0.950.30±0.38b
通过对上述结果进一步用Pearson法分析,见表4,ZPT与ZPB相关关系显示出ZPT值随ZPB增大而减小r=-0.299(P<0.05),两者呈负相关;ZPTV与ZPB之间无相关关系。
表4 卵母细胞ZPT、ZPTV和ZPB之间的相关性

ZPTZPTVZPBPearson correlation-0.299-0.026Sig.(2-tailed)0.0000.725Data NO.301301
2.3 玻璃化冷冻卵母细胞透明带超微结构的变化
将各组卵母细胞处理后在扫描电镜下观察,发现大部分卵母细胞透明带完整的包裹卵母细胞,表面十分粗糙,呈粗网状或不规则窗孔状(如图2a-b),部分卵母细胞透明带虽然完整,但表面较平滑,网状结构已不清晰,只见小而浅的小孔(如图2c-d);一些卵母细胞出现透明带呈熔融状,表面凹凸不平但不粗糙,网孔结构融化消失(如图2e-f),甚至出现卵母细胞透明带破裂,与卵母细胞分离,脱落(如图2g-h)。
经过统计分析,如表5所示,发现三组中冷冻组的粗ZP率最低(44.8%对92.9%和84.8%)(P<0.05),而光滑ZP率最高(31.0%对7.4%和9.1%)(P<0.05)。同时,冷冻液处理组和冷冻组的ZP熔融率也高于对照组。
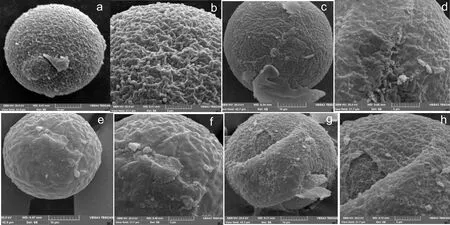
a-b:正常卵母细胞粗糙透明带表面,c-d:卵母细胞透明带表面部分光滑,e-f: 卵母细胞透明带熔融状,g-h:卵母细胞透明带部分脱落
图2 玻璃化冷冻对卵母细胞超微结构的影响
表5 玻璃化冷冻对卵母细胞透明带超微结构的影响

组别卵母细胞数粗ZP/%光滑ZP/%熔融ZP/%破裂ZP/%对照组2792.9 (25/27)a7.4 (2/27)a0 (0/27)a0 (0/27)处理组3384.8 (28/33)a9.1 (3/33)a6.1 (2/33)ab0 (0/33)冷冻组2944.8 (13/29)c31.0 (9/29)c17.2 (5/29)bc6.9 (2/29)
3 讨论
卵母细胞玻璃化冷冻研究虽然取得了显著进展,然而冷冻复苏后卵母细胞的发育潜力仍低于新鲜卵母细胞[9]。有研究发现,乙二醇(EG)的渗透性最好毒性最低,而二甲基亚砜(DMSO)的玻璃化能力较强。目前,综合冷冻保护剂的冷冻保护效果和细胞毒性,EG和DMSO联合使用的冷冻液保护配方较为广泛[10]。有研究发现,使用15%EG、15%DMSO、0.5 M蔗糖和20%胎牛血清对大鼠卵母细胞进行玻璃化冷冻复苏后,可以获得最佳的存活率和卵裂率,但透明带精子穿透率低,皮质颗粒胞吐率高[1]。本研究也发现,HM+7.5%(DMSO+EG),HM+15%(DMSO+EG)+0.5 mol/L Su冷冻液配方对小鼠卵母细胞发育潜力影响较小。其原因可能是在细胞冷冻的平衡过程中,防止细胞内结冰或暴露在高溶质浓度的溶液中造成细胞损伤[11]。尽管如此,卵母细胞损伤仍然存在,这可能与冷冻保护剂浓度高引起的细胞毒素以及冷冻过程中环境温度过低引起的各种卵母细胞结构变化有关[12]。
ZPT是通过透明带评估卵母细胞质量的指标之一,有试验证实,ZPT小的卵母细胞更容易受精[5]。ZPTV是一个反映透明带厚薄均匀程度的指标,值越大说明透明带厚薄越不均匀。ZPTV较大的胚胎妊娠率较高,因此ZPTV也是一个通过透明带评估卵母细胞及胚胎质量和发育潜力的重要指标之一。在本研究中发现,冷冻组ZPT显著高于对照组和处理组,但ZPTV与其他两个组差异不显著。此结果表明,玻璃化冷冻主要使得卵母细胞透明带变厚,进而使得冷冻复苏后卵母细胞受精率降低;同时,玻璃化冷冻不会影响透明带厚薄均匀程度,可见玻璃化冷冻复苏的卵母细胞成功受精后的妊娠率所受影响不大,这也与其他人的研究结果相符[13]。此外,处理组的ZPT和ZPTV均和对照组差异不显著,反映出冷冻保护液不影响透明带的厚度及厚度变量,据此推断玻璃化冷冻后卵母细胞透明带厚度的变化主要是由冷冻低温环境造成的。
ZPB与其大分子结构相关,ZPB的变化意味着透明带的大分子结构出现变化。研究证实,ZPB与体外受精率及囊胚形成有关,且ZPB越大发育潜力越好[14-15]。本研究结果可见冷冻组ZPB显著低于处理组和对照组,处理组和对照组之间差异不显著,由此可知,玻璃化冷冻过程中的低温环境对透明带大分子结构造成了不良影响,使得ZPB降低,表明这种不良影响引起玻璃化冷冻复苏的卵母细胞体外受精率及囊胚形成率降低。Bogliolo等[16]用Raman射线探究玻璃化冷冻对透明带分子结构的变化,证实了玻璃化冷冻复苏后的卵母细胞透明带结构发生了变化。在本研究中,用扫描电镜检测ZP发现,玻璃化冷冻复苏后卵母细胞透明带结构发生部分改变,而新鲜卵母细胞和只经历冷冻程序没有液氮冷冻的卵母细胞间差异不显著,这个研究结果与前人研究结果相一致。
进一步分析ZPT、ZPTV和ZPB的相关性发现ZPT和ZPB之间存在显著负相关,而ZPTV和ZPB之间相关性不显著。可以推断,玻璃化冷冻对卵母细胞透明带的分子结构有显著影响,这种影响可能导致透明带厚度整体变大而不是局部变厚,这些变化均导致透明带与精子的作用受到影响,进而使得卵母细胞玻璃化冷冻复苏后受精率下降。而根据处理组和对照组之间差异不显著的结果,可推断玻璃化冷冻对卵母细胞物理特性的影响不是冷冻保护剂的细胞毒性,可能是低温环境或者其他不良因素造成的。此外,ZPT和ZPB间存在的相关性也侧面证实ZPT作为评估卵母细胞及胚胎质量指标的可靠性,在ZPB测量存在一定困难的条件下,ZPT从一定程度上也能体现ZPB所能指示的结果。
