枸杞酒发酵过程中的褐变
2020-03-22郭晓梦张一晟张惠玲
郭晓梦,张一晟,王 菁,张惠玲*
(1.宁夏大学 农学院 宁夏银川750021;2.宁夏食品微生物应用技术与安全控制重点实验室,宁夏银川750021)
枸杞(Lycium barbarum)富含多种生物活性物质,具有较好的营养价值和药理活性,是我国传统药食两用的名贵中药材[1-2]。枸杞发酵酒是以枸杞为原料,经酵母菌发酵而成的一种保健果酒,营养丰富,深受消费者喜爱[3]。但是枸杞酒容易发生褐变,不仅对色泽和风味造成影响,同时会降低营养价值[4],制约着枸杞酒行业的发展。目前,我国对于枸杞酒的研究多集中于制作工艺及产品开发[5-7],对枸杞酒褐变的研究十分少。作者针对枸杞酒制备中发生褐变因素进行研究,为进一步控制枸杞酒的色泽变化提供理论基础。
1 材料与方法
1.1 材料与设备
鲜枸杞:宁夏百瑞源股份有限公司;酿酒活性干酵母Excellence XR:法国Lamothe-Abiet公司;五羟甲基糠醛、对羟基苯甲酸、原儿茶酸、绿原酸、咖啡酸、阿魏酸、对香豆酸、没食子酸、芦丁、槲皮素、山奈酚、冰乙酸、甲醇:均为HPLC,纯度≥99%,北京中科质检生物技术有限公司;福林试剂、没食子酸、愈创木酚:均为AR,麦克林公司;邻苯二酚、2,6-二氯酚靛酚、3,5-二硝基水杨酸、乙酸乙酯、VC:均为AR,北京奥博星生物技术有限责任公司。
仪器与设备:高效液相色谱仪1100 Series,美国安捷伦科技有限公司;紫外可见分光光度计V-5100,上海精科实业有限公司;旋转蒸发仪RE-52,上海亚荣生化仪器厂;L-8900全自动氨基酸分析仪,日本日立公司。
1.2 实验方法
1.2.1 枸杞酒的制作流程鲜枸杞→清洗→破碎、打浆→添加亚硫酸→加入果胶酶、酶解→调节糖酸→过滤→接种酵母→发酵(18℃)→取上清液→陈酿→过滤→灌装→成品酒。
1.2.2 操作要点枸杞汁预处理:将鲜枸杞清洗、沥干后,以料水质量体积比1∶3打浆,加入亚硫酸,使SO2的质量浓度达到60 mg/L。加入40 mg/L果胶酶,45℃酶解4 h,调节糖度至20°Bx,调pH 3.3~3.5,过滤取汁发酵。
接种发酵:将活化后的酵母菌按0.2 g/L接入枸杞汁中,于18℃恒温培养箱中发酵。每天定时取样,测定相关参数,当糖质量浓度不再下降时停止发酵,取上清液进入陈酿,测定各项指标作为陈酿初酒指标。
陈酿:枸杞酒在16℃恒温条件下陈酿90 d,每15天取样并测定各项指标。由于陈酿中的酶活很小,实验主要针对非酶褐变因子进行测定。
1.2.3 测定方法pH值:pH计测定;酒精体积分数:密度瓶法,参照《GB/T 15308 2006葡萄酒、果酒通用分析方法》[8]进行测定;还原糖:采用3,5-二硝基水杨酸法[9];VC的测定:采用2,6-二氯酚靛酚法,参照GB 5009.86-2016进行测定[10]。PPO和POD活性的测定:PPO和POD的提取和测定参照赵凤[11]等人方法;总黄酮的测定:采用分光光度计法,参照王静[12]的方法。
褐变度的测定:采用消光值法[13]。将枸杞酒待测液在420 nm波长处测定吸光度值,用来表示褐变,吸光值越大,褐变越严重。重复测定3次。
游离氨基酸的测定:氨基酸分析仪(茚三酮柱后衍生离子交换色谱仪)测定。
总酚的测定:采用Folin-Ciocalteu法[14],以没食子酸计,所绘制标准曲线为:y=10.81x+0.091 1,R2=0.998 3。样品总酚测定:将1 mL待测液稀释10倍,取1 mL稀释样液进行测定。
酚类物质质量浓度测定:采用高效液相色谱法。取30 mL枸杞酒,参照李朋亮[15]的方法对样品进行处理后上机测定。10种酚类物质标准品色谱图见图1,采用外标法所得10种酚类物质工作曲线方程见表1。
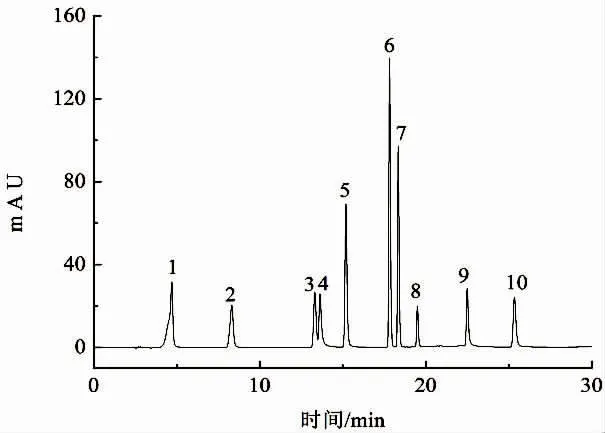
图1 10种单体酚类物质标准品色谱图Fig.1 Chromatogram of 10 phenolic compounds
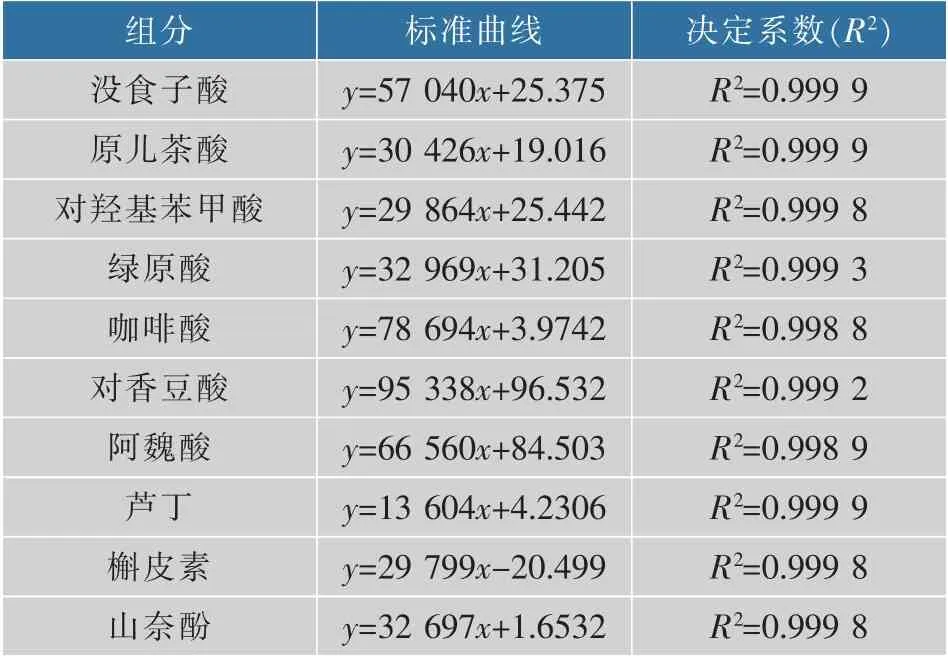
表1 10种单体酚类物质标准品工作曲线的回归方程Table 1 Equation of liner regression of 10 phenolic compounds
5-HMF的测定:采用HPLC方法,称取5-HMF标准品0.010 g,V甲醇∶V水=1∶1,定容至100 mL容量瓶,作为标准品溶液。取待测液20 mL,用20 mL乙酸乙酯萃取3次,收集有机相,35℃下旋转蒸干后用2 mL甲醇-水(体积比1∶1)溶解,0.45μm有机滤膜过滤后进样。
液相色谱条件为:柱温30℃,检测波长284 nm,流动相A为甲醇,B为V乙酸∶V水=1∶99,等梯度洗脱,流量为1.0 mL/min。样品进样前经0.45μm有机滤膜过滤,进样量为20μL,检测时间30 min。
HMF标准品色谱图见图2,所得标准曲线为:y=8 055.8x+36.624,R2=0.999 9。
统计分析方法:使用SPSS17.0对陈酿过程中主要非酶褐变因素与褐变度进行通径分析,分析前对数据进行标准化处理。

图2 5-HMF标准品色谱图Fig.2 Chromatography of 5-HMF standard
1.2.4 建立枸杞酒褐变模拟体系枸杞酒是一个复杂的体系,在分析陈酿中的褐变因素时,多因素交叉,为了证明实验所得褐变因素的正确性,作者拟通过构建模拟体系进行验证。以葡萄糖作为实验中的还原糖,原始物质质量浓度以枸杞酒陈酿中第一次取样为准。以枸杞酒中各游离氨基酸、总糖、还原糖、总酚包括黄酮、10种酚类物质、VC和5-HMF为指标,与褐变度(A420)进行通径分析,研究其非酶褐变主要影响因素。为了便于观察,模拟参数设计是在原酒的数据上扩大了10倍,配制乙醇柠檬酸缓冲液(11.64%乙醇,pH 3.22),将各模拟体系于50℃存放20 d,每5天取样,测定其褐变度的变化,见表2。
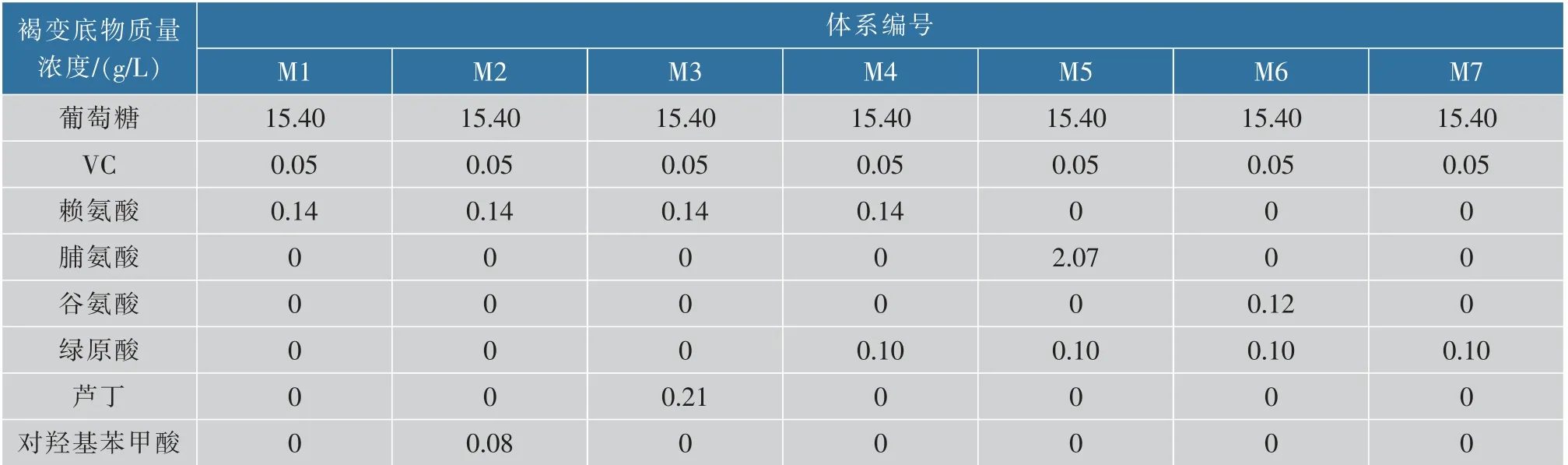
表2 枸杞酒模拟体系的构建Table 2 Construction of medlar wine model system
2 结果与分析
2.1 发酵过程中褐变度影响
2.1.1 酶促褐变因素对褐变度的影响
1)酶与总酚的影响 从图3可以看出,两种酶与总酚在进入最旺盛阶段变化较大,酶促褐变与非酶褐变共同参与,使褐变度一直上升,说明发酵过程中一直伴随着褐变反应。枸杞中含有丰富的酚类物质,酚类中的一元酚邻位羟基物质容易被PPO催化,形成邻二酚并发生脱氢反应,生成具有高度氧化活性的邻醌,邻醌通过自身聚合或与多酚、蛋白质、金属离子等结合发生共呈色作用,生成导致颜色越来越黄的多聚体,并最终形成不溶性的褐色多酚—黑色素,使枸杞酒的黄化发展为褐化。
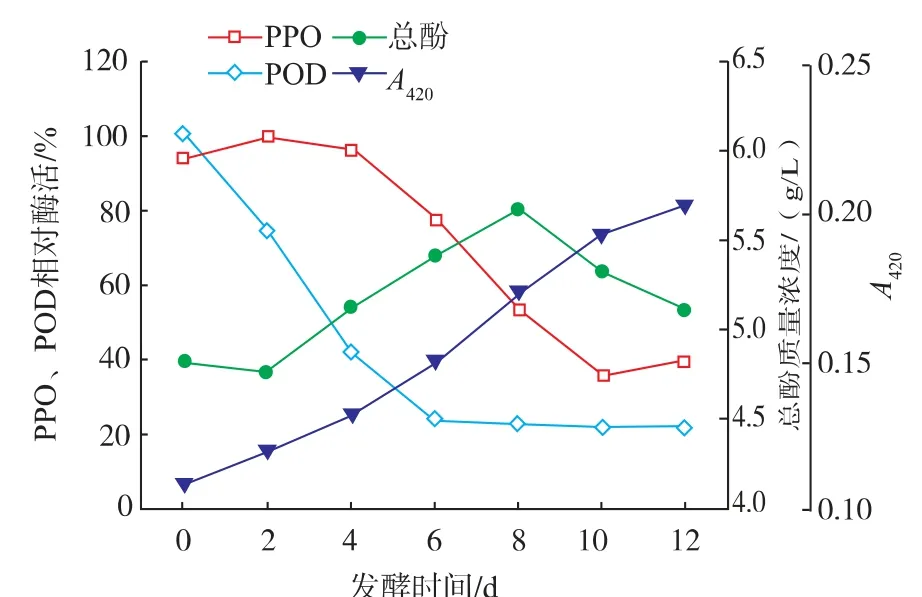
图3 发酵过程中酶、总酚与褐变度的变化Fig.3 Changes of enzymes,total phenolic and browning during wine fermentation
2)主要单体酚对褐变度的影响 芦丁是枸杞中含量最高的类黄酮物质,其次是绿原酸和阿魏酸。从图4—5可知,这些物质下降幅度较大。因为芦丁结构苯环上含有4个羟基,其中包括2个邻羟基,容易被PPO催化,形成醌类物质或与醌类物质缩合引起褐变;芦丁具有较强的金属离子螯合能力,能与Fe2+等金属离子发生螯合反应,生成黄色、蓝绿色和黑色等有色螯合物[16],从而加速枸杞酒的褐变。槲皮素含有5个羟基包括2个邻位羟基,其酶促褐变反应活性与芦丁相似。山奈酚不含邻羟基,发酵过程中可能是发酵液环境变化使细胞释放。
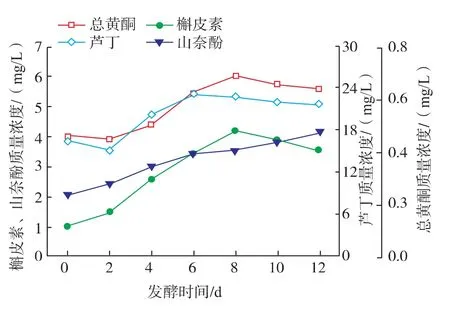
图4 发酵过程中类黄酮主要单体酚变化Fig.4 Changes of major phenolic compounds in flavonoid during wine fermentation

图5 发酵过程中非类黄酮主要单体酚变化Fig.5 Changes of major phenolic compounds in nonflavonoid during wine fermentation
2.1.2 非酶促褐变因素对褐变度的影响枸杞中的非酶褐变主要来自VC氧化、还原糖和氨基酸的美拉德反应。由图6可知,枸杞发酵液中VC从开始就迅速氧化降解,随着发酵后期溶解氧被酵母菌大量消耗,以及多酚类物质和VC竞争式的氧化还原平衡,能一定程度保护VC,使VC下降速度变得缓慢。VC分子中含有连烯二醇基[-C(OH)=(OH)-]和内酯环结构,极易氧化分解形成脱氢抗坏血酸,经脱水形成DKG(2,3一二酮古洛糖酸)后,脱羧产生酮木糖,最终生成还原酮,进一步脱水与氨基化合物缩合或自身裂解,最终形成类黑精[17],使枸杞酒褐变度上升。
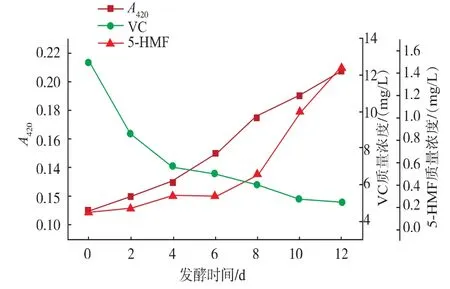
图6 发酵过程中VC、5-HMF与褐变度的变化Fig.6 Changes of VC,5-HMF and browning degree during wine fermentation
5-HMF是还原糖和氨基酸进行美拉德反应的中间产物,它的生成量能一定程度指示美拉德反应的进行。还原糖和氨基酸经1,2-烯醇化反应,脱水形成3-脱氧奥苏糖,继续脱水生成5-HMF,最终产物主要为类黑素[18]。从图6可以看出褐变曲线一直上升。
2.2 陈酿过程中褐变度的影响
2.2.1 总酚与褐变度的变化由图7可知,随着陈酿时间的延长,褐变不断产生。陈酿中除了多酚氧化聚合、VC氧化降解和美拉德反应的持续外,多酚氧化中间物质醌类还可以与酚等物质通过亲核、偶联或自由基途径发生非酶聚合,反应过程中产生的二聚体或多聚体可能发生了结构重排,产生褐色的多聚体[19]也使得总酚物质下降。

图7 陈酿过程中褐变度和总酚的变化Fig.7 Changes of browning degree and total phenolic during wine aging
2.2.2 主要单体酚的变化在陈酿中,枸杞酒中主要的单体酚芦丁、绿原酸、对羟基苯甲酸、咖啡酸和没食子酸质量浓度均有下降,其原因与发酵过程相同,见图8—9。

图8 陈酿过程中类黄酮中主要单体酚变化Fig.8 Changes of major phenolic compounds in compounds flavonoids during wine aging
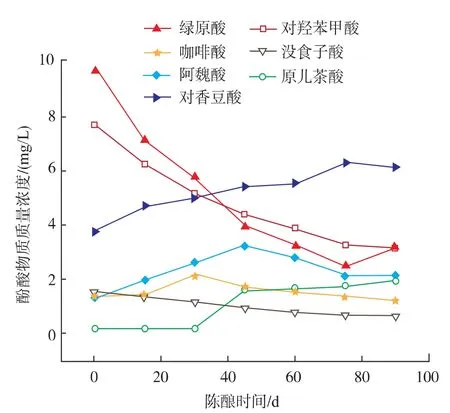
图9 陈酿过程中非类黄酮主要单体酚变化Fig.9 Changes of major phenolic in non-flavonoid during wine aging
2.2.3 游离氨基酸的变化由表3可知,除了Asp和Gly质量浓度增加了,其他氨基酸都有所下降,脯氨酸下降最大,有研究表明[20],脯氨酸最具类黑精形成活性,是褐变反应活性最高的氨基酸。钱敏[23]等人发现,谷氨酸参与的美拉德反应产物中5-HMF质量浓度较高。
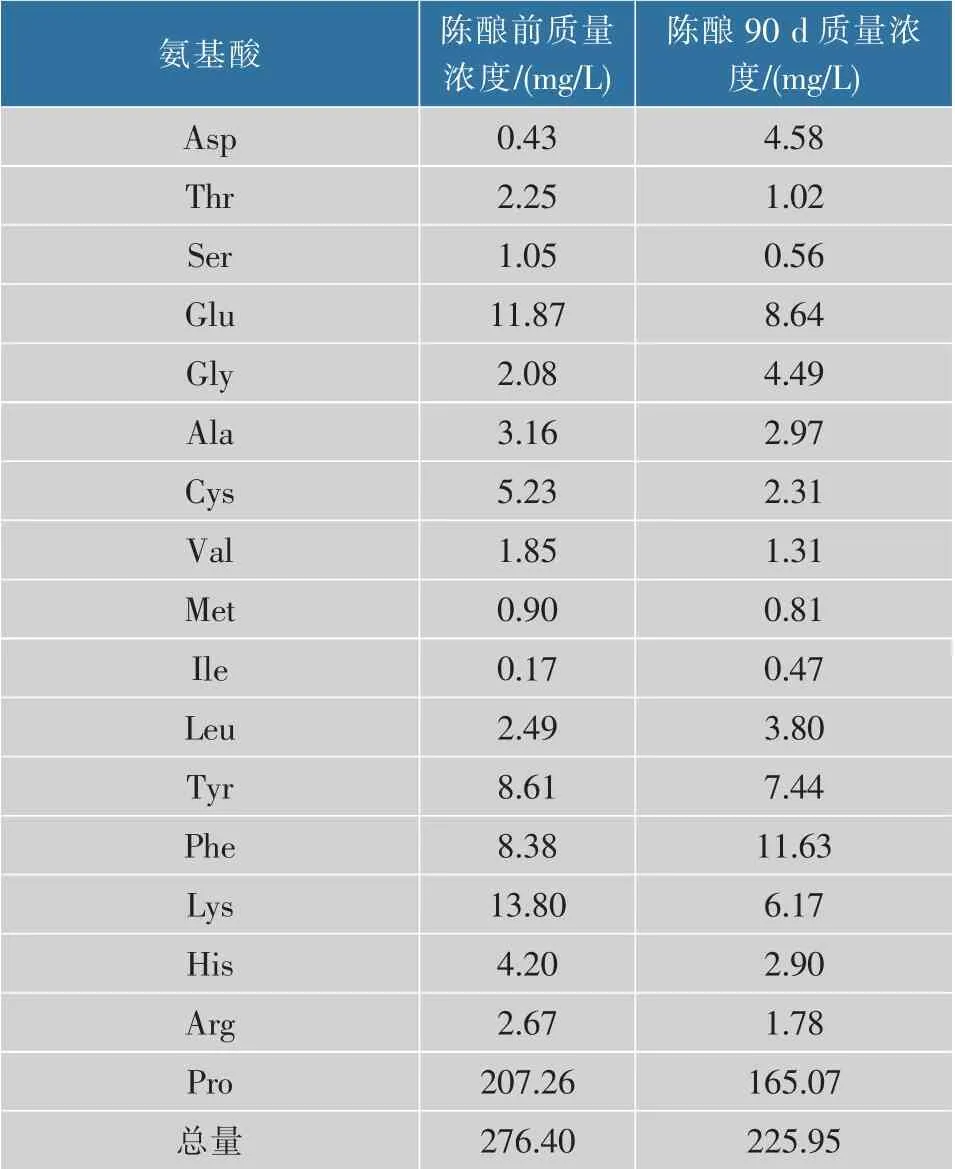
表3 陈酿90 d后氨基酸的变化Table 3 Changes in amino acids after 90 days of aging
2.2.4 总糖、还原糖、5-HMF和VC的变化通过5-HMF与VC的变化可知,陈酿中的美拉德反应一直在进行,VC一直在持续,褐变一直在继续。由图10—11可知,枸杞酒陈酿过程中总糖呈不断下降趋势,还原糖先上升后波动下降。总糖发生酸水解使酒中多糖等非发酵性残糖转化为葡萄糖、果糖、阿拉伯糖、半乳糖等,使还原糖质量浓度有所升高,该还原糖参与美拉德反应被不断消耗,使还原糖、总糖曲线有所下降。
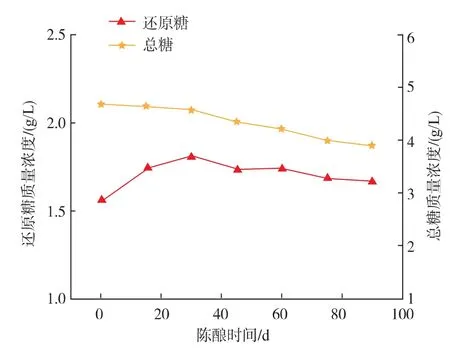
图10 陈酿过程中总糖、还原糖的变化Fig.10 Changes of total sugars and reducing sugars during wine aging

图11 陈酿过程中VC和5-HMF的变化Fig.11 Changes of VC and 5-HMF during wine aging
2.3 通径分析结果
通径分析是建立在通径系数概念基础上的一种多元统计分析方法[21]。以总酚(X1)、总糖(X2)、5-HMF(X3)、VC(X4)为自变量,以褐变度A420为Y值,进行通径分析。对褐变度进行S-W测试,统计量为0.934,p=0.583>0.05,接近正态分布。采用逐步回归分析法,筛选出对褐变度影响显著的因素,得到最优回归方程:Y=5.809-0.853X1-0.667X2,由显著性检验可知:X1、X2显著性均小于0.05,且模型达极显著水平(F=266.498,p=0.000),相关系数R=0.996,说明方程拟合度达到99.6%,R2=0.993,剩余因子值很小,对褐变度有影响的自变量考虑较为全面。
由表4可知,总酚(X1)、总糖(X2)和VC(X4)与褐变度呈显著负相关,5-HMF(X3)与褐变度呈显著正相关。

表4 相关及显著性检验结果Table 4 Correlation and significance test results
由表5可知,总酚对枸杞酒褐变度的直接通径系数为P1=-0.682,对R2的总贡献为0.669,总糖对枸杞酒褐变度的直接通径系数P2=-0.345,对R2的总贡献为0.323,说明总酚、总糖对褐变度具有直接的负效应。可以看出,总酚对褐变度起直接作用,总糖对褐变度起间接作用。有研究表明,酸性环境中,糖类容易转变成羟甲基糠醛类中介物,然后与酚类物质反应生成有色物质,引起枸杞酒的褐变[22]。
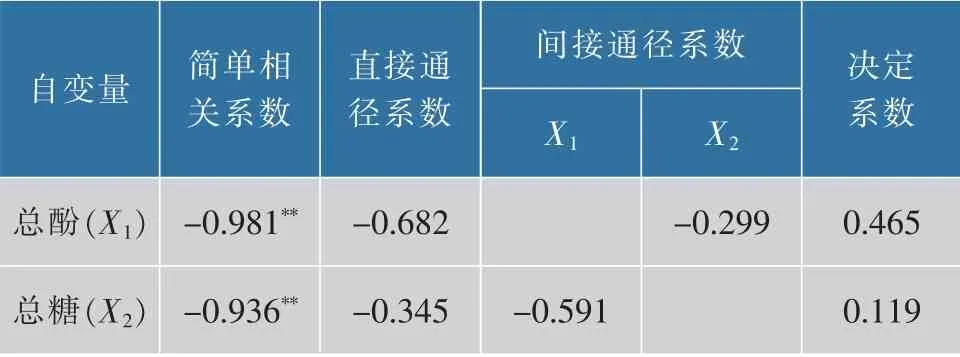
表5 各褐变因素与褐变度通径分析表Table 5 Path analysis of browning factors and browning degree
2.4 模拟实验结果
2.4.1 不同酚类物质对褐变度的影响由图12可知,M3(芦丁)和M4(绿原酸)的褐变度明显高于M1(不含酚),20 d后褐变度分别为M1的1.67和1.28倍,M2(对羟基苯甲酸)的褐变度较M1无明显变化。芦丁和绿原酸是引起陈酿中非酶促褐变的主要物质。另外,有研究表明,多酚和赖氨酸、葡萄糖的交互作用能够促进褐变[23],枸杞酒中有可能也发生了类似的反应。对羟基苯甲酸对枸杞酒陈酿中的褐变几乎无影响,其作为羟基苯甲酸衍生物,在陈酿过程中质量浓度的降低可能是与酒精结合所致[24]。

图12 不同酚类物质模拟体系褐变度的变化Fig.12 Changes of browning degree of different phenolic compounds model system
2.4.2 不同氨基酸对褐变度的影响由图13可知,M4(赖氨酸)和M5(脯氨酸)的褐变度高于M7(不含氨基酸),而M6(谷氨酸)褐变度在前5天达到最高后基本不变,明显低于M7,绿原酸、VC和葡萄糖的综合作用能明显促进褐变。脯氨酸是枸杞酒中质量浓度最高的氨基酸,对褐变具有明显促进作用,赖氨酸对枸杞酒褐变影响次之。谷氨酸在枸杞酒模拟体系中,对褐变度具有较明显抑制作用,其抑制机理有待研究。

图13 不同氨基酸模拟体系褐变度的变化Fig.13 Changes of browning degree of different amino acids model systems
3 结语
在发酵过程中,酶促褐变和非酶促褐变同时存在,酶促褐变主要由PPO和POD催化枸杞发酵液中的酚类物质引起。主要酚类物质是芦丁、绿原酸、羟基苯甲酸、阿魏酸、香豆酸,这些物质在酶的催化下形成具有高度氧化活性的邻醌,并最终形成不溶性的褐色多酚-黑色素,使枸杞酒的黄化发展为褐化。陈酿过程中,以非酶褐变为主,主要来自多酚的氧化缩合和美拉德反应。总酚、总糖、脯氨酸、赖氨酸和谷氨酸是引起褐变的主要原因。
