2Hz电针对SNI诱导神经病理性疼痛大鼠脊髓IRF8和mTOR的作用
2020-03-20孙亚兰
薛 梦,孙亚兰,黄 诚
(赣南医学院 1.2017级硕士研究生;2.2018级硕士研究生;3.基础医学院;4.疼痛医学研究所,江西 赣州 341000)
疼痛是一种严重影响患者生活质量的病理生理性疾患,主要有急性痛和慢性痛[1]。神经病理性疼痛(Neuropathic pain, NP)是慢性疼痛的一种,它是由中枢以及外周神经系统的损伤和功能障碍所引起的一种复杂性疾病[2]。缘由神经病理性疼痛的病理生理学机制较为复杂且目前的治疗效果不佳,因此,对其发病机制以及临床治疗的研究就显得尤为迫切和重要。
针灸是祖国的传统医学,由针灸发展而来的电针(Electroacupuncture, EA),因其不良反应较小,在临床上有较广泛的应用,比如,电针对慢性疼痛的治疗作用已经得到了全球的认可[3-4],但其作用机制还有待于进一步阐明。特别值得一提的是,2019年世界卫生组织(WHO)与世界针灸学会联合会(WFAS)建立了正式工作关系[5-7],这预示着电针在医学领域的应用研究将愈来愈受到关注。我们课题组前期研究发现,干扰素调节因子8(transcription factors interferon regulatory factor 8, IRF8)在背根神经节(Dorsal root ganglion, DRG)上参与了2Hz电针对选择性神经损伤模型(Spared nerve injury, SNI)大鼠的镇痛作用[8]。另有实验表明,IRF8通过影响脊髓小胶质细胞的转录基因,激活小胶质细胞[9],形成中枢敏化,进而导致慢性疼痛的发生发展,但是关于IRF8是如何通过小胶质细胞来影响中枢敏化的具体机制还不甚清楚[10-11]。在神经病理性疼痛的状态下,激活的小胶质细胞可释放脑源性神经营养因子(brain-derived neurotrophic factor, BDNF),BDNF/TrkB信号通路是形成中枢敏化的重要通路之一,并且已被大量实验证明其可通过N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor, NMDAR)参与中枢敏化[12-13]。另有研究发现哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)在神经元可塑性中发挥重要作用[14],mTOR可通过调控NMDAR参与神经病理性疼痛的中枢敏化[15]。基于此,我们提出假设:电针对IRF8与mTOR参与中枢敏化的调控作用是否与BDNF信号通路有一定的联系。为此,本实验拟在SNI诱导的神经病理性疼痛大鼠模型上,探讨鞘内给予外源性BDNF后,其对2Hz电针作用于神经病理性疼痛大鼠脊髓IRF8和mTOR的表达影响,以期为电针进一步应用于临床治疗神经病理性疼痛提供理论依据。
1 资料和方法
1.1实验动物与分组SPF级雄性SD大鼠24只,体重180~220 g,由湖南斯莱克景达实验动物有限公司提供[动物中心许可证号:SCXK(湘)2016-0002],所有实验动物严格遵守赣南医学院动物伦理委员会的要求。实验动物随机分为6组(n=4):Sham组,SNI组,SNI+Mock EA组,SNI+EA组,SNI+EA+BDNF组和SNI+EA+PBS组。在SNI术后1天,分别对SNI+EA组,SNI+EA+BDNF组和SNI+EA+PBS组大鼠双侧的足三里和三阴交穴位进行隔日电针治疗14天,SNI+Mock EA组仅扎针不给予电刺激。Sham组暴露坐骨神经不进行结扎剪断。所有大鼠在电针后的第14天取材。
1.2实验试剂与仪器华佗牌一次性针灸针(0.28 mm×15 mm,苏州医疗用品有限公司),韩氏多功能电针仪(北京华运安特科技有限公司)。反转录试剂盒购自 invitrogen 公司(货号: C28025),SYBR®Select Master Mix: Life technologies(货号:4368813),IRF8和 mTOR 的特异性引物由生工生物工程(上海)股份有限公司合成。
1.3鞘内置管及给药方法麻醉后的大鼠俯卧位固定于动物手术台,沿背部正中切开皮肤,在L4/L5椎间隙处进行穿刺,见大鼠尾巴甩动进行置管,PE-10导管置入约3.5 cm,将PE-10导管外端自皮下由头颈部穿出,多点进行固定。术毕动物放回铺有垫料的大鼠饲养笼,单笼饲养。观察4~5天后,剔除置管不成功(瘫痪或跛行),然后进行神经病理性疼痛大鼠模型手术。在电针治疗SNI大鼠后的第12天,连续鞘内给予外源性的BDNF两天,一天两次,每次100 ng,每次间隔30 min。
1.4神经病理性疼痛大鼠模型制备参照文献[16]介绍的方法建立SNI模型,大鼠用2%~3%浓度的异氟烷进行麻醉。分离左侧胫神经和腓总神经,保留腓肠神经,用4号线分别结扎并剪断胫神经和腓总神经,建立SNI大鼠模型,Sham组仅暴露胫神经和腓总神经,不进行结扎剪断,其他手术操作同前,麻醉苏醒后将大鼠放回原笼。
1.5qPCR检测电针后第14天,取L4~L6段脊髓组织置于1.5 mL的无酶的EP管,加入10倍体积的Trizol,用匀浆器充分将脊髓组织裂解,再加入1/5的氯仿,上下颠倒混匀15~30 s,室温静置5 min,4°,12 000×g,离心15 min。然后取上层水相,加入等体积异丙醇,混匀,室温静置10 min,4°,12 000×g,离心10 min。加入75%的乙醇(用去RNA酶水配制)用于洗涤沉淀,洗涤后 4°,7 500×g,离心10 min,弃乙醇,进行干燥。加20 μL的RNase Free 的水溶解,定量。逆转录成cDNA后,行实时定量PCR实验。qPCR反应体系: cDNA 2 μL,1×SYBR 10 μL,加超纯水至20 μL。反应条件:95℃预变性20 min,PCR反应,95 ℃变性10 s,61 ℃退火20 s,72 ℃延伸25 s,共40个循环。各引物序列由上海生工生物公司合成,其引物序列如下(表1)。
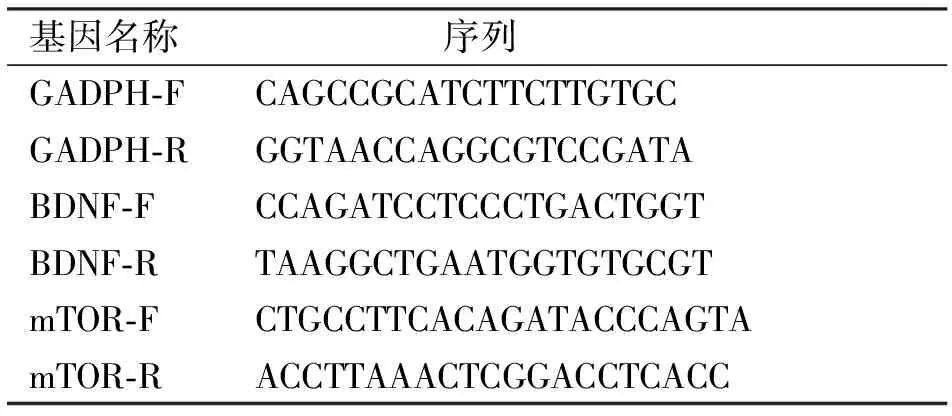
表1 PCR引物序列
2 结 果
2.12Hz电针对SNI模型大鼠脊髓IRF8和mTOR的mRNA表达的影响为观察SNI模型大鼠脊髓IRF8和mTOR在2Hz电针的作用,我们在第14天取材后,应用qRT-PCR检测大鼠脊髓IRF8和mTOR的mRNA表达水平。结果显示,与Sham组相比,SNI大鼠脊髓IRF8 的mRNA表达明显增高(P<0.05);与SNI组相比,SNI+EA组大鼠脊髓IRF8的 mRNA表达明显下降(P<0.05);与SNI组相比,SNI+Mock EA组大鼠脊髓IRF8的mRNA表达变化不明显,差异无统计学意义(见图1A)。同样,SNI大鼠脊髓mTOR的 mRNA表达显著高于Sham组(P<0.01);SNI+EA组大鼠脊髓mTOR 的mRNA表达明显低于SNI组(P<0.05);与SNI+EA组相比,SNI+Mock EA组大鼠脊髓中的mTOR mRNA表达变化不明显,差异无统计学意义(见图1B)。
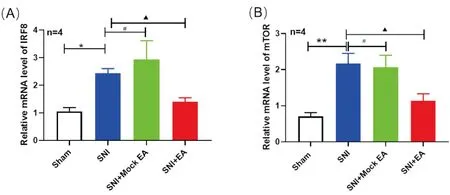
图1 2Hz EA对SNI模型大鼠脊髓IRF8和mTOR的 mRNA的影响
2.2鞘内注射外源性BDNF对2Hz电针作用于大鼠脊髓IRF8和mTOR的mRNA表达影响为进一步探讨BDNF对2Hz电针作用于大鼠脊髓IRF8和mTOR 的表达影响,我们在SNI大鼠经电针治疗后的第12、13天分别鞘内注射PBS和BDNF,每天2次,每次间隔半小时,注射剂量100 ng。我们的实验结果显示,与PBS组相比,BDNF组大鼠脊髓中IRF8 mRNA的表达显著升高(P<0.05)(见图2A)。同样的,BDNF组大鼠脊髓中mTOR mRNA的表达也明显高于PBS组(P<0.05)(见图2B)。

图2. 鞘内注射BDNF对脊髓IRF8和mTOR的mRNA的影响
3 讨 论
神经病理性疼痛因其中枢和外周神经系统的损伤病变而产生的机制比较复杂,导致其治疗难度大,至今仍未有较好的治疗方式。针灸在中国有着悠久且辉煌的临床应用历史,由针灸发展而来的电针,因其可以通过刺激频率、强度和持续时间等参数进行标准化而更有利于开展科学研究[5]。由于电针具有良好的镇痛效果,在临床上也得到了广泛运用,但目前有关电针治疗神经病理性疼痛的机制仍然不是很清楚。我们在脊髓水平的实验结果发现,2Hz电针能够显著降低神经病理性疼痛大鼠脊髓IRF8和mTOR的基因表达,而BDNF可翻转2Hz电针的这种作用,这提示BDNF参与了2Hz电针对SNI大鼠脊髓IRF8和mTOR的调控作用。
有研究报道IRF8也称为干扰素同源序列结合蛋白,是干扰素(IFNs)在多种细胞类型中诱导的IRF转录因子家族的成员之一[17]。课题组前期结果显示,IRF8在SNI大鼠模型的DRG有表达,并参与机械痛敏的形成[8]。有证据表明,IRF8在免疫细胞(如淋巴细胞和树突状细胞)以及外周神经损伤(peripheral nerves injuries, PNI)后的免疫系统和脊髓均有表达[9],而且IRF8在脊髓水平可通过激活小胶质细胞参与神经病理性疼痛的发生发展[18]。在PNI模型中,IRF8激活脊髓小胶质细胞后以p38依赖性方式释放炎性细胞因子,进而形成中枢敏化[11]。进一步的实验发现,脊髓IRF8参与神经病理性疼痛与小胶质细胞P2X4受体的驱动有着密切的关系[19-20]。这些研究都证实了IRF8可调控小胶质细胞的激活和转录[9,21],而活化的小胶质细胞参与诱导中枢敏化并维持与小胶质细胞相关的持续性疼痛[22-23]。BDNF已被证明在脊髓水平可诱发中枢敏化,是引发神经病理性疼痛的重要信号通路之一[12-13]。而且脊髓小胶质细胞激活后可释放BDNF,进一步加强伤害性敏化[24]。Fang等[25]发现,在SNI模型中,脊髓IRF8可以通过下调BDNF来缓解神经病理性疼痛。表观遗传学实验进一步证实,小胶质细胞中的IRF8和P2X4受体上调[26],而且BDNF在小胶质细胞的表达也上调,认为这是导致中枢敏化和痛敏行为的一个关键因素。以上结果提示,IRF8在脊髓水平通过小胶质细胞诱发中枢敏化,进而导致神经病理性疼痛,但引起中枢敏化的原因很可能与BDNF有关。
mTOR是细胞生长和增殖的重要调节因子。有研究发现,在糖尿病诱导的神经病理性疼痛模型中,mTOR在DRG的表达明显上调,阻断mTOR后可显著提高模型大鼠的机械退缩阈值,进而缓解疼痛[27]。在坐骨神经慢性压迫(Chronic constriction injury,CCI)模型中,脊髓的mTOR蛋白表达明显升高,并诱发神经病理性疼痛[28]。最近的证据表明,mTOR在脊髓参与突触可塑性的变化,是调节伤害性敏化发展必不可少的因素[14,29]。在脊髓背角中,mTOR通路的激活参与了NMDAR触发的中枢敏化[15]。在糖尿病所诱导的神经病理性疼痛状态下,脊髓mTOR的激活介导了突触蛋白Ⅱ和神经突增生的上调[30],两者均可导致痛觉过敏,这进一步说明mTOR在神经元可塑性中所发挥的作用,而且这可能与谷氨酸的过量释放以及GABA能神经元突触传递有关。有实验表明,脊髓的BDNF-mTOR信号通路参与痛觉过敏[31]。在前扣带回皮层,BDNF激活mTOR后上调NR2B可诱导炎性痛和厌恶情绪的产生[32]。以上研究证实,BDNF可通过激活mTOR参与脊髓可塑性并诱导中枢敏化,进而产生神经病理性疼痛。
神经病理性疼痛是一个世界性难题,因其复杂的病理机制及治疗难度一直困扰着众多患者。脊髓中枢敏化是神经病理性疼痛发病机制中的一个重要环节,BDNF信号所诱导GluN2B-NMDA受体触发的中枢敏化已得到了认可[12,33],有关其上下游分子的作用仍有待于进一步研究。有文献报道,BDNF信号的上游分子IRF8和下游分子mTOR与中枢敏化有着重要的联系,并且电针通过下调mTOR进而抑制由脊髓损伤所引起的神经病理性疼痛[34]。重要的是我们课题组前期的研究表明,电针可通过下调DRG的IRF8表达来缓解神经病理性疼痛[8]。本实验探讨了脊髓的IRF8和mTOR在2Hz电针对SNI诱导神经病理性疼痛的作用,我们发现SNI可明显提高大鼠脊髓IRF8和mTOR的mRNA表达,而2Hz电针可显著下调大鼠脊髓IRF8和mTOR的mRNA水平。为进一步探索BDNF与中枢敏化的关系,在2Hz电针治疗SNI诱导的神经病理性疼痛大鼠后,外源性给予BDNF,发现BDNF可明显翻转2Hz电针对SNI大鼠IRF8和mTOR的mRNA表达。我们的实验提示,在SNI诱发的神经病理性疼痛大鼠模型中,2Hz电针有可能通过下调SNI大鼠脊髓IRF8和mTOR的表达来抑制BDNF所诱导的中枢敏化。
综上所述,2Hz电针镇痛的脊髓机制有可能是通过下调IRF8和mTOR来抑制中枢敏化,并且BDNF参与这一过程,这将为电针治疗神经病理性疼痛提供一个新思路,即2Hz电针通过阻断IRF8和mTOR的表达发挥对神经病理性疼痛的缓解作用。但本实验并未进一步应用IRF8、BDNF和mTOR的抑制剂去反向探讨电针的作用机制,这有待于今后的研究加以阐明。
