大鼠脑缺血再灌注早期过氧化物酶体增殖物激活受体γ活化与细胞焦亡的关系
2020-03-20刘海颖冯子人孙辉孟爱国赵俊暕张文婷
刘海颖,冯子人,孙辉,孟爱国,赵俊暕,张文婷
缺血性脑卒中是由于脑动脉阻塞造成脑部血液循环不畅进而导致神经损伤的一种缺血性脑血管疾病,是引起当今世界成年人死亡的主要原因[1]。目前临床常见的治疗方法有药物溶栓或手术开通被堵的动脉,实现缺血脑组织的血液再灌注。然而再灌注后往往造成脑组织进一步损伤,即脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)。近来研究发现,细胞焦亡(pyroptopsis)可能参与了脑缺血再灌注损伤的病理过程[2]。过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor gamma,PPARγ)是一种核转录因子,被配体激活后在细胞的存活、转化和死亡方面具有重要作用。研究发现在大鼠CIRI模型中,过表达PPARγ后炎症反应明显降低,神经细胞损伤减少[3]。基于PPARγ在抗炎方面的显著作用,其是否参与了细胞焦亡的发生,与细胞焦亡有无内在联系,目前国内外文献很少报道。本研究建立大鼠CIRI模型,通过观察PPARγ激活后细胞焦亡和神经损伤的变化,明确PPARγ活化与细胞焦亡的关系及神经保护作用。
1 材料与方法
1.1 实验动物与分组 SPF级雄性SD大鼠40只,体质量250~280 g,购自北京华阜康生物科技有限公司,合格证编号[SCXK(京)2014−0004,本实验经华北理工大学实验动物伦理委员会批准,编号:LX201901],在标准条件下(温度23℃±1℃,空气湿度60%~65%)维持12 h白昼/12 h黑夜循环。动物适应性饲养1周后开始进行实验分组,编号后随机分为假手术组(sham组)、模型组(MCAO组)、吡格列酮组(PGZ组)、吡格列酮+GW9662组(PGZ+GW9662组),每组10只。模型组采用改良线栓(MCAO)的方法建立大鼠半脑局部缺血模型[4]。术后2 h拔出线栓开始计时,再灌注24 h后对脑缺血的大鼠进行Zea−Longa神经功能评分[5]并处死大鼠。PGZ(一种PPARγ配体激活剂)组在建模前7 d以15 mg/kg腹腔注射PGZ,每天1次。PGZ+GW9662组在建模前7 d同PGZ组注射PGZ,并于建模前1 h以1 mg/kg剂量进行腹腔注射GW9662(PPARγ特异性阻断剂),共注射1次。
1.2 试剂和仪器 PGZ购自TCI(上海)化成工业发展有限公司(纯度>98%);GW9662购自美国Cayman Chemical公司;TTC溶液购自北京雷根生物技术有限公司;PPARγ一抗购自美国Affinity公司;半胱氨酸的天冬氨酸特异性蛋白水解酶−1(caspase−1)、Gasdermin D(GSDMD)、白细胞介素−1β(IL−1β)、IL−18、β−actin一抗购自美国Cell Signaling公司。
1.3 实验方法
1.3.1 动物模型制备 采用1%戊巴比妥钠(35 mg/kg,腹腔注射)对实验动物进行麻醉后取仰卧位,剃毛器暴露颈部,碘伏消毒,于颈部正中切口后逐层分离组织和筋膜,分离颈总动脉(CCA)、颈内动脉(ICA)以及颈外动脉(ECA),小心分离迷走神经,于CCA近心端挂线结扎,然后于ECA靠近分叉处进行挂线结扎,同时用动脉夹将ICA暂时夹闭,使用眼科剪在CCA结扎处远心端约1 cm处剪一小口,插入线栓后松开动脉夹,使线栓经由分叉处进入ICA,直至线栓标记的黑点处到达分叉处有阻力时停止,插入线栓头端距离分叉处约18.5~19.5 mm,固定线栓并开始计时,2 h后拔出线栓实施再灌注。
1.3.2 Zea−Longa神经功能评分 对再灌注24 h的大鼠进行Zea−Longa神经功能评分,相关评分标准:无神经损伤症状(0分),不能完全伸展对侧前爪(1分),不能直行,向一侧绕圈(2分),向对侧倾倒(3分),不能自发行走,意识丧失(4分)。
1.3.3 TTC染色 再灌注24 h后取大鼠的脑组织,立即在−20℃下储存30 min。冷冻的大脑被切成5个冠状部分,每个厚度为1 mm。将脑片置于TTC溶液中,37℃放置15 min,翻面继续于TTC染液中浸染15 min,避光。使用Image J软件进行分析以计算大鼠的脑梗死面积,用梗死面积的百分比(%)表示。缺血区面积比=脑切片白色缺血区域面积/脑切片总面积×100%。
1.3.4 Western blot检测缺血区域大脑皮质焦亡相关蛋白的表达 将脑组织与一定量的蛋白裂解液和PMSF混合并置于冰上彻底研磨。提取上清液,根据BCA试剂盒说明书测定蛋白质浓度。依据蛋白分子质量配相应浓度的SDS−PAGE胶,先以90 V电压电泳,当观察到待测样本被浓缩至一条细线并进入分离胶时,将电压调至120 V,并且根据靶蛋白的分子质量观察电泳时间。在220 mA稳定电流下转膜1.5 h。5%BSA室温摇床上缓慢封闭2 h后,立即加入PPARγ(1∶1 000),caspase−1(1∶1 000),GSDMD(1∶500),IL−1β(1∶1 000),IL−18(1∶1 000),β−actin(1∶2 000)一抗并于4℃冰箱过夜,次日TBST洗涤3次。依据一抗的来源,采用HRP标记的抗兔/小鼠二抗(1∶5 000)在室温下孵育60 min。采用超敏ECL显影液进行显影,运用Image J软件对图像进行灰度值测定进而获得蛋白的相对表达量(目的蛋白灰度值/内参蛋白灰度值)。
1.4 统计学方法 SPSS 17.0软件进行统计学分析,结果数据符合正态分布,采用均数±标准差(±s)的方式表示,多个样本均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠脑缺血再灌注24 h神经功能评分和TTC染色结果 MCAO组,PGZ组,PGZ+GW9662组较sham组的神经功能评分升高,脑缺血再灌注24 h后大鼠脑梗死面积(白色部分)增大(P<0.05),给予PGZ干预后,其神经功能评分以及脑梗死面积较MCAO组减小(P<0.05);与PGZ组相比,加入PGZ+GW9662后神经功能评分以及脑梗死面积增大(P<0.05),见表1、图1。
2.2 各组大鼠脑缺血再灌注24 h细胞焦亡相关蛋白表达变化 Western blot结果显示,与sham组比较,MCAO组与PGZ+GW9662组中焦亡蛋白caspase−1、GSDMD和炎症因子IL−1β、IL−18的表达水平升高,差异有统计学意义(P<0.05);与MCAO组比较,PGZ组焦亡蛋白caspase−1、GSDMD和炎症因子IL−1β、IL−18的表达水平降低(P<0.05);与PGZ组比较,PGZ+GW9662组焦亡蛋白caspase−1、GSDMD和炎症因子IL−1β、IL−18的表达水平升高(P<0.05),见表2、图2。
Tab.1 Comparison of neurological function score and cerebral infarction area after 24-hour cerebral ischemiareperfusion between different groups of rats表1 不同组大鼠脑缺血再灌注24 h后神经功能评分及脑梗死面积比较 (n=5,±s)
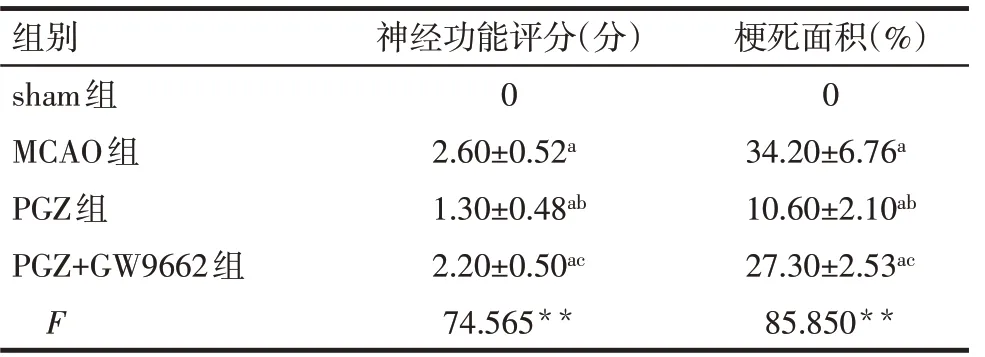
Tab.1 Comparison of neurological function score and cerebral infarction area after 24-hour cerebral ischemiareperfusion between different groups of rats表1 不同组大鼠脑缺血再灌注24 h后神经功能评分及脑梗死面积比较 (n=5,±s)
**P<0.01;a与sham组比较,b与MCAO组比较,c与PGZ组比较,P<0.05
组别 神经功能评分(分) 梗死面积(%)

Fig.1 TTC staining of the infarct sizes图1 TTC染色示脑梗死面积
Tab.2 Changes of expressions of PPARγ,pyrogen and inflammatory factors 24 hours after cerebral ischemiareperfusion in different groups of rats表2 不同组大鼠脑缺血再灌注24 h后PPARγ、细胞焦亡蛋白以及炎症因子的表达变化(n=5,±s)

Tab.2 Changes of expressions of PPARγ,pyrogen and inflammatory factors 24 hours after cerebral ischemiareperfusion in different groups of rats表2 不同组大鼠脑缺血再灌注24 h后PPARγ、细胞焦亡蛋白以及炎症因子的表达变化(n=5,±s)
**P<0.01;a与sham组比较,b与MCAO组比较,c与PGZ组比较,P<0.05
组别PPARγcaspase−1 GSDMD

Fig.2 The expression levels of PPARγand proteins associated with pyroptosis图2 PPARγ及细胞焦亡相关蛋白表达水平
2.3 PPARγ在大鼠脑组织中的表达Western blot结果显示,MCAO组中PPARγ的表达水平低于sham组(P<0.05);PGZ组PPARγ的表达水平高于MCAO组,作用被PGZ激活(P<0.05);PGZ+GW9662组PPARγ的表达水平低于PGZ组,作用被GW9662抑制(P<0.05),见图2、表2。
3 讨论
细胞焦亡的概念是由Cookson等[6]首次提出,又被称为炎性细胞坏死,是一种促炎程序性细胞死亡模式[7]。其主要作用方式为半胱氨酸天冬氨酸蛋白酶−1前体(pro−caspase−1)发生酶原自体水解,分解产生caspase−1的活性形式p20亚基,活化的caspase−1进一步切割GSDMD蛋白,使其蛋白质N−末端部分在细胞膜上寡聚并形成孔道,从而引起细胞膜破裂,导致炎症因子IL−1β、IL−18的大量释放,进一步造成周围细胞炎症死亡[8]。越来越多的临床病例发现,细胞焦亡参与了疾病的发生发展。如在肾缺血再灌注中,细胞焦亡导致肾脏细胞不可逆坏死,引起患者发生肾衰竭而死亡;在心肌缺血再灌注中,细胞焦亡造成大量缺血区心肌细胞坏死,导致患者心衰而死亡[9−11]。本研究结果发现,在大鼠脑缺血再灌注中caspase−1、GSDMD及细胞炎性因子IL−1β、IL−18的表达水平显著增加;同时,大鼠神经功能评分明显提高,脑梗死面积明显增大,显示在大鼠脑缺血再灌注中发生了细胞焦亡,且随着细胞焦亡水平的提高,神经损伤加重,提示抑制细胞焦亡可能是一种新的治疗脑缺血再灌注损伤的方法。
PPARγ属于配体激活的核转录因子,作为一种重要的细胞调节因子,在神经细胞中广泛表达[12−13]。迄今已经证实,PPARγ在脑缺血再灌注损伤过程中发挥重要作用。如PPARγ活化后可通过抑制核转录因子κB(NF−κB)[14]、降低兴奋性毒性[15]、抗氧化作用[16]等环节抑制神经细胞炎症反应,减轻脑缺血再灌注损伤。细胞焦亡是近年来在多种疾病的病理过程中发现的一种新的细胞程序性炎症死亡方式。如在糖尿病心肌缺血再灌注中,细胞焦亡参与了心肌细胞的不可逆性细胞死亡,从而引起患者心功能衰竭死亡[17]。细胞焦亡也被发现在脑缺血再灌注损伤中发挥重要作用。如Zhang等[2]研究发现在大鼠脑缺血再灌注损伤中焦亡关键蛋白GSDMD明显升高,神经细胞损伤明显增强。进一步研究发现,在NOD样受体热蛋白结构域相关蛋白3(NOD−like receptor pyrin domain−containing protein 3,NLRP3)的启动子区域有PPARγ结合位点[18],NLRP3是炎症小体NLR家族成员之一,是诱导细胞焦亡的关键。因此,笔者推测PPARγ与焦亡可能存在内在联系,通过活化PPARγ影响焦亡产生有望成为一种新的抗CIRI方 法。本 研 究 通 过PPARγ配 体PGZ激 活PPARγ后发现,细胞焦亡关键蛋白caspase−1和GSDMD及细胞炎症因子IL−1β和IL−18的表达明显降低,神经功能评分减轻,脑梗死面积显著减少。为了进一步证实PPARγ的特异性神经保护作用,采用PPARγ的特异性抑制剂GW9662进行阻断后再观察,结果发现,PPARγ的抗细胞焦亡作用显著减弱,神经功能评分升高,脑梗死面积增加。这表明PPARγ活化后可通过抑制细胞焦亡达到神经细胞保护作用。
综上所述,本研究探讨了在大鼠脑缺血再灌注损伤中PPARγ活化与细胞焦亡的关系,发现PPARγ活化后通过抑制细胞焦亡的发生达到神经细胞保护作用,为临床治疗脑缺血再灌注损伤提供了新的方法。
