Wnt信号通路转录上调EGFR促进非小细胞肺癌吉非替尼耐药
2020-03-20王倩黎谢梦丹罗凯郑国沛张志杰卢敏莹董静贾小婷贺智敏
王倩,黎谢梦丹,罗凯,郑国沛,张志杰,卢敏莹,董静,贾小婷,贺智敏
肺癌的发病率与死亡率在世界范围内均高居首位,其中非小细胞肺癌(non−small cell lung cancer,NSCLC)约占80%左右[1]。NSCLC传统的全身治疗手段为化疗,但不良反应较多。近年来伴随着NSCLC驱动基因的发现,以驱动基因为治疗靶点的靶向治疗因针对性强、疗效好和毒副作用小等优点在临床获得了广泛的应用。其中表皮生长因子受体(epidermal growth factor receptor,EGFR)是NSCLC最主要的驱动基因之一,而EGFR突变阳性的NSCLC患者在接受EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)靶向治疗时可获得良好的疗效[2−3]。目前主要的EGFR−TKIs靶向药物包括一代吉非替尼、厄洛替尼,二代阿法替尼和三代奥希替尼,然而NSCLC患者接受EGFR−TKIs靶向治疗12个月左右均不可避免出现药物耐受,目前已发现的EGFR−TKIs靶向耐药机制包括EGFR基因二次突变、旁路激活和表型转换等,但仍有相当比例患者的耐药机制未明[4−5]。因此进一步发现耐药靶标并阐明其耐药机制对于逆转EGFR−TKIs耐药提高NSCLC综合疗效具有重要的意义。
本课题组前期已成功构建了吉非替尼继发耐药的NSCLC细胞株HCC827/R且已排除主要已知耐药机制的作用,亲代与耐药细胞基因芯片差异表达基因数据生物信息学分析结果显示耐药细胞中Wnt信号通路异常活化且EGFR基因表达升高,提示Wnt信号通路与EGFR均可能参与了吉非替尼耐药[6]。本研究拟证实Wnt信号通路与EGFR本身在NSCLC吉非替尼耐药中的作用并初步阐明其机制,为寻找新的耐药靶标和逆转耐药方式提供实验依据。
1 材料与方法
1.1 材料 人肺癌HCC827细胞购自中科院上海细胞所,吉非替尼继发耐药细胞HCC827/R为本实验室自行构建。293T细胞为本实验室保存。吉非替尼购自MCE公司。RPMI 1640培养液与胎牛血清购自Gibco公司。Trizol、Lipo2000转染试剂购自Thermo公司。逆转录试剂盒、SYBR®Premix Ex Taq™荧光定量PCR试剂盒购自TaKaRa公司。EGFR、β−catenin抗体购自CST公司。MTS购自Promega公司。Chip试剂盒购自Active Motif公司。T细胞因子/淋巴增强因子(T−cell factor/lymphoid enhancer−binding factor,TCF/LEF)依赖活化的Luciferase质粒、TCF3过表达质粒、TCF4过表达质粒、EGFR基因启动子区Luciferase质粒购自复能基因公司。另收集2012—2016年间EGFR−TKIs靶向治疗耐药前后NSCLC肿瘤组织样品3对,样本经本院经病理诊断确诊并行基因检测为EGFR基因突变阳性的晚期(Ⅲ~Ⅳ期)NSCLC,同时通过查询病历系统和病理诊断系统确认其在确诊后接受了吉非替尼或厄洛替尼靶向治疗直至临床耐药且再次接受穿刺或镜检获得了肿瘤组织,其中男2例,女1例,年龄58~68岁。
1.2 方法
1.2.1 细胞培养 本研究所用到的HCC827、HCC827/R和293T细胞均利用含10%胎牛血清的RPMI 1640培养液于37℃,5%CO2培养条件下培养,每2~3 d传代1次,待细胞培养融合度达80%左右时用于后续实验研究。
1.2.2 实时荧光定量 PCR(qRT−PCR)检测HCC827和HCC827/R细胞中EGFR mRNA表达Trizol提取细胞总RNA,利用逆转录试剂盒将总RNA逆转录为cDNA,取5倍稀释cDNA 2µL作为模板,以人β−actin作为内参基因进行qRT−PCR扩增。EGFR引物:上游5′−AGGCACGAGTAACAAGCTCAC−3′,下游5′−ATGAGGACATAACCAGCCACC−3′;β−actin引物[7]:上游5′−ATGATGATATCGCCGCGCTC−3′,下游5′−CCACCATCACGCCCTGG−3′。反应体系:SYBR GreenⅠ10µL、上下游引物(10µmol/L)各2µL、ddH2O 4µL、稀释后cDNA产物2µL,总体积20µL。反应条件:95℃预变性30 s;95℃变性5s,60℃复性30 s,72℃延伸45 s(采集荧光),共45个循环;熔解曲线分析。所有检测指标均设置3个重复检测孔,利用2−ΔΔCT法计算基因相对表达量。
1.2.3 免疫印迹实验(Western blot)检测HCC827和HCC827/R细胞中EGFR蛋白表达 提取细胞总蛋白,BCA法测定蛋白浓度,取20µg蛋白进行SDS−PAGE电泳,电泳完成后将蛋白转至PVDF膜上,5%脱脂牛奶于室温封闭2 h,洗涤后一抗(1∶2 000)4℃孵育过夜,次日洗涤后加二抗(1∶2 000)室温孵育2 h,再次洗涤后加发光液于暗室进行观察结果。
1.2.4 免疫组织化学染色检测EGFR基因在EGFR−TKIs靶向治疗耐药前后NSCLC肿瘤组织样品中的表达 组织切片经二甲苯脱蜡后梯度乙醇水化,PBS洗涤;封闭液中浸泡30 min再次PBS洗涤;微波炉煮沸进行抗原修复,PBS再次洗涤;加山羊血清封闭液进行封闭;加一抗室温孵育1 h后转4℃孵育过夜;PBS洗涤后加二抗室温孵育1 h;PBS洗涤后DAB显色、苏木精复染、盐酸酒精分化;脱水、透明、封片后显微镜下观察EGFR表达情况。
1.2.5 双荧光素酶报告基因实验检测HCC827和HCC827/R细胞Wnt/β−catenin信号通路活化以及TCF3、TCF4转录对EGFR基因的表达调控 取对数生长期HCC827和HCC827/R细胞,将TCF/LEF依赖活化的Luciferase质粒转入细胞,继续培养72 h后收集上清,每个实验组设置3个重复孔,检测上清中GLUC报告荧光素酶活性和SEAP对照荧光素酶活性,计算相对荧光素酶活性(GLUC/SEAPs)。另将TCF3和TCF4过表达质粒及各自对照质粒分别与EGFR基因启动子区双荧光素酶报告基因质粒共转染入对数生长期293T细胞中,依上述步骤检测并计算相对荧光素酶活性。
1.2.6 生物信息学预测LEF/TCF转录因子在人EGFR基因启动子区的结合位点 在ensembl(http://asia.ensembl.org/index.html)数据库中获得人EGFR基因上游启动子区3 000 bp长度的序列(NM_005228),将该序列导入Jaspar(http://jaspar.genereg.net)数据库中预测LEF/TCF家族转录因子在该区域的结合位点。
1.2.7 染色质免疫共沉淀实验(Chromatin Immunoprecipitation,Chip)检测β−catenin/LEF/TCF转录复合物与EGFR基因启动子区的结合 利用人EGFR基因启动子区序列和生物信息学预测到的LEF/TCF转录因子在EGFR基因启动子区的结合位点,设计针对结合位点的PCR引物:上游5′−CTGTTGTGCTTCCCATTT−3′,下游5′−TTGTGCCTGGGTCTCG−3′。待10 cm培养皿中HCC827/AR细胞生长融合度达80%~90%时,加入多聚甲醛交联,终止交联后刮取细胞超声打断,离心后取10µL上清作为Input组,另各取50µL上清分别做为IgG组和β−catenin组,各组分别加入磁珠和对应抗体后,4℃颠倒过夜,磁力架吸附洗涤磁珠后再加入解交联buffer洗脱染色质,利用洗脱染色质为样品行qRT−PCR检测。qRT−PCR反应体系与反应条件同1.2.2。
1.2.8 功能阻断实验检测Wnt3a刺激和EGFR干扰情况下HCC827细胞对吉非替尼耐药性的变化 实验设置6组:HCC827空白组、HCC827+Con1组(添加Wnt3a稀释液)、HCC827+Wnt3a组、HCC827−Con2组(转染EGFR shRNA对照 质 粒)、HCC827−EGFR shRNA组 和HCC827−EGFR shRNA+Wnt3a组。96孔板中按2 000个/孔接种对数生长期HCC827细胞,待细胞贴壁后除HCC827空白组外其他各组加入终浓度为3.13µmol/L的吉非替尼,同时在HCC827+Wnt3a组中加入终浓度150µg/L的Wnt3a激活Wnt/β−catenin信号通路,HCC827+Con1组中加入等体积Wnt3a稀释液,HCC827−Con2组和HCC827−EGFR shRNA组分别转染对照质粒和EGFR shRNA,HCC827−EGFR shRNA+Wnt3a组在细胞转染EGFR shRNA质粒后同时加入终浓度150µg/L的Wnt3a,每组设置3个重复孔,37℃,5%CO2培养条件下继续培养48 h,然后按20µL/孔的量加入MTS试剂,孵育3 h后置多功能酶标仪中测定OD值,利用所测数据计算药物对细胞的抑制率(抑制率=1−加药亚组OD值/未加药组OD值)。
1.3 统计学方法 利用SPSS 19.0进行数据统计分析,计量资料以均数±标准差(±s)形式表示,数据组间比较采用独立样本t检验,多组间比较采用单因素方差分析或析因设计方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 EGFR在EGFR−TKIs继发耐药的NSCLC细胞和肿瘤组织中高表达 qRT−PCR结果显示,EGFR在吉非替尼耐药HCC827/R细胞中的表达较亲代细胞升高,差异有统计学意义(n=3,t=22.228,P<0.01),见图1A。Western blot实验结果也显示EGFR在耐药HCC827/R细胞中的表达明显高于亲代细胞(n=3,t=19.374,P<0.01),见图1B、C。免疫组织化学染色结果显示,在3对肿瘤组织中,有2例EGFR−TKIs靶向治疗耐药后较治疗前的EGFR表达增加。见图1D。
2.2 HCC827和HCC827/R细胞中Wnt信号通路活化状态 HCC827/R细胞的相对荧光素酶活性高于亲代HCC827细胞(n=3,t=11.194,P<0.01),见图2。
2.3 Wnt信号通路激活后上调EGFR表达 在Jaspar数据库中预测到在EGFR基因启动子区上游−1476~−1468区域存在LEF/TCF家族的TCF3和TCF4转录因子结合位点,见图3A。HCC827/R细胞Chip实验结果显示,针对该位点的PCR引物扩增β−catenin抗体沉淀的HCC827/R细胞染色质结果为阳性(n=3,t=109.119,P<0.01),见图3B。双荧光素酶报告基因实验结果显示在293T细胞中共转染过表达TCF3质粒、TCF4质粒和EGFR基因启动子区双荧光素酶报告基因质粒后,其相对荧光素酶活性较对照组升高,差异有统计学意义(n=3,t分别为5.209、12.939,均P<0.01),见图3C、D。
2.4 Wnt信号通路转录上调EGFR介导吉非替尼耐药 利用Wnt3a刺激HCC827细胞后可见吉非替尼对细胞的抑制率较HCC827 Con1组下降,差异有统计学意义(n=3,F=81.653,P<0.01),见图4A。敲低HCC827细胞EGFR基因表达后吉非替尼对细胞的抑制率较HCC827 Con2组升高,差异有统计学意义,见图4B。析因设计方差分析结果显示,Wnt3a刺激(F=293.335,P<0.01)和敲低EGFR基因表达(F=114.014,P<0.01)处理均影响吉非替尼对细胞的抑制率。但Wnt3a刺激和敲低EGFR基因表达处理间不存在交互作用(F=1.100,P=0.325)。在HCC827细胞中同时利用Wnt3a刺激细胞并敲低细胞EGFR基因表达后吉非替尼对细胞的抑制率较单独Wnt3a刺激组升高,而较单独敲低EGFR组细胞抑制率低(n=3,F=146.149,P<0.01),见图4C。

Fig.1 Expression of EGFR in acquired drug−resistant NSCLC cells and tumor tissues图1 EGFR在继发耐药NSCLC细胞和肿瘤组织中的表达
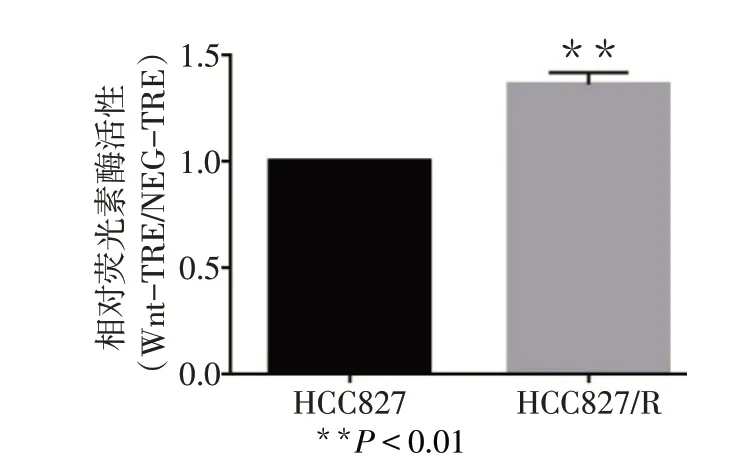
Fig.2 Relative activation status of Wnt signaling pathway in drug−resistant HCC827/R cells图2 耐药HCC827/R细胞Wnt信号通路的相对活化状态
3 讨论
EGFR−TKIs靶向治疗因具有疗效好、不良反应小等优点已在EGFR突变阳性NSCLC患者的临床治疗中得到了广泛应用。目前EGFR−TKIs类药物已发展出了以EGFR为主要靶点的单靶点药物和多靶点药物,不同药物其应用的临床指征有所不同,然而在晚期NSCLC一线治疗中,吉非替尼仍然是最主要的EGFR−TKIs类靶向药物[8]。
接受EGFR−TKIs药物治疗有效的NSCLC患者最终均会在12个月左右出现耐药。目前已有报道的EGFR−TKIs耐药机制主要包括3个方面[4−5]:一是EGFR基因的二次突变导致EGFR蛋白的二次激活,Li等[9]报道显示49.7%(71/143)的NSCLC患者在接受EGFR−TKIs治疗耐药后出现二次T790M突变,而该二次突变造成EGFR蛋白构象改变致使EGFR−TKIs不能再与EGFR蛋白结合抑制其活性从而导致继发耐药,EGFR基因其他二次突变包括D761Y、C797S等[10]。二是旁路信号途径的激活,当EGFR−TKIs抑制了EGFR活性后,其他信号旁路或下游信号通路节点基因可能出现代偿性活化或被异常激活,cMET或HER-2基因扩增是NSCLC患者EGFR−TKIs耐药后常见的分子改变之一,cMET或HER2异常过表达且自身磷酸化后可激活下游信号通路促进细胞生长。三是组织细胞表型转换。近来研究报道,部分NSCLC患者接受EGFR−TKIs治疗耐药后,肿瘤转化为小细胞肺癌,其具体机制尚不明确[11]。目前虽已阐明了部分EGFR−TKIs耐药机制,但作为当前临床应用最广泛的EGFR−TKIs类药物吉非替尼,其耐药机制仍不明确。因此进一步发现吉非替尼耐药新靶点并阐明其机制对于提高靶向治疗的效果具有重要意义。
本研究前期利用存在EGFR基因19del突变的吉非替尼敏感细胞HCC827诱导构建了继发耐药HCC827/R细胞,同时利用Sanger测序法、ARMs法、Fish法检测了HCC827/R细胞中常见耐药相关分子改变,排除了EGFR基因二次突变、Kras基因突变、cMET和HER2基因扩增等已知主要吉非替尼耐药机制在HCC827/R细胞中介导耐药的作用,表明HCC827/R细胞中可能存在新的耐药机制[6]。生物信息学分析亲代与耐药HCC827/R细胞间差异表达基因的基因芯片结果发现Wnt信号通路活化且EGFR基因表达增加,提示两者可能与HCC827/R细胞的吉非替尼耐药有关。

Fig.4 Gefitinib resistance mediated by transcriptional upregulation of EGFR by Wnt signaling pathway图4 Wnt信号通路转录上调EGFR介导吉非替尼耐药
Wnt信号通路是一条保守的细胞信号通路,其功能主要包括调节干细胞增殖与分化、促进细胞上皮间质转化(EMT)和调节胚胎发育等。Wnt信号通路可分为经典途径和非经典途径,经典途径可通过Wnt配体蛋白与受体的结合而被激活,激活的经典Wnt信号通路可使胞浆中糖原合成酶激酶−3β(GSK−3β)、轴蛋白(Axin)与腺瘤样息肉蛋白(APC)等构成的蛋白复合体解聚释放β−catenin,而胞浆中游离β−catenin浓度增加后会入核与TCF/LEF转录因子结合形成转录复合物调控下游靶基因的表达[12]。新近研究认为经典Wnt信号通路的异常激活与肿瘤发生和化疗耐药有关,该研究发现作为治疗靶点的EGFR在吉非替尼长时间诱导耐药的HCC827/R细胞中的表达反而增加,提示长时间的吉非替尼治疗可能会诱导EGFR代偿性高表达来拮抗吉非替尼的抑制效应,从而促进药物耐受[13]。同时本研究利用TCF/LEF依赖活化的Luciferase质粒证实了Wnt信号通路在耐药HCC827/R细胞中异常活化。鉴于Wnt信号通路可通过转录因子TCF/LEF调节下游靶基因的表达,因此本研究提出Wnt信号通路通过转录上调EGFR表达参与介导NSCLC吉非替尼耐药的科学假设,后期生物信息学分析预测到EGFR基因启动子区存在TCF/LEF转录因子结合位点且Chip实验和双荧光素酶报告基因实验结果进一步证实了Wnt信号通路可转录上调EGFR表达。功能阻断实验结果显示,当单独利用Wnt3a刺激HCC827细胞时,吉非替尼对细胞的抑制率较对照组明显降低,证明Wnt信号通路介导了吉非替尼耐药,而 刺激的同时敲低细胞 表达则吉非替尼对细胞的抑制率较单独Wnt3a刺激组有所恢复,这证明Wnt信号通路通过转录上调EGFR表达参与介导了HCC827/R细胞对吉非替尼的耐药。免疫组化染色结果也显示在临床EGFR−TKIs耐药的NSCLC样品中也存在EGFR表达较耐药前增加的情况,提示该耐药机制也存在于临床患者中。目前Wnt信号通路代偿性上调靶点EGFR表达介导NSCLC吉非替尼耐药尚未见相关报道,本研究结果为进一步阐明NSCLC吉非替尼耐药机制提供了新的思路和实验依据。
然而,Wnt3a刺激加同时敲低EGFR组吉非替尼对细胞的抑制率虽然较单独Wnt3a刺激组的抑制率有所回升,但并未达到完全恢复,这表明Wnt信号通路还可能同时通过其他途径介导吉非替尼耐药,值得进一步研究。同时由于NSCLC患者EGFR−TKIs治疗耐药前后配对组织标本取样困难的原因,本研究纳入的临床样品偏少,接下来本研究将进一步扩大临床样品量进行验证。
综上所述,Wnt信号通路通过转录上调EGFR表达介导了NSCLC吉非替尼耐药,有望为逆转NSCLC吉非替尼耐药提供新思路。
