不同植茶年限茶树根际土壤细菌多样性及群落结构研究
2020-03-19许广王梦姣邓百万郭苗苗
许广 王梦姣,2 邓百万,2 郭苗苗
(1. 陕西理工大学生物科学与工程学院,汉中 723000;2. 陕西省食药用菌工程技术研究中心,汉中 723000)
在植物根际土壤中,土壤-微生物-植物根际之间相互影响,相互作用[1]。根际微生物在土壤的物质转化[2]、促进植物吸收养分[3]、提高植物抗病虫害能力[4]、提高植物抗逆性[5]、生长发育等方面发挥着极其重要的作用,同时根际土壤微生物种类和数量也是评价土壤肥力高低的重要生物指标。
根际土壤细菌代谢旺盛,繁殖速度快,是植物根际土壤微生物数量、种类较多的类群[6],几乎驱动所有生物地球化学循环,参与土壤中养分转化[7]。例如:荧光假单孢菌(Fluorescent pseudomonas)[8]作为生防菌抑制病原真菌生长、固氮细菌(Azotobacter)[9]能促进对氮元素的吸收,伯克霍德氏菌(Burkholderia)[10]能溶解硅酸盐矿物,减少环境污染等等。
近年来在植物土壤微生物多样性方面研究很多,但是主要集中在农作物[11-14]、林木[15]等方面,对茶树根际土壤微生物的研究较少。本文选取汉中西乡地区3种植茶年限的茶树,采用传统培养法和高通量测序技术研究其根际土壤细菌多样性和群落结构组成,并分析茶树土壤理化性质与细菌群落的相关性,为改善茶树的土壤和提高茶树产量提供参考。
1 材料与方法
1.1 材料
采样地位于秦巴山区腹地的汉中市西乡县千山茶园,属北亚热带半湿润季风气候,土壤类型为矿物质含量较高的黄棕壤,茶树其他自然生长条件见表1。自20世纪90年代以来,该地已经建立茶叶生产基地,当前已经形成规模广大、管理良好的现代化生态茶园。施肥上采用机械化方式施加有机肥,同时补充氮肥,叶面肥。基于生态和绿色有机理念,茶树种植方面均采用有机肥,实现精准施肥,减少人为干预。
研究对象选取该茶园种植年限为5年(32°56'2″ N,107°51' 32″ E,737 m)、10 年(32°56'14″N,107°51' 59″ E,805 m)、20 年(32°56' 58″ N,107°52' 13″ E,814 m)且品种均为紫阳群体的茶树根际土壤。
采样时间为2018年9月,天气晴朗,用五点采样法收集距茶树主干20 cm,垂直深度20-40 cm的根际土壤。用抖落法去掉与根系结合松软土壤,将剩余土壤与根系装入无菌密封塑料袋中,贴上标签,立即带回实验室混匀,过2 mm筛,一部分用于分子实验并保存于-80℃冰箱,一部分用于测定土壤理化性质。
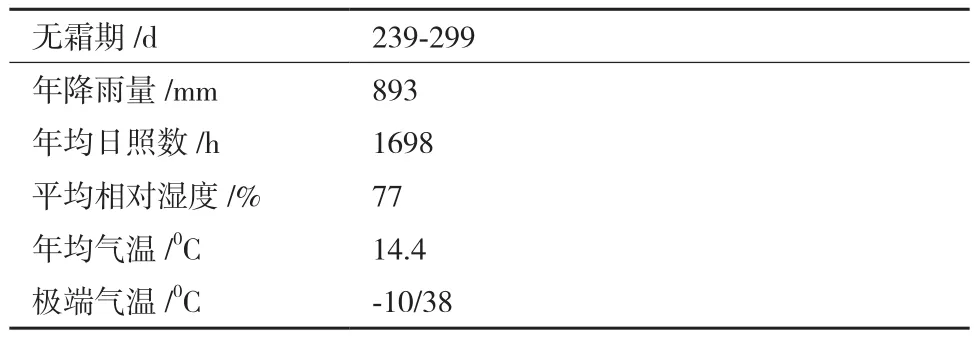
表1 茶树生长环境基本情况
1.2 方法
1.2.1 传统培养法分析不同植茶年限茶树根际土壤细菌多样性
1.2.1.1 根际细菌的分离计数及纯培养 称取10 g茶树土壤依次制备成10-1、10-2、10-3梯度稀释液。各吸取100 mL至牛肉膏蛋白胨培养基上,涂布均匀,37℃培养14-18 h,重复3次,利用菌落计数器计数。
1.2.1.2 根际细菌16S rDNA的扩增及鉴定 用天根细菌试剂盒提取基因组DNA,用通用引物E-27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-G GTTACCTTGTTACGACTT-3')进行16S rDNA的序列扩增。送天津擎科生物公司测序。将所测的序列提交到GenBank数据库中并进行BLAST检索,下载同源性较高的数据,初步确定分离得到菌的种属。
1.2.1.3 根际细菌的种群多样性分析 计算不同植茶年限茶树根际土壤细菌的香侬-威纳指数(Shannon-Wiener)、辛普森指数(Simpsonindex)、丰富度指数(Margalef index)、均匀度(Evenness),具体分析方法参考文献[16-17]。
1.2.2 高通量测序分析不同植茶年限茶树根际土壤细菌多样性
1.2.2.1 DNA提取、16S rDNA扩增和高通量测序用Power SoilDNA Isolation Kit试剂盒提取土壤微生物总DNA,用Nano Drop分光光度计(Nano-100,Aosheng Instrument Co Ltd.)检测DNA的浓度和纯度。用 引 物 515F(5'-GTGCCAGCMGCCGCGGTAA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')扩增细菌16S rDNA序列的V3-V5区。PCR反应体系为50 μL,2×Premix Taq 25 μL,515F/806R 引物各 1 μL,DNA 3 μL,Nuclease-free water 20 μL, 反 应 条 件 :94℃ 5 min,30个循环(94℃,30 s;52℃,30 s;72℃,30 s),72℃ 10 min,4℃ 保存。使用 Illumina Hiseq2500平台进行测序。
1.2.2.2 高通量测序数据处理 利用Trimmomatic软件得到质控后的PE reads。选择FLASH软件将其拼接为原始序列。然后利用Mothur软件将序列分配至相应的样品中,得到最终片段。利用Usearch[18]软件以97%的相似度将Tags聚类成为OTU,并计算Chao1指数、Shannon指数、Simpson指数、均一度,具体方法参考[19]。同时基于MRPP多相应置换过程分析、Adonis置换多因素方差分析、Amova分子方差分析进行差异检验,从而获取样品多样性和组间显著性差异分析,具体方法参考[20]。
1.2.3 土壤理化性质的测定 土壤有机碳(TOC)测定采用重铬酸钾氧化-外加热法,总氮(TN)测定采用凯氏定氮法,水解性氮(HN)测定采用碱解扩散法。总磷(TP)测定采用碱熔法,有效磷(AP)测定采用电感耦合等离子体发射光谱法,全钾(TK)测定采用碱熔法,速效钾(AK)测定采用1 mol乙酸铵浸提法,pH计测定土壤pH,具体方法参考[21-22]。
2 结果
2.1 培养法结果分析
2.1.1 不同植茶年限茶树根际土壤的细菌数 不同年限茶树土壤细菌数目存在显著性差异。5年茶树的根际土壤细菌数量明显高于10年和20年,细菌数目随着植茶年限之间增加呈现下降趋势(图1)。
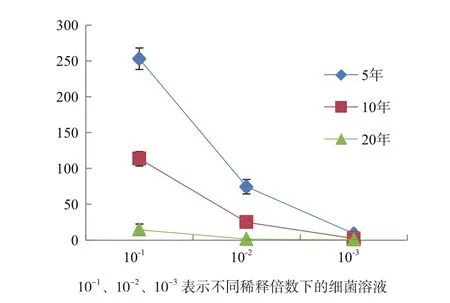
图1 不同植茶年限的茶树细菌菌落数
2.1.2 不同植茶年限茶树根际土壤的细菌组成 对3种不同种植年限的茶树根际土壤进行16S rDNA测序和比对分析。结果表明,在门水平上,3种年限之间群落组成有较大差异,10年的茶树土壤细菌门种类最多(图2-A),厚壁菌门(Firmicutes)为优势菌门,在5年、10年、20年茶树土壤中所占比例均最大,分别为93.7%、77.5%、87.5%,;在属水平上,芽孢杆菌属(Bacillus)在3种年限中均为优势菌属,比例分别是62.5%、75.5%、79.4%,不同年限之间细菌构成和多样性有显著性差异,10年的茶树土壤细菌多样性最为丰富,5年生次之,20年生最低(图 2-B)。
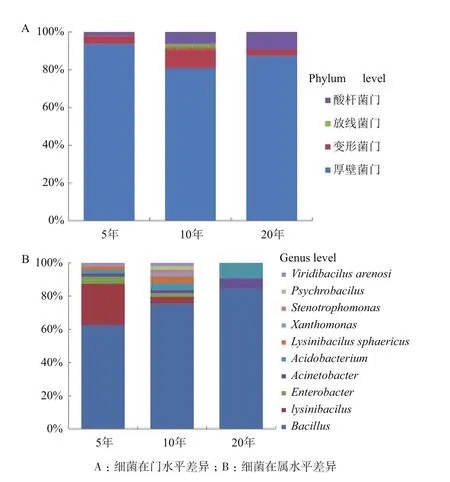
图2 不同植茶年限下的茶树根际细菌组成
2.1.3 不同植茶年限茶树根际细菌的多样性比较 利用牛肉膏蛋白胨培养基对3种年限茶树根际土壤样品进行分离纯化,共获得129株根际细菌,比较不同植茶年限的细菌多样性。由表2可见,不同年限茶树根际细菌群落的丰富度指数、Simpson指数、Shannon指数,存在显著差异(P<0.05),5年、10年、20年茶树细菌丰富度指数分别为1.54、2.31、0.58,说明10年茶树细菌丰富度最高,5年次之,20年最低。Simpson指数分别是0.54、0.42、0.27;Shannon指数分别为1.56、1.54、0.77。5年和10年茶树细菌Simpson指数和Shannon指数相似且均明显高于20年茶树,说明5年和10年茶树细菌的多样性更为丰富,20年茶树土壤细菌多样性最低。

表2 不同种植年限茶树根际细菌的多样性指数比较
2.2 高通量测序结果分析
2.2.1 不同植茶年限茶树细菌多样性和群落结构差异性 利用高通量测序技术测得序列片段,使用QIIME软件,基于97%的相似度将其聚类为OTU,共得到10 982条OTU。所有样本Observed稀释曲线趋于平缓,表明所测序列数据可以较好地反映细菌群落的种类与数量,基本涵盖了样本土壤的所有细菌种群,足以进行下游数据分析(图3-A)。
通过Chaol指数、Simpson指数和Shannon指数来比较3种植茶年限下的土壤细菌丰富度和多样性。根据Chaol指数得出,5年生的茶树根际细菌物种总数最多,10年茶树次之,20年最少(表3);根据Simpson指数和Shannon指数得出,3种年限的茶树细菌均表现出高水平的物种丰富度和细菌多样性,同时不同年限之间存在显著性差异;10年生的茶树细菌Simpson指数和Shannon指数均最高,说明10年生的茶树丰富度和多样性均最高;20年生的茶树根际细菌丰富度和细菌多样性最低(图3-BC)。对相对丰度较高(>1%)的30个细菌菌群,在属水平上进行聚类热图分析(图3-D)。结果表明,5年和20年茶树细菌群落结构和组成较为相似,与10年茶树存在显著性差异。基于MRPP、Anosim 和Adonis 算法的差异检验结果(表4)也表明3种植茶年限的土壤细菌群落结构存在显著差异。
2.2.2 不同植茶年限茶树土壤细菌群落组成差异性 3种年限的主要菌门(>1%)共有16个(图4-A),分别是奇古菌门(Thaumarchaeota)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、装甲菌门(Armatimonadetes)、拟杆菌门(Bacteroidetes)、衣 原 体(Chlamydiae)、 绿 菌 门(Chloroflexi)、Dependentiae、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、Latescibacteria、硝化螺旋菌门(Nitrospirae)、变形菌门(Proteobacteria)、浮霉菌门(Planctomycetes)、疣微菌门(Verrucomicrobia)、Patescibacteria。主要菌属(>1%)共有17个(图4-B),分别是ADurb.Bin063-1、酸杆菌属(Acidibacter)、根 瘤 菌 属(Bradyrhizobium)、Bryobacter、 伯 克氏 菌 属(Burkholderia)、Candidatus_Solibacter、Candidatus_Udaeobacter、戴尔福特菌属(Delftia)、Dysgonomonas、 芽 单 胞 菌(Gemmatimonas)、Granulicella、HSB_OF53-F07、Massilia、Mucilaginibacter、地杆菌属(Pedobacter)、假单胞菌属(Pseudomonas)、寡养单胞菌属(Stenotrophomonas)。
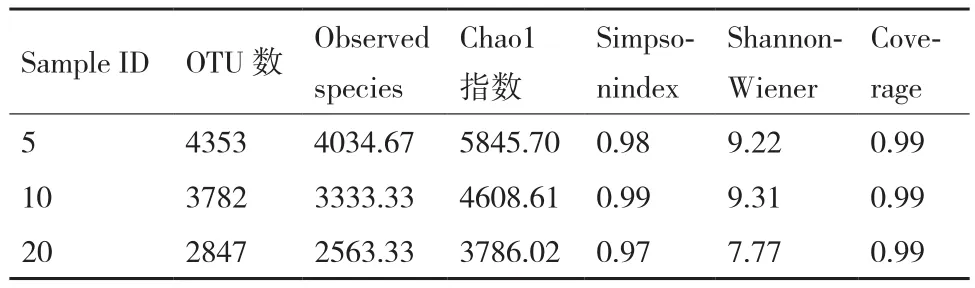
表3 不同种植年限的茶树细菌多样性比较
3种年限的茶树土壤样本各自特有OTU在各自总OTU数量中所占比例不同,分别为占5年茶树(4 353)OTU数目的35.7%、占10年茶树(3 782)OTU数目的26.0%、20年茶树(2 847)OTU数目的20.3%。3种年限茶树土壤公有OTU数为1 646个,分别占5年的37.8%、10年的43.5%、20年的57.8%(图5)。该结果表明3种年限下的茶树细菌群落组成存在显著性差异。
2.2.3 不同植茶年限细菌群落结构对土壤理化性质的相关性 土壤理化性质结果见表5,其中TOC、TN、TK、AP、AK和pH在3种年限茶树土壤中呈现显著性差异。10年茶树土壤TOC含量最高,5年和20年茶树TOC差异不明显,但都低于10年茶树;三者的TN含量差异性显著,10年最高,5年次之,20年最低;5年和20年茶树土壤之间TK含量差异不明显且低于10年茶树土壤;5年茶树土壤的AP含量显著高于10年和20年茶树;AK在10年和20年茶树土壤中含量几乎一致且明显高于5年茶树土壤;20年茶树土壤pH明显高于5年和10年;基于茶树细菌群落结构与土壤理化因子间CCA数据和相关性热图(图6)分析:TN、TK、AP、pH对汉中茶树细菌群落的影响较大。
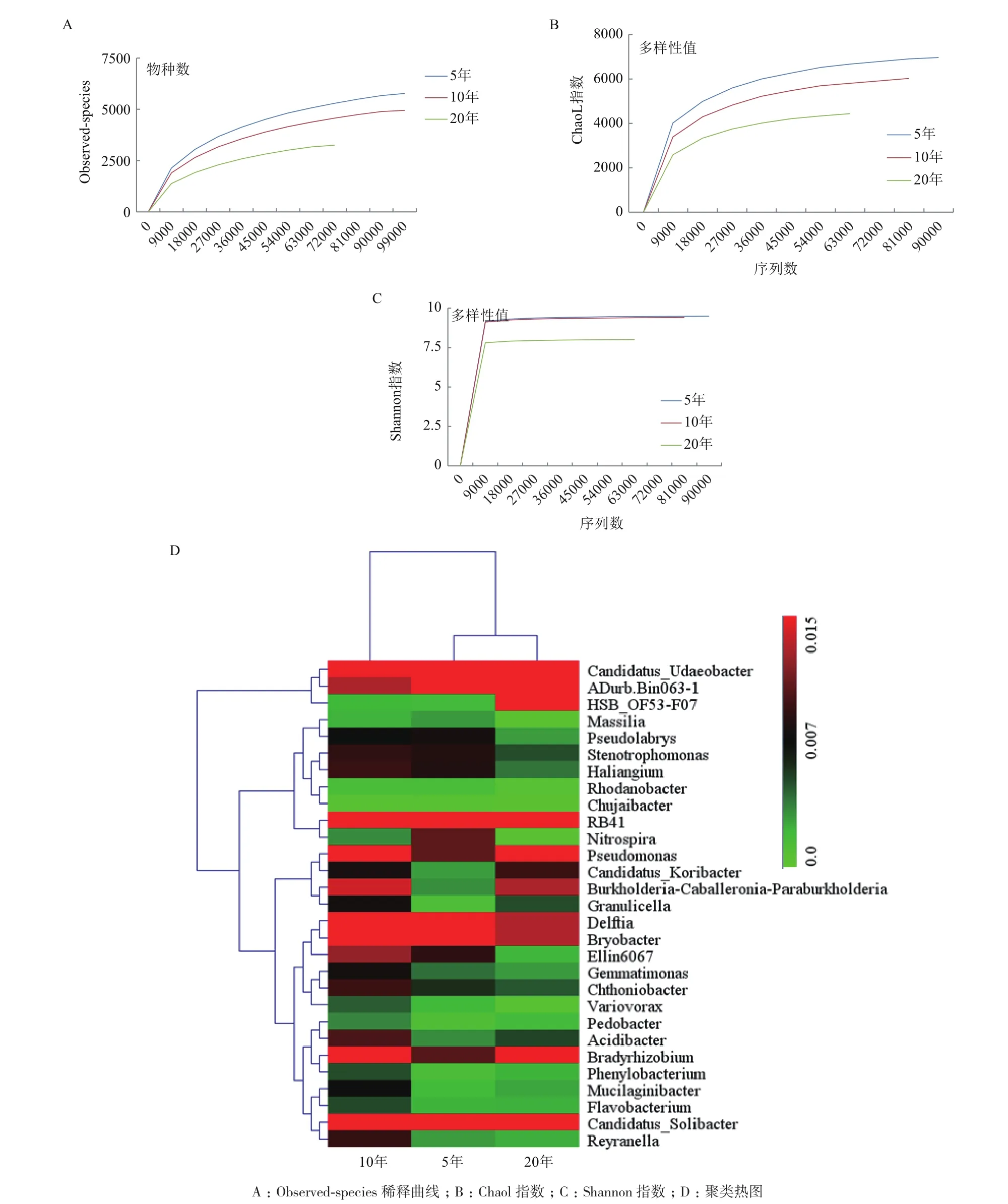
图3 不同植茶年限茶树细菌丰富度及多样性分析
3 讨论
土壤是茶树生长的载体,茶树连续种植后,极易导致土壤酸化[23]。本实验结果表明植茶年限的增加,根际土壤pH呈现下降趋势,与5年茶树相比,20年茶树根际土壤pH下降了18.5%,可见茶树连续种植会引起土壤酸化,与前人研究结果一致。土壤中细菌种类最多,数量最大。细菌喜中性偏碱的土壤环境,连作会导致细菌数量的减少[24],土壤贫瘠,自毒效应增强,多样性降低,病虫害加剧[25-26]。本实验中两种方法结果均表明随着植茶年限的增加,茶树根际细菌的数量呈现下降趋势,多样性也严重降低,与前人研究结果一致。

表4 不同植茶年限茶树土壤细菌群落结构差异性分析
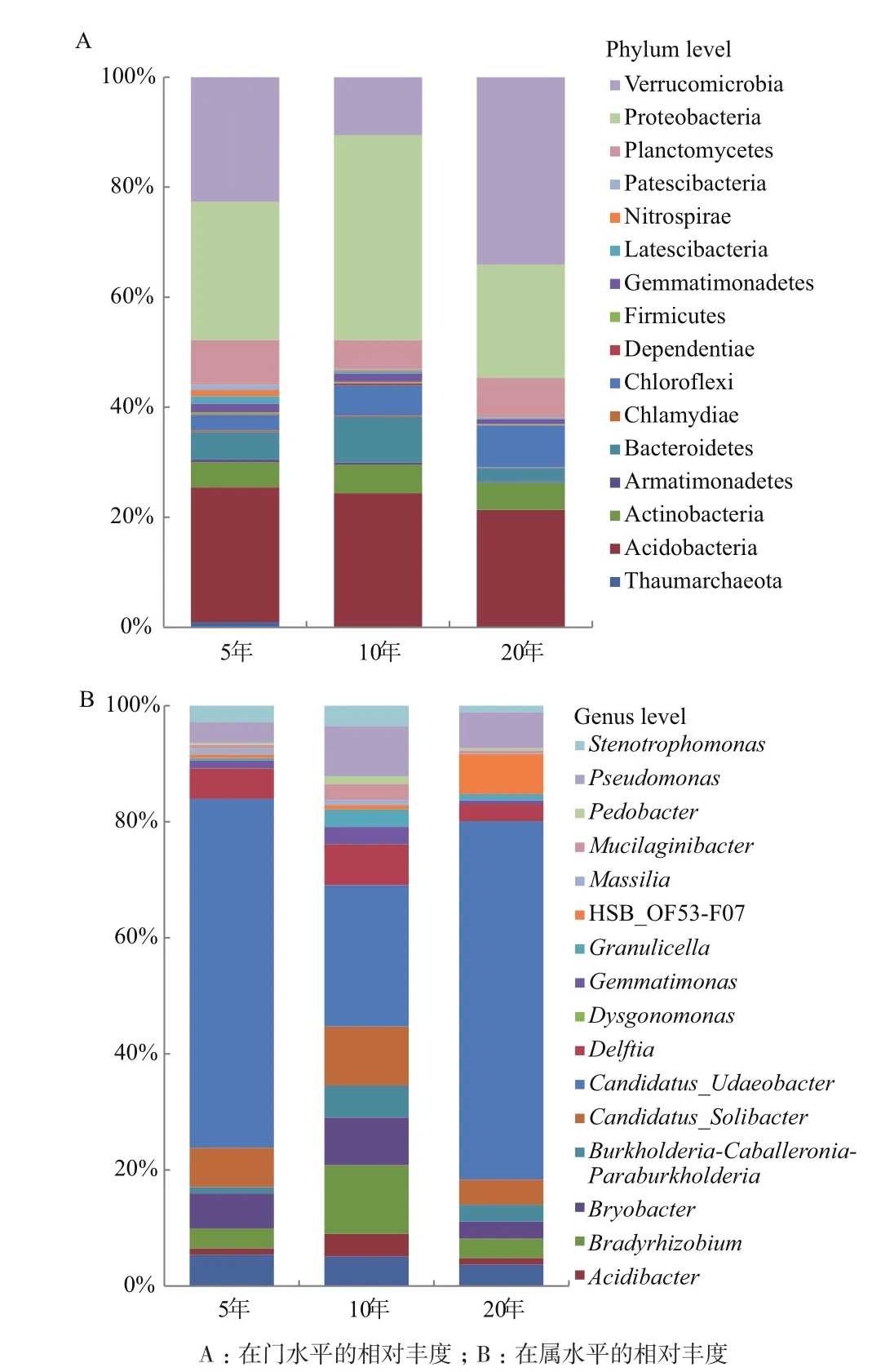
图4 不同植茶年限根际细菌群落主要菌群相对丰度
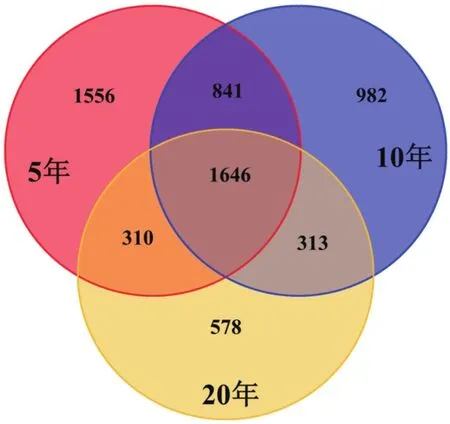
图5 不同年限茶树土壤样品OTU分布的Venn分析图
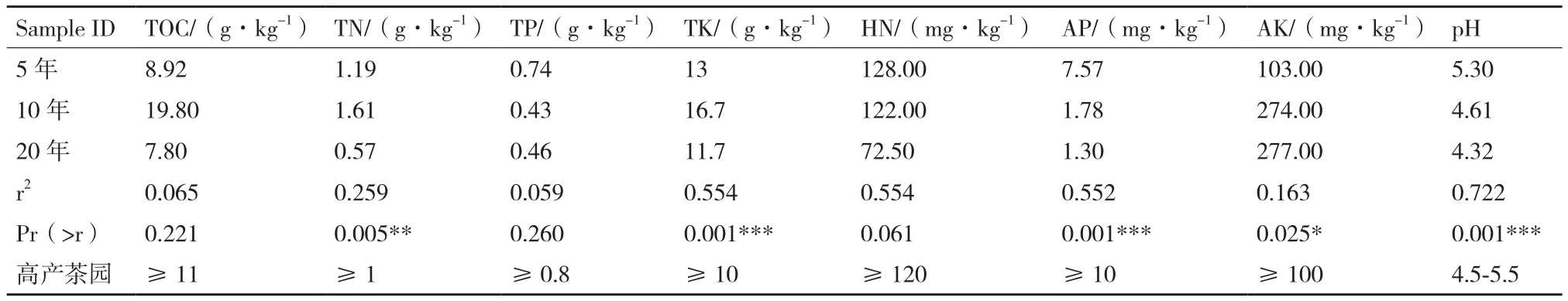
表5 不同植茶年限和高产茶园土壤理化性质及CCA数据分析
比较传统培养法和现代高通量测序技术的结果可见,后者得到的微生物多样性远远高于前者。反映出土壤中存在许多不可培养的微生物[27]。两种方法均表明植茶年限对细菌群落构成有显著性影响,但是两种方法获得的优势菌群有显著差异,原因在于培养法分离细菌时仅采用牛肉膏蛋白胨培养基,其所含营养与土壤原始营养环境差异较大,使得对营养要求复杂、培养基偏好性、生长缓慢、贫营养型的微生物无法生长,仅利于某几种微生物类群生长,使其成为平板上的优势类群[28]。其次,微生物培养再选择过程中部分微生物的信号会放大,其他大量微生物信息可能缺失[29]。例如:黄祖新等[30]采用培养法与非培养法比较宿根甘蔗根际土壤细菌多样性时,得到Burkholderia和Acidobacteria分别是培养法和非培养法中的优势菌群;崔中利[31]采用培养法与非培养法比较高产水稻土细菌多样性时,得出培养法优势菌为Pseudomonas和Bacillus与非培养法以Acidobacteria为主不同;杨虎[32]利用培养和非培养法分析冷藏鸡肉胴体中的细菌多样性,也得到完全不一致的结果。本文培养法结果表明Firmicutes和Bacillus在3种植茶年限中均为优势门属,原因在于芽孢杆菌具有外层芽孢,能耐高温,耐酸,在实验中易被分离到,形成平板优势菌群。高通量测序结果显示Acidobacteria、Proteobacteria、Bacteroidetes在3种植茶年限中均属于优势菌群,与Janssen[33]研究结果较为一致。Candidatus_Udaeobacter随着植茶年限增加而比例逐渐变大且优势愈发明显,原因在于植茶年限增加会引起土壤微生态失调,单一化群落结构明显,更利于某种菌的生长[34]。
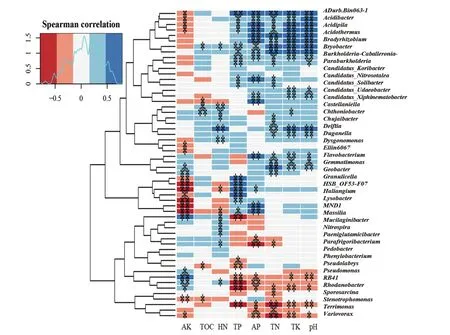
图6 茶树根际细菌群落与理化因子的相关性热图分析
土壤微生物群落与土壤肥力之间有密切关系,养分含量严重影响土壤微生物数量和多样性[35]。据报道,增加有效磷(AP)可以提高微生物多样性[36];pH值是影响土壤微生物群落结构的最强因素[37-38],改善土壤pH对土壤微生物量和细菌群落多样性具有积极意义[39];全钾(TK)与茶园生产力、细菌多样性密切相关[40];土壤中总氮(TN)可以影响微生物生物量[41]。本研究结果表明随着植茶年限的增加,TN、TK、AP、pH均呈现出下降趋势,从而导致细菌群落的数量和多样性也随之降低。同时结合高产茶园土壤主要养分指标分析,随着植茶年限的增加,有必要采取措施防止土壤酸化,同时增施氮肥和磷肥,以提高茶园产量和品质。
本实验培养法采用的培养基较单一,具有局限性,所获得的细菌数量和种类均较少,但其优势在于成本低、获取的菌体纯度高,是分离目标物种的重要手段,同时也保存了微生物菌种资源,用于实际生活生产方面。例如:通过培养法获得的Viridibacillus arenosi可降解霉变玉米粉中的黄曲霉毒素B-1[42];耐高温的α淀粉酶也是由培养法获得的芽孢杆菌产生[43]。高通量测序技术与培养法相比能更全面地反映不同植茶年限下茶树根际细菌的物种组成及丰度信息。但是高通量测序技术获取的信息量巨大,其归类整合没有严格标准,而且高通量测序技术仅以微生物DNA为检测基础,故无法区分死菌与活菌。综上所述,我们在实际过程中,需要将这两种方法相结合,以求获取全面准确的信息,为改善茶树的土壤和提高茶树产量、后期研制微生物菌肥提高实验数据。此外,本实验仅对细菌群落进行了分析,对于茶园土壤其他种类的微生物类群,如真菌、放线菌等分布状况,有待于进一步研究。
4 结论
不同植茶年限下的汉中茶树根际土壤细菌多样性丰富。在细菌群落构成方面,传统培养法:厚壁菌门和芽孢杆菌属在植茶年限为5年、10年、20年中均为优势门属;高通量测序技术:酸杆菌门、变形菌门、拟杆菌门和Candidatus_Udaeobacter在3种植茶年限中为优势门属。植茶年限增加会使茶园土壤呈酸化趋势,且逐渐低于优质高产茶园土壤的最低标准。总氮、总钾、总磷、pH是影响汉中茶树细菌群落的关键理化因子;随着植茶年限增加,要采取必要措施防止土壤酸化,适当增施氮肥和磷肥。
