NGF过表达脐带间充质干细胞治疗大鼠脑出血的实验研究
2020-03-19邵锦根李旭升陶红苗何忠平刘晓玲周向平
邵锦根,李旭升,陶红苗,何忠平,刘晓玲,周向平
(1.金华市人民医院 神经内科,浙江 金华 321000;2.金华职业技术学院 医学院,浙江 金华 321000;3.金华市食品药品检验检测研究院,浙江 金华 321000;4. 金华市人民医院 康复科,浙江 金华 321000)
脑出血(intracerebral hemorrhage,ICH )具有发病率、死亡率、致残率和复发率高的特点[1]。临床流行病学数据显示[2-3],我国脑出血发病率占脑卒中的19.2%~53.5%。脑出血的发生机制可能与多种原因导致的神经元受损、神经功能缺失有关[4]。自体干细胞可在微创移植针的辅助下移植至脑组织坏死区,为脑出血的临床治疗提供了新思路[5]。脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs)己被证实可分化为神经元和神经胶质细胞,并能在受损的脑和脊髓中存活、增殖,使受损的神经功能得到改善[6]。研究表明[7-9],神经生长因子(nerve growth factor,NGF)可提高培养神经元的存活率,并对脑出血的神经元变性、坏死具有保护和修复作用。研究发现[10],间充质干细胞转染NGF基因后,出现神经元样的形态变化及相关蛋白表达,提示在一定环境下NGF可诱导间充质干细胞向神经干细胞分化。本研究观察过表达NGF的UCMSCs在大鼠脑出血中的治疗效果。
1 材料与方法
1.1 实验动物及分组 80只SPF级SD雄性大鼠于相同环境中饲养3 d后,随机分为4组:空白对照组20只,脑出血组20只,NGF治疗组20只,GFP空载对照组20只。脑出血组、NGF治疗组和GFP空载对照组按Rosenberg等[11]的方法制备大鼠脑出血模型。空白对照组不接受任何处理,正常饮食;脑出血组建模后正常饮食;NGF治疗组推注移植NGF-UCMSCs细胞悬液至脑出血模型大鼠左侧脑室,推注后继续常规饲养;GFP空载对照组推注GFP空载对照UCMSCs细胞悬液至脑出血模型大鼠左侧脑室,推注后继续常规饲养。
1.2 主要试剂与仪器 Trizol试剂购自Thermo Fisher公司,Titan One Tube RT-PCR Kit试剂盒购自Sigma-aldrich公司,PowerUp SYBR Green试剂盒购自Thermo Fisher公司,ECL试剂盒购自Biovision公司,PVDF膜购自Millipore公司,HRP-羊抗兔IgG、兔抗人NGF多克隆抗体、兔抗β-actin多克隆抗体购自Abcam公司。Bio-Rad CFX96 PCR System荧光定量PCR仪购自Bio-Rad 公司,GE Image scanner III凝胶电泳图像扫描分析仪购自GE 公司,化学发光分析仪购自Thermo 公司。
1.3 大鼠脑出血模型制备 参考Rosenberg等[11]的方法,根据《大鼠脑立体定位图谱》确定尾状核的位置,选择前囟0.1 mm,矢状缝向右3.0 mm,深5.5 mm为注射点。按0.1 mL/100g剂量,以0.3%戊巴比妥腹腔注射麻醉大鼠,固定于脑立体定位仪上。常规消毒头皮正中,切开皮肤,暴露前囟。以骨钻钻孔后,注射Ⅳ型胶原酶2 μL,注射时间5 min以上,留针10 min后缓慢退针。以骨蜡封闭钻孔,局部以碘伏消毒,缝合皮肤。模型制备成功标准[12]:采用Bederson评分标准,0分:未见神经功能缺损;1分:前肢出现任何屈曲成分,不伴其他异常;2分:侧向推力实验阳性,伴前肢屈曲,无转圈行为;3分:同2分行为,伴自发性旋转(提尾悬空实验阳性)。模型制备后6 h,选择评分2分及以上的大鼠作为制备成功模型,排除术后昏迷或死亡大鼠。
1.4 NGF过表达慢病毒载体构建 通过Pubmed检索Human NGF mRNA序列,以pLVX.CMV.eGFP.PGK.PruoR载体,元件顺序为3FLAG-NGF-GFP,将NGF构建至pLVX.CMV.eGFP.PGK/PuroR载体上形成3FLAG-NGF-GFP病毒颗粒[13]。
1.5 UCMSCs分离培养及鉴定 取大鼠的脐带组织,PBS清洗并剪碎后采用组织分离器搅拌3次,300 g离心15 min,弃上清。PBS洗涤3次,加DMEN/F12培养液,37℃ 5%CO2培养箱中培养并传代。收集第3代细胞,采用流式细胞仪检测细胞表面分子的表达,CD34、CD45阴性,CD14阴性,CD73阳性,CD19阴性,CD105阳性,CD90阳性为大鼠脐带间充质干细胞。
1.6 慢病毒转染 鉴定后的细胞传代扩增,5.0×105/mL的细胞悬液接种于6孔板中,加入MOI值为10的病毒液+8 ng/mL Polybrene,转染组携带NGF,对照组仅携带GFP,培养6 h后换液,继续培养72 h,收集细胞备用。
1.7 荧光定量PCR 以Trizol法提取细胞总RNA,以1 μg RNA进行逆转录反应。以逆转录cDNA 2 μL为模板,10 μmol/L引物1 μL,2×SYBR Green Master Mix,ddH2O 7 μL,95℃ 5 s,60℃ 30 s,40个循环,进行PCR扩增。以β-actin为内参,比较2-△△Ct值。
1.8 蛋白免疫印迹 1.0×106个细胞加400 μL混有蛋白酶抑制剂的去污剂裂解液,冰上裂解30 min后,4℃ 12 000 g 离心5 min,取上清。以BCA法蛋白定量后行聚丙烯酰胺凝胶电泳,然后将蛋白转移至PVDF膜上。5%BSA封闭PVDF膜2 h,洗涤后滴加兔抗NGF溶液(1∶1 000),4℃过夜孵育。TBST洗涤去除多余一抗后,与HRP标记的二抗(1∶5 000)室温孵育2 h。TBST清洗后加入ECL化学发光底物,显影拍照。以Quantity One软件对蛋白条带光密度进行检测,NGF与β-actin条带光密度比值为NGF相对表达量。
1.9 细胞移植 大鼠造模成功后6 h,NGF治疗组在无菌条件下,以1 μL/min的速度缓慢推注2 μL NGF-UCMSCs细胞悬液至大鼠左侧脑室;GFP空载对照组推注GFP空载对照细胞悬液,推注后继续常规饲养动物。
1.10 Brdu免疫荧光检测 大鼠断头取脑后以多聚甲醛固定脑组织。脑组织经梯度蔗糖脱水后,冰冻冠状切片。采用漂片法进行免疫荧光染色,取各组相同编号的厚10 μm的脑片置于4%多聚甲醛的24孔板中固定30 min,含0.3% Triton X-100的PBS洗涤3次。依次放入4℃ 2 mol/L HCl中10 min,室温2 mol/L HCl中10 min,37℃ 2 mol/L HCl中20 min裂解DNA。抗原修复后,以PBS洗涤3次。加山羊血清封闭1 h。Brdu标记脑出血的NGF-UCMSCs 细胞。再孵育小鼠抗大鼠Brdu单克隆抗体,4℃过夜。次日以PBS洗涤3次,常温下避光孵育山羊抗小鼠-488抗体2 h。避光下,PBS洗涤3次,贴片后避光晾干,防荧光淬灭剂封片,暗室下荧光显微镜观察并拍照。
1.11 观察指标 ①采用改良神经功能损伤评分(modified neurological severity score, mNSS)[14]评估神经行为情况,包括平衡木实验、行走测试、反常运动、感觉测试、反射缺失、提尾反射等。0分为无受损,1~6分为轻型受损,7~12分为中型受损,13~18分为重型受损。②出血灶周围脑组织水含量:以10%水合氯醛注入大鼠腹腔内行局部麻醉,剪心脏放血法处死后,断头取出血灶周围脑组织;采用干湿比重法测定出血灶周围脑组织水含量。③血肿体积:采用图像分析管理系统计算血肿体积,血肿体积=切面出血面积总和×切面厚度。
1.12 统计学分析 采用SPSS22.0统计学软件,计量资料比较采用t检验,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 转染后UCMSCs细胞的NGF表达情况 转染后UCMSc细胞NGF mRNA和蛋白水平均高于GFP对照组,差异均有统计学意义(P<0.05),见图1。
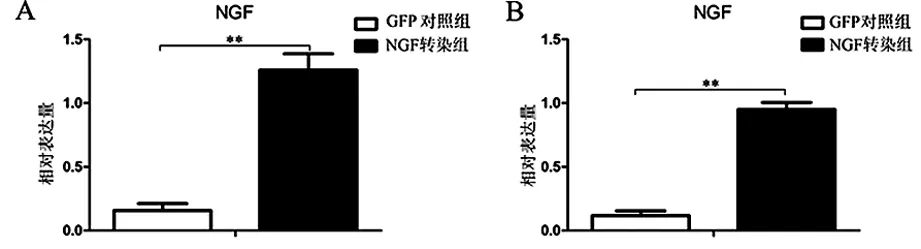
A: 荧光定量PCR; B:蛋白免疫印迹;**P<0.01。图1 转染后UCMSCs细胞的NGF表达情况
2.2 大鼠脑组织细胞移植情况 NGF治疗组移植后,荧光显微镜下大鼠脑组织出血灶周围可见绿色荧光,见图2。

A: NGF治疗组移植后1 d;B:NGF治疗组移植后3 d;C:NGF治疗组移植后7 d;D:NGF治疗组移植后14 d;E: GFP空载对照组移植后1 d; F: GFP空载对照组移植后3 d; G: GFP空载对照组移植后7 d; H: GFP空载对照组移植后14 d。图2 大鼠脑组织出血灶周围Brdu免疫荧光图(×200)
2.3 大鼠神经功能评分 NGF治疗组移植后1 d、3 d、7 d、14 d mNSS评分均低于脑出血组、GFP空载对照组,差异均有统计学意义(P<0.05),见表1。
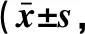
表1 细胞移植后大鼠改良神经功能损伤(mNSS)评分分)
注:与NGF治疗组比较,*P<0.05。
2.4 出血灶周围脑组织水含量 与空白对照组相比,移植后第2周脑出血组、NGF治疗组和GFP空载对照组出血灶周围脑组织水含量均增加,差异均有统计学意义(P<0.05);与空白对照组相比,移植后第4周各组大鼠出血灶周围脑组织水含量差异均无统计学意义(P>0.05);与脑出血组比较,NGF治疗组移植后第1周和第2周的脑组织含水量均低于脑出血组,差异均有统计学意义(P<0.05)。见表2。
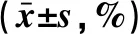
表2 大鼠出血灶周围脑组织水含量
注:与空白对照组比较,*P<0.05;与脑出血组比较,#P<0.05。
2.5 出血灶周围脑组织血肿体积 与空白对照组相比,移植后第1周、第2周和第4周脑出血组、NGF治疗组和GFP空载对照组出血灶周围脑组织血肿体积均增加,差异均有统计学意义(P<0.05);与脑出血组比较,NGF治疗组移植后第1周、第2周和第4周的脑组织血肿体积均低于脑出血组,差异均有统计学意义(P<0.05)。见表3。
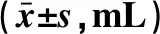
表3 大鼠出血灶周围脑组织血肿体积
注:与空白对照组比较,*P<0.05;与脑出血组比较,#P<0.05。
3 讨论
间充质干细胞(MSCs)是来源于中胚层的非造血干细胞,在一定条件及微环境下,可跨胚层分化为多种细胞,使不可再生细胞的再生成为可能。研究表明[14],脐带血中也含丰富的MSCs,可向3个胚层来源的细胞分化。同时,UCMSCs具有来源丰富、取材方便,增殖能力强等优点。神经生长因子(nerve growth factor,NGF)可提高神经元的培养存活率,对脑出血的神经元变性、坏死具有保护和修复作用[15]。
有研究发现[16],转染NGF基因后的间充质干细胞会出现神经元样的形态变化及相关蛋白表达,提示NGF可诱导间充质干细胞向神经干细胞分化。多项研究证实[17-18],MSCs移植后可在体内存活并聚集于损伤区域周围,分化表达神经细胞标志物,促进宿主神经细胞的存活和再生。Mu等[19]采用BDNF腺病毒载体转染MSCs,移植入大鼠大脑动脉7~14 d后,其神经功能恢复效果和梗死范围均优于未移植MSCs的对照组。本研究采用慢病毒转染UCMSCs细胞过表达NGF基因,以荧光定量PCR及蛋白免疫印迹观察转染效率。将NGF过表达的UCMSCs移植入大鼠脑出血区域周围,结果显示,NGF治疗组移植后1 d、3 d、7 d、14 d mNSS评分均明显低于脑出血组、GFP空载对照组,提示可能原因:①移植细胞及分化的神经样细胞可发挥神经细胞间的网络连接作用,与神经细胞建立传入、传出联系。②移植细胞可分泌细胞因子,如白细胞介素、集落刺激因子、干细胞因子等,发挥调节神经细胞代谢,减轻细胞凋亡,促进轴突再生及神经干细胞增殖、分化,启动内源性修复,促进微血管形成,改善神经功能[20-21]。本研究结果同时显示,与脑出血组比较,NGF治疗组移植后第1周和第2周的脑组织含水量和血肿体积均明显低于脑出血组。以Brdu荧光单标观察NGF过表达的UCMSCs细胞的迁移情况,结果显示,各时间点均可见绿色荧光标记的NGF过表达的UCMSCs细胞,提示UCMSCs可迁移至脑出血灶周围存活,促进神经功能恢复,减少血肿量。
综上所述,NGF过表达脐带间充质干细胞治疗大鼠脑出血可改善大鼠神经功能,减少脑组织含水量及血肿体积。
