骶神经电刺激对急性脊髓损伤大鼠肠黏膜免疫屏障功能的影响*
2020-03-15白春宏张文丽户士忠
白春宏, 张文丽, 户士忠
(1. 武警特色医学中心骨科, 天津 300162; 2. 华北理工大学综合测试分析中心, 唐山 063000; 3. 武警天津总队第一支队卫生处, 天津 300222)
急性完全性脊髓损伤( spinal cord injury,SCI)患者肠道功能障碍严重影响患者身心健康,尤其肠道细菌移位和内毒素血症的出现会导致脓毒血症、败血症、全身炎症反应综合征,甚至出现多器官功能衰竭乃至死亡。Bai 等通过电刺激兔骶3 神经根发现,该电刺激可以改善兔子的肠道症状,减轻菌群移位、内毒素血症[1]。完整的肠道屏障功能主要包括机械屏障、化学屏障、免疫屏障和生物屏障,其中免疫屏障功能平时维持肠内、外微生物平衡,对抵抗细菌移位和内毒素血症,以及它们所造成的继发损伤起到关键作用[2]。有关骶神经刺激( sacral nerve stimulation,SNS) 对SCI 肠道免疫屏障功能的具体保护作用仍未被阐明。所以本实验旨在初步探讨SNS 对SCI 大鼠肠道免疫屏障功能的保护作用,为其在临床上的应用提供理论依据。
1 材料与方法
1.1 截瘫模型建立和电刺激实施
大鼠麻醉后定位T6棘突,刮毛、消毒。手术暴露脊髓,Fehlings法98 g动脉瘤夹横行钳夹约l min,以双下肢抽搐停止,运动、感觉诱发电位评价完全离断情况。定位右侧骶3神经孔,脱毛、消毒,置人电极,电刺激尾部肌肉收缩确定植入效果,SCI 2 h后电刺激,参数为:电压4 V,波宽210 μs,频率15 Hz,刺激10 s,间歇20 s。每次持续10 min,间歇10 min,共2 h。早8:00-10:00,晚6:00-8:00两次(前期实验确认)。
1.2 实验分组及标本采集
按随机数字表法分为正常组(Sham group,SG=8只)、脊髓损伤组(Control group,CG=24只)和骶神经电刺激组(Experimental group,EG=24只)。CG(24、48和72 h,8只/组)和EG (24、48和72 h,8只/组)。
1.3 肠粘膜形态学观察
消毒后剖腹,取小肠组织(距离盲肠约10 cm),常规处理后分别进行光镜和透射电镜观察。
1.4 Western blot检测小肠组织中锌指蛋白A20、NOD2和CD68蛋白表达量
Anti-锌指蛋白A20、Anti-NOD2抗体购自美国Sigma公司, Anti-CD68抗体、Goat polyclonal secondary antibody to rabbit IgG购自英国Abcam 公司,以β-actin 为内参。用 image J 图像分析软件,根据光密度定量分析。
1.5 统计学处理
应用SPSS 13.0统计软件,两组间比较采用t检验,三组间比较采用方差分析。
2 结果
2.1 肠道形态学观察
2.1.1 光镜 SG小肠黏膜完整、形态正常;CG黏膜形态破坏随时间逐渐加重,24 h发现(Peyer patch,PP)滤泡相关上皮破坏,使肠腔和上皮下穹隆贯通;72 h黏膜下水肿、淤血,大量炎性细胞浸润,肠绒毛破坏,上皮细胞坏死,大量渗出。EG黏膜形态也有不同程度破坏,72 h黏膜下血管轻度充血,少量渗出物,少量炎性细胞浸润(图1)。
2.1.2 电镜 SG细胞间紧密连接、中间连接和桥粒正常,小肠微绒毛排列整齐;CG黏膜上皮出现不同程度细胞水肿,细胞间隙增宽。72 h黏膜上皮细胞水肿严重,部分细胞坏死,细胞间隙明显增宽,微绒毛水肿、折断并脱落。部分肠黏膜上皮细胞崩解破裂,细胞外细菌和杂质进入肠黏膜上皮细胞;细胞外细菌和杂质穿经M细胞并同时沿细胞轴经细胞旁紧密连接处进入黏膜下组织;细菌进入血管,和红细胞共同在微血管内循环。EG上述损伤较轻,72 h黏膜上皮细胞水肿,细胞间隙略增宽,微绒毛变疏松(图2,3)。
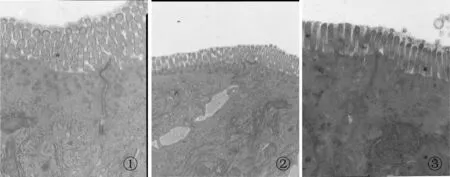
Fig. 2 Intestinal morphology under transmission electron microscope in each group
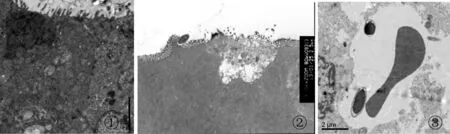
Fig. 3 Electron microscopic observation of bacteria and impurities penetrating the intestinal mucosal barrier
2.2 肠组织锌指蛋白A20、NOD2和CD68表达
锌指蛋白A20:与SG相比,CG各小组A20表达均明显降低(P<0.01);与SG、CG相比,EG各小组A20的表达均明显升高(P<0.01)。A20作为机体内炎症反应调控的内源性蛋白,其表达量增加,提示机体内源性抗炎保护作用得到增强。本实验CG组减少,提示SCI小肠缺少锌指蛋白A20保护,SNS后明显增加,说明SNS可刺激锌指蛋白A20产生,减少肠黏膜炎症反应、氧化反应并提供内源性保护。
NOD2:与SG比,CG各组NOD2的表达均明显升高(24 h、72 hP<0.05;48 hP<0.01);与CG比,EG 48 h、72 h NOD2的表达均明显降低( 48 hP< 0.01,72 hP<0.05);与SG相比,EG各组NOD2表达均无统计学意义。NOD2蛋白作为一种细胞内膜识别受体,可通过其下游靶基因表达产物发挥病原防御、抗炎作用。其表达量增加,提示机体有抗原入侵,发生炎症反应;SNS后NOD2表达下降接近SG水平,证明炎症反应减轻。
CD68:与SG、EG比,CG各组CD68的表达均明显升高(P<0.01);与SG相比,EG 24 h、48 h组NOD2表达明显升高(P<0.01),72 h组无统计学意义。CD68蛋白作为一种巨噬细胞标记性分子,其表达量增加,提示巨噬细胞数量增加并活跃,机体发生炎症反应;SNS后炎症反应减轻(图4,表1)。
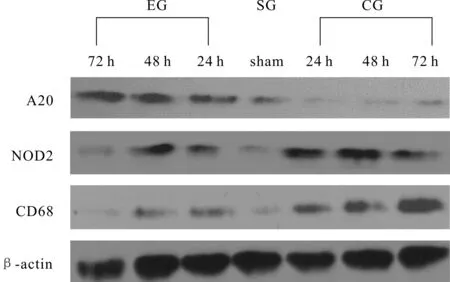
Fig. 4 The expressions of A20, NOD2, and CD68 in small intestine of EG, SG and CG
Tab. 1 The expression levels of A20, NOD2, and CD68 in small intestine
3 讨论
肠道免疫系统主要由肠黏膜上皮的免疫相关组织(如PP、肠系膜淋巴结)、细胞(如树突细胞、巨噬细胞、T细胞及B细胞等)和分子(抗菌肽、免疫球蛋白、融酶等)组成,构成免疫屏障,及时识别外来微生物抗原、食物抗原以及自身异常抗原,诱导出局部及全身免疫应答反应,维持肠道动态平衡[3]。小肠黏膜免疫屏障包括黏膜层及黏膜下固有层内的局部淋巴细胞,构成黏膜相关淋巴组织,结构上分为免疫诱导部分和免疫效应部分。比如位于黏膜诱导部位的M细胞[4]摄取抗原,呈递给巨噬细胞、B细胞、树突细胞和肥大细胞[5],这些细胞再对抗原进行加工处理;或由上皮细胞呈递给B细胞和T细胞。树突状细胞还可以打开肠道上皮的紧密连接直接进入肠腔吞噬病原体,激活黏膜免疫系统的幼稚T细胞。淋巴细胞和抗原发生作用后,呈递抗原给肠道淋巴结,再进入全身循环,然后再回到肠道,称之为归巢。免疫屏障功能的状态关乎肠道局部和全身炎症反应的程度,也是本次研究的重点。
完整的肠上皮细胞选择通透性能够有效阻止细菌及内毒素等有害物质透过肠黏膜组织进入血液。肠上皮细胞间通道是封闭的,这种生理功能是由相邻上皮细胞之间的连接复合体完成的,其中紧密连接起着主要的作用。肠道蠕动是肠道机械屏障的另一重要组成部分[6]。正常肠道菌群构成肠道的非特异性免疫屏障,形成稳态[7]。当肠道细菌数量、种类或者位置发生变化时,肠道的稳态发生破坏,肠道免疫系统就会启动来纠正以维持平衡[8,9]。肠道机械屏障一旦破坏,肠道通透性会增加[10]。肠黏膜上皮的完整性,也是微生物和免疫屏障之间的壁垒[11]。当SCI时,肠道功能紊乱,蠕动减慢,肠管积气、积便,大量细菌繁殖。同时,可直接或间断破坏肠道械屏障,细菌通过肠黏膜上皮细胞和其间的紧密连接组成机械屏障而进入黏膜下组织[12],肠黏膜上皮免疫相关组织就会发挥作用,形成激烈的局部炎症反应。尤其巨噬细胞和树突细胞等在PP上皮穹隆的下面,非常适合监测进入PP的微生物,导致大量的免疫细胞聚集并把细菌带入循环系统。内毒素再次打击肠黏膜形成继发性损伤,免疫屏障功能从而也遭到破坏,进而形成恶性循环。本实验发现脊髓损伤后肠道黏膜开始出现黏膜下血管充血,炎性细胞浸润,黏膜上皮细胞轻度水肿,细胞间隙略增宽。24 h发现PP滤泡相关上皮破坏,使肠腔和上皮下穹隆贯通;后期甚至出现肠绒毛破坏,上皮细胞坏死,大量渗出。电镜观察发现CG72 h组黏膜上皮细胞水肿严重,部分细胞坏死,细胞间隙明显增宽,微绒毛水肿、折断并脱落。严重区域有细胞崩解破裂,细胞外细菌和杂质进入肠黏膜上皮细胞;细胞外细菌和杂质穿经M细胞并同时沿细胞轴经细胞旁紧密连接处进入黏膜下组织;细菌进入血管,和红细胞共同在微血管内循环。而EG组虽然也有不同程度损伤,但较对照组明显减轻。
巨噬细胞在维持肠黏膜免疫平衡过程中起着关键作用[13]。巨噬细胞标记性分子CD68可用于检测巨噬细胞的分布规律和数量[14]。CD68可激活体内炎症信号转导途径,造成NF-KB等活化,启动多种炎症细胞因子基因(如IL-1b, TNF, IL-12, and IL-23等)的转录和翻译过程,加强体内炎症反应[15]。本实现发现:与SG、EG比,CG各组CD68的表达均明显升高(P<0.01);与SG相比,EG24h、48h组NOD2表达明显升高(P<0.01),72 h组无统计学意义。提示巨噬细胞数量增多,比较活跃,黏膜局部发生明显的炎症反应[16]。EG各组CD68的表达均减少,到72 h组减少到和SG组无统计学差异,证明SNS后,黏膜下炎症反应减轻。
锌指蛋白A20是炎症时NF-KB活化介导并自体合成的一种强有效抑制NF-KB的炎症反应特异性调控蛋白[17],降低炎症介质(TNF-α、IL-β等) 释放,调节机体炎症反应和凋亡抑制,通过抗炎症反应和抗氧化反应,维持机体免疫能力以达到机能平衡[18];同时调整多核细胞、巨噬细胞、自然杀伤细胞以提高内在免疫功能[19]。创伤感染的早期A20表达增加是机体重要的内源性抗炎保护效应机制。本实验发现:与SG相比,CG各小组A20表达均明显降低(P<0.01);与SG、CG相比,EG各小组A20的表达均明显升高(P<0.01)。A20作为机体内炎症反应调控的内源性蛋白,其表达量增加,提示机体内源性抗炎保护作用得到增强。本实验CG组减少,提示SCI小肠缺少锌指蛋白A20保护,SNS后明显增加,说明SNS可刺激锌指蛋白A20产生,减少肠黏膜炎症反应、氧化反应并提供内源性保护。
NOD2是凋亡调节因子,NOD2突变,改变了NF-κB的信号反应,导致慢性炎症的发生。NOD2蛋白是一种细胞内模式识别受体,可识别细菌细胞壁的肽聚糖及其裂解产物胞壁酰二肽,广泛参与宿主对病原体的免疫应答,是联系天然免疫与特异性免疫的重要桥梁。NOD2在肠道上皮细胞中的表达较低,可能是机体对肠道正常微生物的一种保护机制[20]。外源微生物入侵时,机体可能通过其它模式识别受体激活NF-κB,上调NOD2的表达,启动其介导的信号通路。正常情况下,NOD2可通过其下游靶基因表达产物发挥病原防御、抗炎作用。如NOD2的下游靶目标黏膜免疫排斥因子DMBT1,可防止细菌侵入小肠上皮细胞。NOD2也可通过调控肠道Paneth细胞释放防御素和抗菌肽来维持肠道黏膜正常的屏障功能[21],或者与CD147形成CD147-NOD2复合物降低CD147的活性,因为CD147高表达会促进李斯特菌侵入上皮细胞。NOD2基因突变或功能缺陷导致肠道对病原体容忍度增加[22],因此,肠道免疫屏障受损。可能是由于抗菌肽表达量减少、防御素表达缺乏调节、肠黏膜渗透性增加等原因,使得肠道杀菌能力减弱、细菌易于侵入上皮细胞。本实现发现:与SG比,CG各组NOD2的表达均升高(24 h、72 hP<0.05;48 hP< 0.01);与CG比,EG48 h、72 h NOD2的表达均降低(48 hP<0.01,72 hP<0.05);与SG相比,EG各组NOD2表达均无统计学意义。NOD2蛋白作为一种细胞内膜识别受体,可通过其下游靶基因表达产物发挥病原防御、抗炎作用。其表达量增加,提示机体有抗原入侵,发生炎症反应;SNS后NOD2表达下降接近SG水平,证明炎症反应减轻。
总之,SNS能较好促进肠道蠕动,保护肠黏膜机械屏障,减少病原体入侵,减轻炎症反应并加强内源性保护,改善肠黏膜免疫屏障功能。为改善肠道功能,预防截瘫后内毒素血症和肠道菌群移位感染的发生提供了一种有效的选择。
