云南热区咖啡种植地红壤细菌群落多样性分析
2020-03-15樊帆李正涛李世钰山云辉黄家雄吕玉兰何飞飞秦世雯
樊帆, 李正涛, 李世钰,2, 山云辉, 黄家雄,吕玉兰, 何飞飞, 秦世雯*
(1.云南大学农学院, 昆明 650550; 2.云南省瑞丽市农场管理委员会, 云南 瑞丽 678600; 3.德宏后谷咖啡有限公司, 云南 德宏 678400; 4.云南省农业科学研究院热带亚热带经济作物研究所, 云南 保山 678000)
咖啡是全球主要饮料作物之一,具有重要的商业价值。云南热区具有咖啡种植的最佳海拔高度和气候条件,种植面积和产量均占全国咖啡的98%以上[1]。目前,云南咖啡产区主要集中在云南保山、德宏、临沧、普洱等地[2]。随着云南咖啡产业的快速发展,提高咖啡品质、解决栽培技术落后和加工滞后等问题对发展云南高原特色农业具有重要意义。
咖啡优良品质的形成与咖啡的生产量、施肥、耕作方式和自然环境的动态平衡息息相关[3-4]。土壤微生物是指示种植生态系统的重要指标,在种植土壤发育、有机质转化、生态系统平衡、土壤环境净化、生物修复等方面起着不可替代的作用,并且土壤微生物对植物生长和抗逆性具有促进作用。细菌是土壤微生物中数量最大的一个类群,可决定土壤微生物总量的分布、有机物的分解和养分的转化[5-7]。如落叶松人工防护林土壤微生物中细菌数量直接影响土壤微生物总量的变化趋势[8];镉耐性促生细菌明显改善了镉污染土壤微生物环境,促进植物生长[9]。并且土壤中微生物生物量一定程度上代表该生态系统物质循环能力和支持植被生长发育的能力[10]。然而云南咖啡热区土壤研究主要集中在肥力评价,对土壤微生物的研究还较少[11-13]。
本研究以云南咖啡主产区保山市潞江坝(干热区)和德宏芒市(湿热区)不同年限的咖啡种植地红壤为研究对象,采用高通量测序技术分析其细菌群落结构、细菌种群丰度和多样性的变化,深入了解云南咖啡种植地红壤的细菌生态环境,为维持云南热区咖啡土壤质量和健康、培育优质的咖啡提供参考信息。
1 材料与方法
1.1 研究区域概况
云南热区是热带北缘与南亚热带地区的统称,热量条件≥10 ℃年积温6 000 ℃上,年平均气温>18 ℃,最冷月平均气温>10 ℃,年降雨量600~2 700 mm,干湿季分明,5—10月为雨季,降雨量占全年的86%,11月至翌年4月为干季,降雨量仅占全年的14%,年日可照时数1 750~2 250 h。云南热区总面积8.1万 km2左右,占云南省土地总面积的21%,主要分布在澜沧江、金沙江、怒江、红河、南盘江以及伊洛瓦底江的支流大盈江、龙江流域海拔1 400 m以下的低热河谷。热区是云南自然地理系统的低热层,是云南巨大的山地系统的组成部分。热区湿润-半湿润区的土壤类型主要是砖红壤和赤红壤,半干旱区的土壤类型主要是燥红壤和褐红壤,pH范围为4.1~6.5。
本研究区域位于云南咖啡主产地保山市潞江坝和德宏景颇族自治州芒市。德宏芒市属于湿润-半湿润区,保山潞江坝属于半干旱区。总的气候特点为光热充足,水分缺乏,干湿分明,太阳辐射较强。
1.2 样品采集
供试土壤采自云南省保山市隆阳区潞江坝和德宏傣族景颇族自治州芒市不同种植年限咖啡园。2017年咖啡采摘结束后,按S形取样法取10个点作为1个混合样,每块样地重复采集3次,采集深度0~20 cm耕层土壤。土样磨细过2 mm筛后,保存于-80 ℃备用。供试土壤基本情况见表1。

表1 云南咖啡种植红壤样品基本情况Table 1 Summary of the red soil samples in coffee-growing regions of tropical Yunnan
1.3 土壤微生物总DNA提取
采用磁珠法土壤微生物基因组DNA提取试剂盒(天根生化科技有限公司)提取样本的微生物基因组DNA。利用1%琼脂糖凝胶电泳和微量紫外分光光度计(Nanodrop 8 000, USA)检测DNA的纯度和浓度。随后取适量的DNA样品稀释至1 ng·μL-1。
1.4 PCR扩增及测序
利用引物515F/806R扩增细菌16S rDNA基因的V4区域[14]。PCR反应体系30 μL:2×Phusion Master Mix 15 μL,引物3 μL, gDNA 10 μL(5~10 ng),H2O 2 μL。PCR反应程序:98 ℃预变性1 min;98 ℃ 10 s,50 ℃ 30 s,72 ℃ 30 s,循环30次;72 ℃延伸5 min。PCR产物质量和浓度通过2%琼脂糖凝胶电泳和微量紫外分光光度计进行检测。随后PCR产物等质量混样,充分混匀后利用2%的琼脂糖胶电泳和GeneJET胶回收试剂盒(Thermo Scientific,USA)进行纯化回收。最后,样品送至北京诺禾致源科技股份有限公司进行土壤微生物高通量测序(基于IonS5TMXL测序平台)。
1.5 数据处理
利用Cutadapt(V1.9.1)[15]对reads进行低质量部分剪切和初步质控得到原始数据(raw reads),去除嵌合体[16-17]后最终获得Clean reads。利用Uparse 软件(v7.0.1001)[18]对所有样品的全部 Clean reads 进行聚类,默认以97%的一致性(identity)将序列聚类成为OTUs(operational taxonomic units)。对OTUs代表序列进行物种注释和分类学信息,并分别在各分类水平(界、门、纲、目、科、属、种)统计各土样细菌群落组成[19-20]。对各土样数据进行均一化处理,最后进行α多样性和β多样性分析。α多样性指数组间差异分析和β多样性指数组间差异分析分别进行Tukey检验和wilcox检验。
2 结果与分析
2.1 测序质量分析
云南省保山市潞江坝和德宏州芒市不同咖啡种植年限的红壤细菌16S rDNA扩增子测序结果如表2所示,五个咖啡种植土样Clean reads数平均为80 167,Clean reads的平均长度为252 bp,90%以上的碱基质量达到Q20水平,表明测序质量良好。
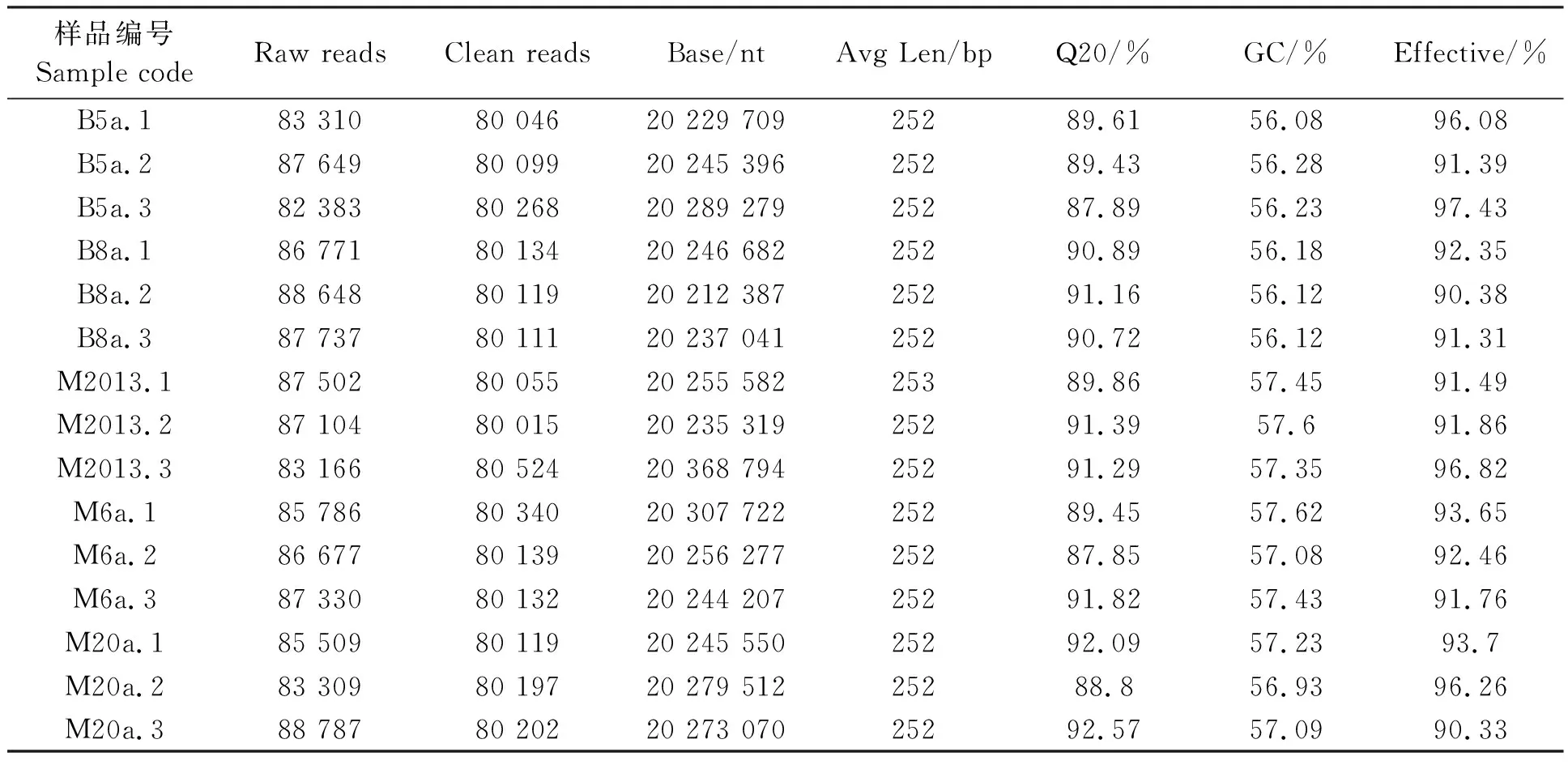
表2 云南热区咖啡种植地红壤细菌16S rDNA扩增子测序结果 Table 2 Sequencing quality of 16S rDNA of red soil samples in coffee-growing regions of tropical Yunnan
2.2 细菌群落组成和结构分析
2.2.1不同咖啡种植区域红壤细菌群落结构特征 为研究云南热区咖啡种植地红壤细菌群落的多样性,对所有样品的Clean reads进行聚类和注释,五个咖啡种植地红壤细菌在界、门、纲、目、科、属、种分类水平下OTUs数目如表3所示。细菌分类学分析结果表明,五个咖啡种植地土样中共检测出细菌39门、109纲、145目、276科、458属。所有土样中优势细菌门(相对丰度>1%)为:变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、疣微菌门(Verrucomicrobia)和厚壁菌门(Firmicutes)(表4)。

表3 云南热区咖啡种植地红壤细菌在各分类水平下的OTUs数目Table 3 Number of OTUs of red soil samples in coffee-growing regions of tropical Yunnan at the different classification levels
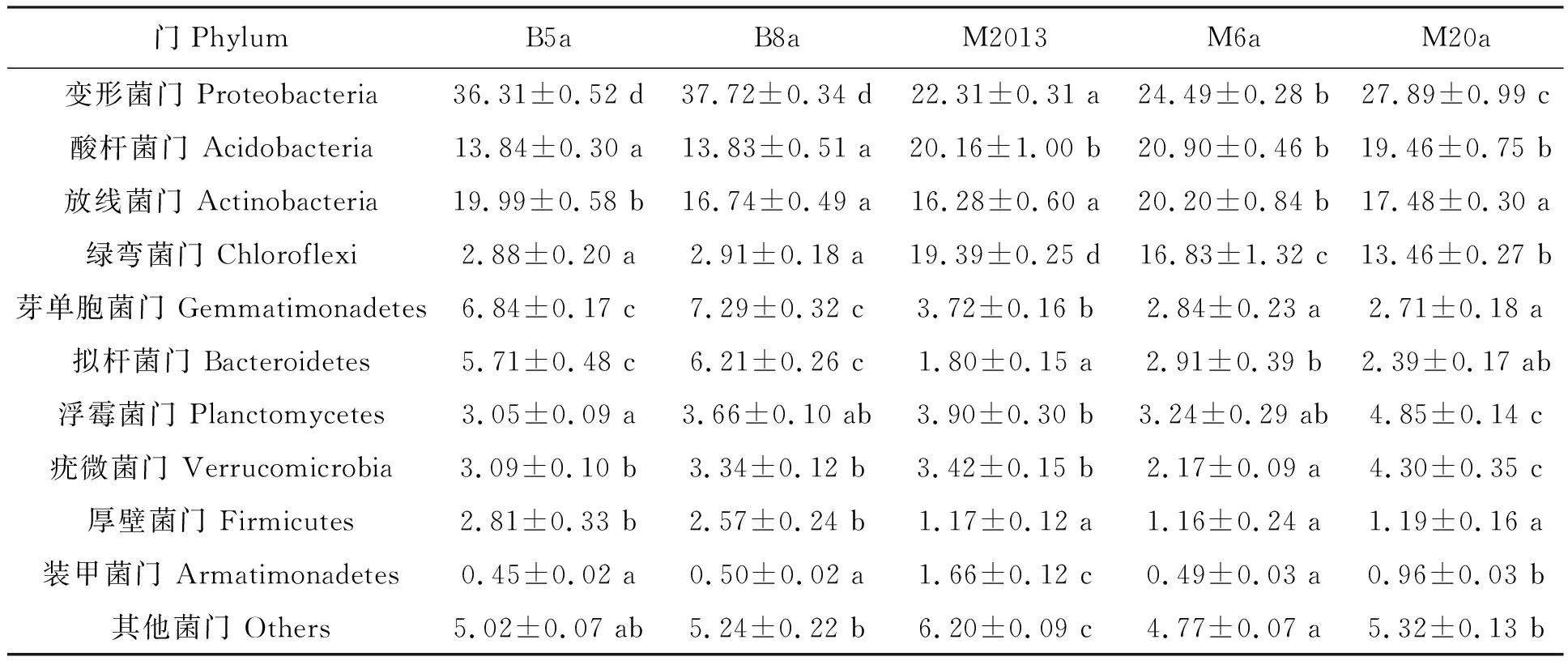
表4 云南热区咖啡种植地红壤细菌群落相对丰度前10菌门的相对丰度Table 4 Relative abundance of the top 10 phylum of red soil bacterial community in coffee-growing regions of tropical Yunnan
另外,5个咖啡种植地土样的相对丰度前35的菌属中均存在氨氧化微生物(Ammonia-oxidizingarchaea, AOA)Group I.1 a-associated(CandidatusNitrosotalea),并且在潞江坝地区丰度较高(0.43%~0.67%),说明氨氧化古菌(AOA)可能是云南热区咖啡种植地红壤的主要氨氧化微生物(图1)。
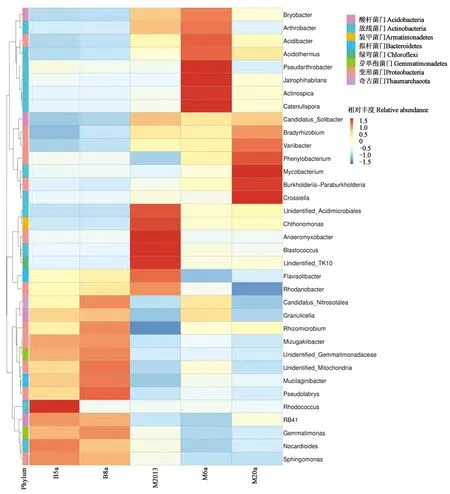
注:不同颜色块代表相对物种丰度值,由蓝到红,相对丰度逐渐升高,只显示丰度最高的前35个属。Note:Different color represents the relative species abundance value, and the relative abundance gradually increases from blue to red. Only top 35 genera with the highest abundance are shown.图1 云南热区咖啡种植地红壤在属水平上的细菌群落的物种丰度聚类Fig.1 Clustering of bacterial community structures of red soil samples in coffee-growing regions of tropical Yunnan at level of genus
潞江坝与芒市咖啡种植区红壤细菌在群落组成和丰度上均存在明显差异(图1和表4)。相对于芒市,潞江坝咖啡种植土样中的变形菌门(潞江坝平均为37.02%,芒市平均为24.90%)、芽单胞菌门(潞江坝平均为7.06%,芒市为3.09%)、拟杆菌门(潞江坝平均为5.96%,芒市平均为2.37%),以及厚壁菌门(潞江坝平均为2.69%,芒市平均为1.17%)相对丰度显著较高,而酸杆菌门(潞江坝平均为13.83%,芒市平均为20.17%)、绿弯菌门(潞江坝平均为2.90%,芒市平均为16.56%)和装甲菌门(潞江坝平均为0.47%,芒市平均为1.03%)相对丰度显著较低(表4)。
另外,潞江坝与芒市咖啡种植地红壤细菌优势属(相对丰度>1%)也明显不同。B5a细菌优势属共9个,分别为Mizugakiibacter(8.54%)、Rhizomicrobium(2.34%)、Gemmatimonas(2.7%)、Rhodococcus(1.89%)、Bryobacter(1.67%)、RB41(1.40%)、Nocardioides(1.00%)、Sphingomonas(3.32%)、unidentified_Mitochondria(1.11%);B8a细菌优势属共8个,分别为Mizugakiibacter(8.97%)、Rhizomicrobium(3.12%)、Gemmatimonas(3.01%)、Bryobacter(1.71%)、RB41(1.30%)、Sphingomonas(2.94%)、unidentified_Mitochondria(1.51%)、Granulicella(1.07%)。而M2013细菌优势属共11个,分别为Blastococcus(1.12%)、unidentified_TK10(2.25%)、Gemmatimonas(1.33%)、Rhodanobacter(1.14%)、Bryobacter(2.86%)、Bradyrhizobium(1.78%)、Arthrobacter(1.32%)、CandidatusSolibacter(2.37%)、Sphingomonas(1.26%)、Acidothermus(1.75%)、Anaeromyxobacter(1.24%);M6a细菌优势属共11个,分别为Mizugakiibacter(1.73%)、Rhizomicrobium(1.80%)、Actinospica(1.04%)、Bryobacter(3.18%)、Bradyrhizobium(1.73%)、BurkholderiaParaburkholderia(1.11%)、Arthrobacter(1.70%)、CandidatusSolibacter(2.13%)、Pseudarthrobacter(1.07%)、Acidibacter(1.33%)、Acidothermus(4.63%);M6a细菌优势属共8个,分别为Rhizomicrobium(2.01%)、Bryobacter(2.21%)、Bradyrhizobium(2.20%)、BurkholderiaParaburkholderia(2.56%)、CandidatusSolibacter(2.31%)、Crossiella(1.01%)、Acidothermus(2.95%)、Variibacter(1.24%)。
2.2.2不同咖啡种植年限红壤细菌群落结构特征 随咖啡种植年限增加,潞江坝咖啡种植地土样中放线菌门的相对丰度减少了3.25%;芒市咖啡种植地土样中变形菌门的相对丰度提高了5.58%,而绿弯菌门和芽单胞菌门的相对丰度分别减少了5.94%和1.01%;另外,放线菌门(20.20%)的相对丰度在M6a土样中丰度最高,而浮霉菌门(4.85%)和疣微菌门(4.30%)在M20a样品中丰度最高(表4)。
2.2.3云南热区咖啡种植地红壤细菌群落结构的主成分分析 为了解潞江坝和芒市不同咖啡种植年限的红壤细菌群落结构差异,对其进行了基于OUT水平的主成分分析(PCA),提取出最大程度反映样品间差异的两个主成分,贡献率分别为28.34%和15.96%。潞江坝和芒市的不同土样围绕PC1轴分开,潞江坝B5a和B8a分布在PC1的负轴,芒市M2013、M6a和M20a分布在PC1的正轴,说明云南干热区和湿热区的咖啡种植地红壤细菌群落结构差异明显(图2)。另外,潞江坝B5a与B8a的细菌群落结构无明显差异,均分布在PC2负轴;而芒市M2013和M6a与M20a的细菌群落结构差异明显,M2013和M6a分布在PC2正轴,而M20a分布在PC2负轴(图2)。
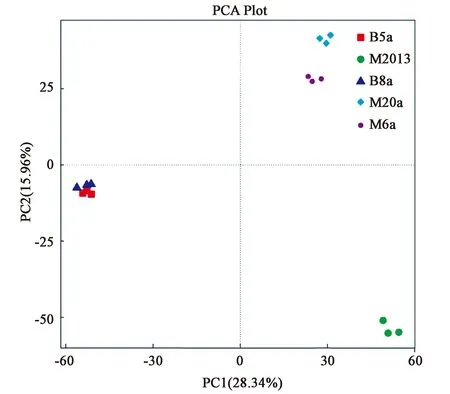
图2 云南热区咖啡种植地红壤细菌群落PCA分析Fig.2 Principal component analysis (PCA) of bacterial community composition of red soil samples in coffee-growing regions of tropical Yunnan
2.3 云南热区咖啡种植地红壤细菌群落的多样性分析
潞江坝B5a和B8a的细菌种类数目、丰富度(chao1和ACE指数)均比芒市M2013和M6a多,但与M20a无显著差异,说明潞江坝咖啡种植8 a后和芒市20 a后红壤细菌种类数目和丰富度无明显差异,且在潞江坝咖啡种植8 a内和芒市咖啡种植6 a内并不能显著提高红壤细菌种类数目和丰富度(表5)。潞江坝B5a与B8a的多样性指数shannon无显著差异,但与M20a差异显著;而芒市红壤细菌多样性指数shannon随着咖啡种植年限的增加而提高(表5)。另外,潞江坝B5a与B8a的多样性指数simpson无显著差异,但与芒市3个咖啡种植地土样差异显著;芒市红壤细菌多样性指数simpson随着咖啡种植年限的增加并无显著提高(表5)。以上结果表明,咖啡种植年限增长对云南热区红壤细菌群落的丰富度和多样性无明显提高。
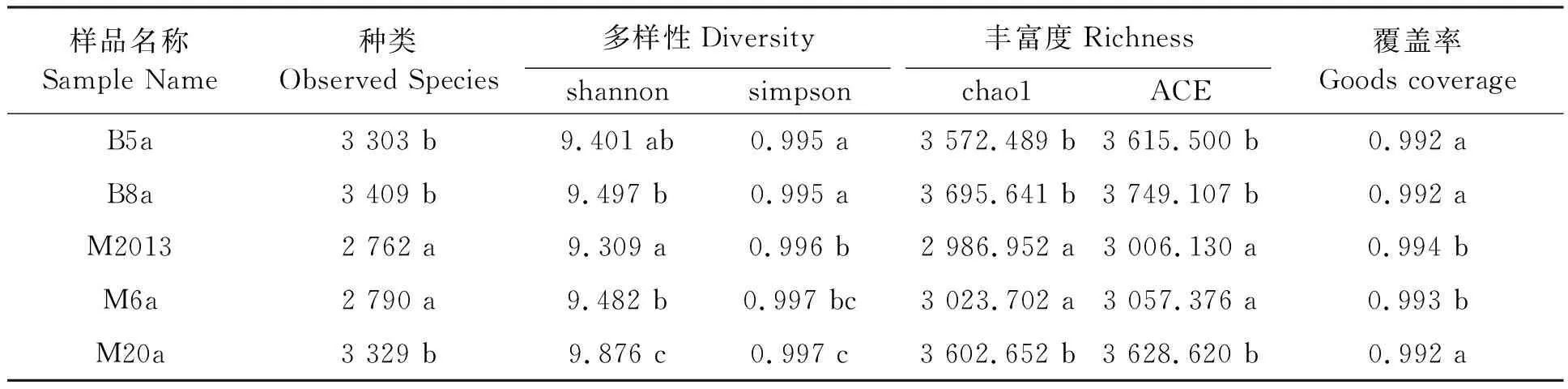
表5 云南热区咖啡种植地红壤细菌群落的α多样性指数Table 5 Bacterial diversity indexes of red soil samples in coffee-growing regions of tropical Yunnan
3 讨论
微生物类群数量是灵敏指示土壤环境质量变化的生物学指标之一,反映了土壤环境生态功能的演变规律[21]。云南保山市潞江坝和德宏芒市是云南主要咖啡种植区,其红壤优势细菌主要为变形菌门、酸杆菌门、放线菌门、绿弯菌门、芽单胞菌门、拟杆菌门、浮霉菌门、疣微菌门和厚壁菌门。本研究结果与稻田红壤和有机农田红壤的根际土壤细菌群落研究结果相似[22-24]。目前研究表明,氨氧化古菌(AOA)倾向于在酸性和低氮的寡营养环境中起作用,而红壤酸性强、有机质含量低、养分匮乏,因此,AOA在红壤细菌中主导氨氧化作用[25-27]。本研究发现,在潞江坝和芒市咖啡种植地红壤中AOA丰度显著高于其他氨氧化细菌,可能是云南热区咖啡种植地红壤的关键氨氧化微生物。另外,2个咖啡种植地的红壤中均发现有利于咖啡生长的优势菌属,如Sphingomonas(降解化学杀虫剂)[28],Blastococcus(抵御不良环境、防治土壤病害)[29],Arthrobacter、Acidothermus、Bryobacter和CandidatusSolibacter(分解有机质,促进土壤碳循环)[30-33]。因此,研究云南热区咖啡种植红壤的细菌类群及其作用,将为保持云南咖啡生态系统平衡,促进云南咖啡产业的可持续发展提供重要参考。
咖啡种植年限低于8 a,保山潞江坝相对于芒市咖啡种植地的红壤细菌种类多,并且细菌丰富度也较高,说明云南干热区相较于湿热区可能更有利于红壤细菌的生长。这可能与不同热区的海拔维度、气候条件、土壤含水量、土壤肥力、咖啡根系生物量、农业管理措施等因素密切相关。土壤微生物的生态系统复杂,并且时刻处于动态平衡的变化过程中,影响云南热区土壤微生物数量变化的主控因子还有待深入研究。
另外,不同咖啡种植年限下云南热区咖啡种植地红壤细菌在群落组成和丰度存在一定差异。随咖啡种植年限增加,潞江坝或芒市咖啡种植地红壤一些细菌优势属发生了变化,并且芒市咖啡种植地的红壤细菌群落组成相对潞江坝变化较大,但2个区域咖啡种植地红壤细菌群落的丰富度和多样性并无明显提高。目前不同种植年限下红壤微生物多样性研究还较少,有的研究发现土壤微生物数量和多样性随着种植年限的增加而增多[34-35],有的研究结果却不同[36-39]。这可能与土壤采样时间、采样深度、采样点肥力差异等有关,特别是与土壤的最高种植年限密切相关。最高种植年限不同,土壤的结构、通气性、水分状况、养分等理化性状均会发生变化,因而对土壤微生物多样性产生了重要影响。
