基于Notch1-RBP-Jk/Msx2信号通路探讨大黄酸对糖尿病肾病主动脉钙化的作用及机制研究
2020-03-14段晓星常永丽张国光潘雪
段晓星 常永丽 张国光 潘雪
010050 呼和浩特,内蒙古医科大学附属医院肾内科
糖尿病肾病是糖尿病常见的并发症,其病情发展过程中可导致主动脉钙化,主动脉钙化不仅会影响血管内皮功能,还会增加心血管并发症的发生风险[1]。目前临床上针对糖尿病肾病主动脉钙化患者主要采用钙模拟剂、磷结合剂、活性维生素D等进行治疗,但是疗效不佳[2]。有研究指出[3],在糖尿病肾病大鼠中给予大黄酸干预不仅肾功能指标能够显著改善,且血钙、血磷水平和钙磷乘积均显著改善,推测该药物能够保护糖尿病肾病患者的肾功能,可用于治疗糖尿病肾病主动脉钙化,但其具体治疗作用及机制仍需进一步研究。另有研究发现,人跨膜受体蛋白Notch-1通路(Notch1-recombining binding protein suppressor of hairless,Notch1-RBP-Jk)/相互作用蛋白Msx2(Msx2-interacting nuclear target protein,Msx2)信号通路是经典的主动脉钙化调控路径[4]。本研究特进行大鼠实验探讨大黄酸对Notch1-RBP-Jk/Msx2信号通路是否具有调控作用以及其对糖尿病肾病主动脉钙化的影响,以期为此类疾病的临床治疗和药物研发提供新的思路。
材料与方法
一、实验材料
40只成年SD大鼠,均购自北京医学实验动物中心(动物合格证号:SCXK(京)2018-012),6~8周龄,雄性,SPF级,体质量180~220 g,平均体质量(196.8±5.1)g。
大黄酸购自广州佳科生物科技有限公司(纯度95%);维生素D3注射液购自浙江仙琚制药股份有限公司;尼古丁购自Merck公司(纯度>95%);24 h尿蛋白比浊法检测试剂盒、血肌酐酶联免疫检测试剂盒、血尿素氮电极法检测试剂盒、二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒、组织钙含量定量检测荧光试剂盒、总核糖核酸(ribonucleic acid,RNA)提取试剂盒、蛋白提取试剂盒均购自上海信帆生物科技有限公司;Von Kossa染料购自美国Sigma公司;一抗、二抗(以辣根酶标记)均购自武汉博士德公司;引物序列由上海生物工程有限公司设计并合成。
AU5800型全自动生化分析仪购自美国贝克曼库尔特有限公司;DSX500型光学显微镜购自日本奥林巴斯公司;DYCP-31A型快速电泳仪购自北京六一仪器厂;SCZX/ABI2720型聚合酶链反应(polymerase chain reaction,PCR)扩增仪购自北京中西远大科技有限公司。
二、方法
1.分组、建模及干预方法 在40只大鼠中随机选取32只建立糖尿病肾病主动脉钙化模型。剩余8只大鼠记为正常对照组,自由饮食和进水。建模方法参照文献[5]给予高脂饲料喂养,持续4周,给予链脲佐菌素(streptozotocin,STZ)溶液(1%)腹腔注射液,剂量为35 mg/kg;2周后24 h尿蛋白>30 g,尿量>原尿量的50%,则视为造模成功;然后自次日早上9时,给予维生素D3肌肉注射,剂量为300 000 U/kg,并给予25 mg/kg、5 mL/kg尼古丁灌胃,当天晚6时再次灌胃。将建模成功的大鼠随机分为模型对照组、低剂量组、中剂量组、高剂量组,后3组分别给予50 mg/kg、100 mg/kg、150 mg/kg剂量的大黄酸灌胃,其中低剂量为临床等效剂量、中剂量为临床等效剂量的2倍,高剂量为临床等效剂量的4倍。模型对照组和正常对照组均给予等量生理盐水灌胃,每天1次,持续4周。
2.观察指标
(1)肾功能指标:分别于干预前后检测各组大鼠的肾功能指标,包括24 h尿蛋白、血肌酐和血尿素氮,利用酶联免疫检测试剂盒、电极法检测试剂盒和全自动生化分析仪进行检测。
(2)腹主动脉钙化特征:处死大鼠,迅速剥离腹主动脉,对主动脉管腔进行彻底冲洗。常规固定,脱水,透明,包埋,切片,染色观察。
(3)腹主动脉组织钙含量:制成腹主动脉匀浆,离心分离,并利用荧光定量检测试剂盒和荧光分光光度计检测腹主动脉组织钙含量,激发和散发波长分别为485 nm和520 nm。
(4)腹主动脉组织Notch1、RBP-JK、Msx2、α-SMA、Runx2 mRNA表达:采用实时PCR(real-time polymerase chain reaction,RT-PCR)检测各组大鼠腹主动脉组织Notch1、RBP-JK、Msx2、α-肌动蛋白(α-smooth muscle aorta,α-SMA)、Runt相关转录因子2(Runt-related transcription factor 2,Runx2)的信使核糖核酸(mRNA)表达强度。利用试剂盒提取总RNA,然后对RNA进行电泳。反转录后实施RT-PCR反应,反应条件:95 ℃预变性共2 min,95 ℃变性共15 s,60 ℃水浴共60 s,60 ℃退火45 s,共进行40个循环。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,反应结束后对扩增曲线和溶解曲线进行分析,测得Ct值,以2-ΔΔCt为目的基因的相对表达强度,其中ΔCt=Ct目的基因-Ct内参;ΔΔCt=ΔCt实验组-ΔCt对照组。
(5)腹主动脉组织Notch1、RBP-JK、Msx2、α-SMA、Runx2蛋白表达:采用蛋白质免疫印迹(western blot)法。腹主动脉匀浆灭活后提取总蛋白,定量后电泳,封闭孵育(室温)。1 h后滴加一抗,孵育过夜(4 ℃),冲洗后滴加二抗,孵育2 h(37 ℃),再次冲洗。显色并以纯化水终止反应,暗室曝光、显影。拍照并计算蛋白相对表达量。
三、统计学处理
采用SPSS 26.0软件进行统计学处理,符合正态分布的计量资料多组间差异比较采用单因素方差分析,两两比较采用SNK-q检验,组内差异比较采用配对t检验。P<0.05为差异有统计学意义。
结 果
一、各组大鼠肾功能指标比较
32只大鼠中共有30只建模成功,随机分为模型对照组(8只)、低剂量组(7只)、中剂量组(7只)和高剂量组(8只),干预期间分别有1只、1只、1只、0只死亡,正常对照组实验期间无大鼠死亡。干预前模型对照组、低剂量组、中剂量组和高剂量组的24 h尿蛋白、血肌酐、血尿素氮水平均高于正常对照组(P<0.05),干预后正常对照组均无显著变化(P>0.05),模型对照组均显著升高(P<0.05),3剂量组均显著降低(P<0.05),且干预后3剂量组均高于正常对照组(P<0.05),均低于模型对照组(P<0.05),其中高剂量组均低于低剂量组和中剂量组(P<0.05),中剂量组均低于低剂量组(P<0.05)。(表1)
二、各组大鼠腹主动脉钙化情况观察及腹主动脉组织钙含量比较
正常对照组大鼠腹主动脉组织未见钙盐沉积,其余4组血管内膜和中膜弹性纤维间存在较多的、散在点状沉积棕褐色钙盐颗粒。其中模型对照组钙化特征最为明显,可见大范围融合的钙化斑块;低剂量组次之,可见部分钙化斑块或较大颗粒的钙盐;中剂量组稍轻,可见钙盐颗粒;高剂量组钙化特征最轻,钙盐颗粒较少,与正常对照组最为接近。(图1)
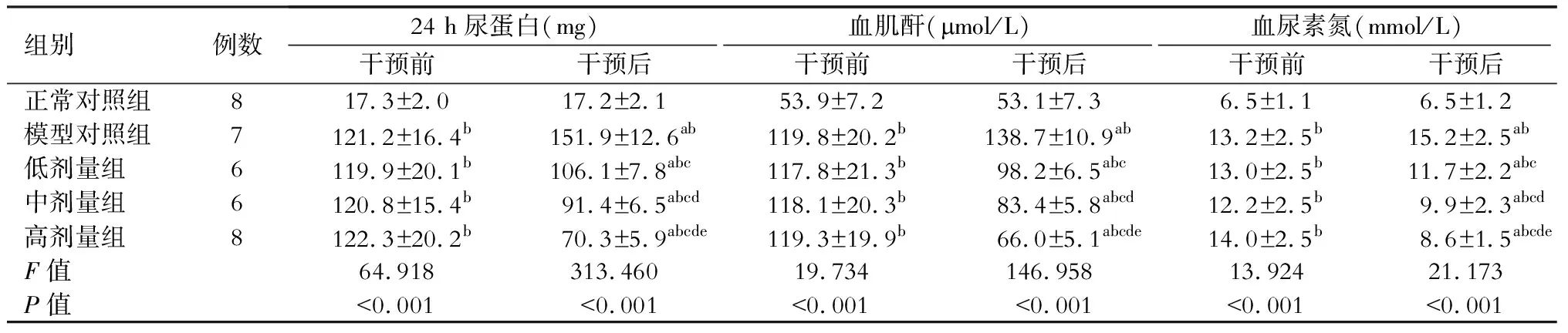
表1 干预前后各组大鼠肾功能指标比较
注:与同组干预前对比,aP<0.05;与正常对照组对比,bP<0.05;与模型对照组对比,cP<0.05;与低剂量组对比,dP<0.05;与中剂量组对比,eP<0.05
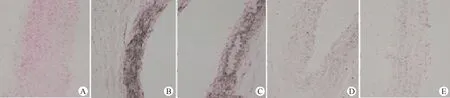
图1 各组大鼠腹主动脉钙化情况观察(×200) A.正常对照组;B.模型对照组;C.低剂量组;D.中剂量组;E.高剂量组
各组大鼠腹主动脉组织钙含量对比差异有统计学意义(P<0.05),3剂量组均高于正常对照组(P<0.05),且均低于模型对照组(P<0.05),高剂量组低于低剂量组和中剂量组(P<0.05),中剂量组低于低剂量组(P<0.05)。(表2)
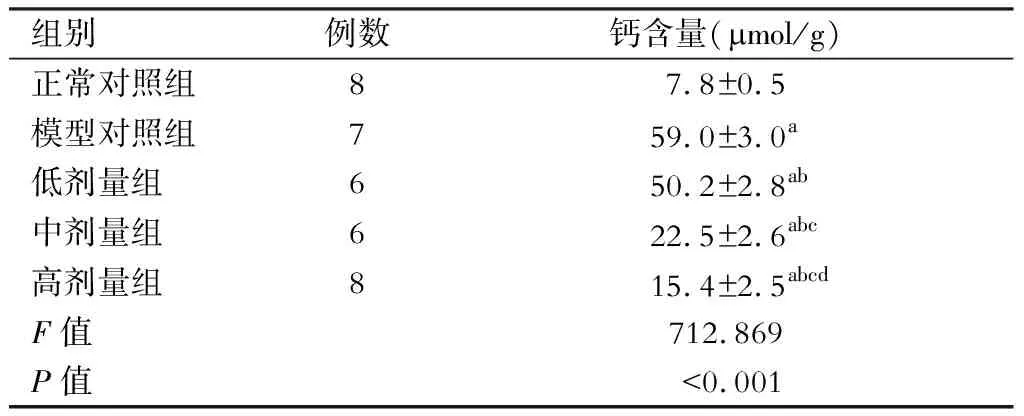
表2 各组大鼠腹主动脉组织钙含量比较
注:与正常对照组对比,aP<0.05;与模型对照组对比,bP<0.05;与低剂量组对比,cP<0.05;与中剂量组对比,dP<0.05
三、各组大鼠腹主动脉组织Notch1、RBP-JK、Msx2、α-SMA、Runx2 mRNA表达量比较
各组大鼠腹主动脉组织Notch1、RBP-JK、Msx2、Runx2 mRNA表达对比差异均有统计学意义(P<0.05),其中3剂量组表达均高于正常对照组(P<0.05),均低于模型对照组(P<0.05),高剂量组均低于低剂量组和中剂量组(P<0.05),中剂量组均低于低剂量组(P<0.05),α-SMA mRNA表达情况刚好相反。(表3)
四、各组大鼠腹主动脉组织Notch1、RBP-JK、Msx2、α-SMA、Runx2蛋白表达量比较
各组大鼠腹主动脉组织Notch1、RBP-JK、Msx2、Runx2蛋白表达量对比差异均有统计学意义(P<0.05),其中3剂量组表达均高于正常对照组(P<0.05),均低于模型对照组(P<0.05),高剂量组均低于低剂量组和中剂量组(P<0.05),中剂量组均低于低剂量组(P<0.05),α-SMA蛋白表达情况刚好相反。(图2、表4)
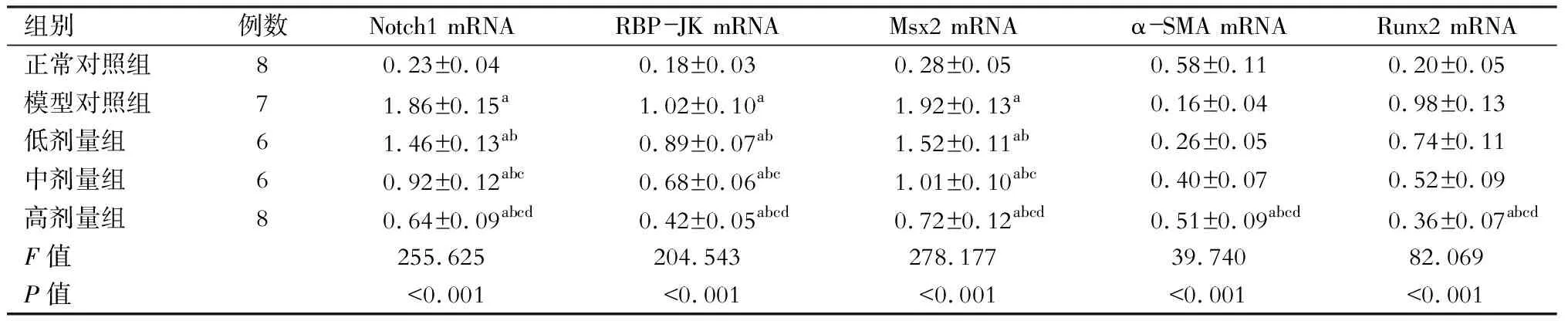
表3 各组大鼠腹主动脉组织Notch1、RBP-JK、Msx2、α-SMA、Runx2 mRNA表达量比较
注:与正常对照组对比,aP<0.05;与模型对照组对比,bP<0.05;与低剂量组对比,cP<0.05;与中剂量组对比,dP<0.05

表4 各组大鼠腹主动脉组织Notch1、RBP-JK、Msx2、α-SMA、Runx2蛋白表达量比较
注:与正常对照组对比,aP<0.05;与模型对照组对比,bP<0.05;与低剂量组对比,cP<0.05;与中剂量组对比,dP<0.05
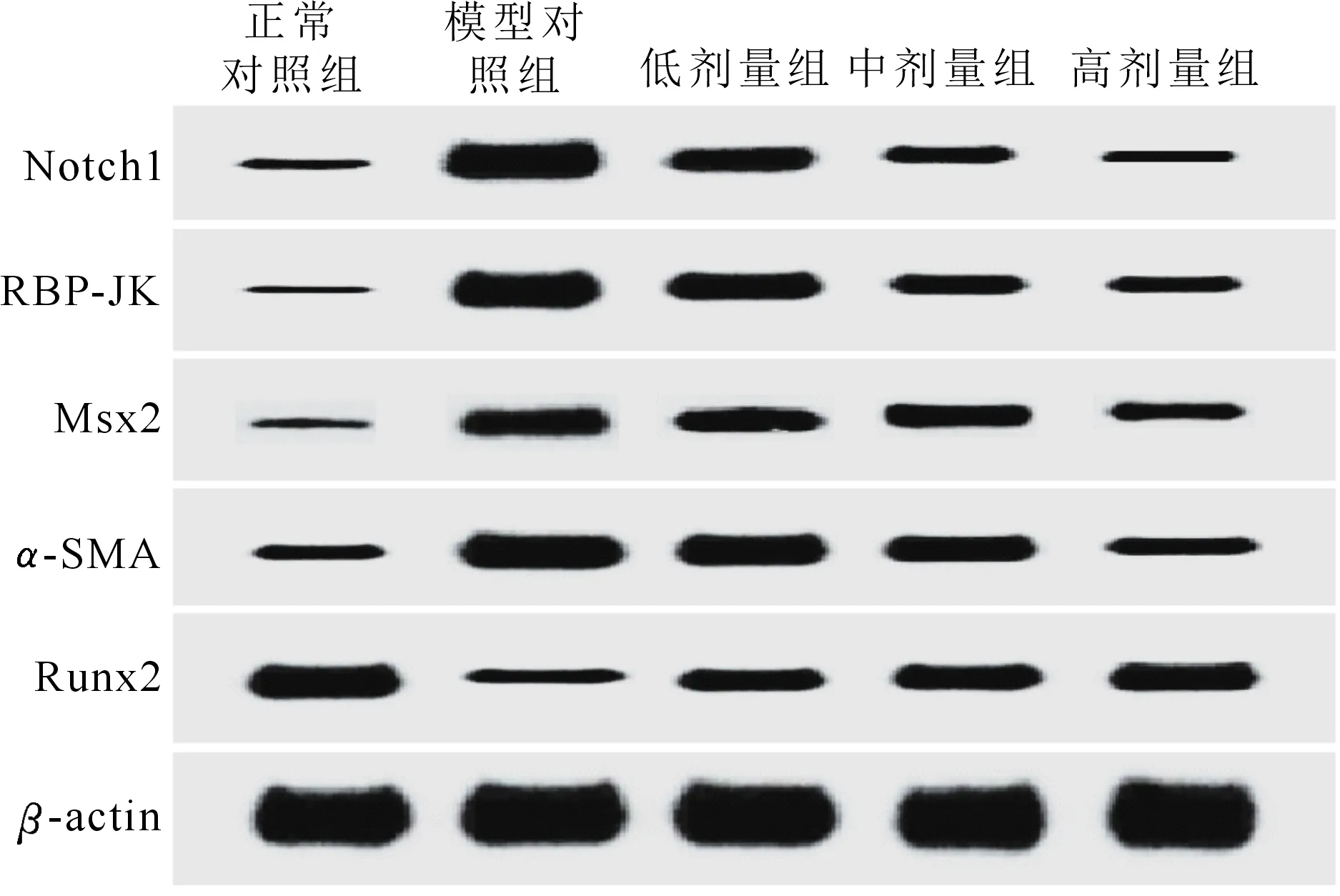
图2 各组大鼠腹主动脉组织Notch1、RBP-JK、Msx2、α-SMA、Runx2蛋白表达量western blot检测结果
讨 论
糖尿病肾病主动脉钙化主要是由于血糖长期处于较高水平,导致微血管、神经病变等,使得血管弹性降低,血管壁受损,加之随着年龄的增长血管逐渐老化而形成的[6-8]。主动脉钙化会使血管僵硬度增加,血管弹性和顺应性减弱,脉压增加,左心室负荷增大,进而可导致左心室肥厚,还可诱发并逐渐加重冠状动脉缺血状态,诱发冠心病、心力衰竭等心血管疾病,甚至危及患者的生命安全[9]。有研究表明[10],主动脉钙化的常见危险因素有糖尿病肾病、钙磷代谢紊乱、年龄增长和透析龄增加,目前仍缺乏行之有效的治疗方案,因此探讨糖尿病主动脉钙化的理想控制方案及其治疗作用机制,符合临床患者的迫切需求。
本次研究显示,与正常对照组相比较,模型对照组24 h尿蛋白、血肌酐和血尿素氮均升高,3剂量组也均升高,且3剂量组指标水平均低于模型对照组,表明对糖尿病肾病钙化大鼠模型给予大黄酸干预能够发挥保护肾脏的作用;其中,高剂量组的效果最佳,表明该药物的肾保护作用呈剂量依赖性。此外,模型对照组大鼠腹主动脉钙化较严重,而3剂量组均明显减轻,且高剂量组钙化情况最轻,可知大黄酸能够减轻糖尿病肾病钙化大鼠模型的腹主动脉钙化情况,且高剂量大黄酸的效果更佳,关于腹主动脉组织钙含量的检测结果也证实了此结论。大黄酸是从大黄干燥的根茎中提取的有效成分,而大黄具有利湿退黄、清热泻火、凉血解毒的功效[11]。大黄酸也被证实能够延缓糖尿病肾病的发展进程,保护肾功能[12]。大黄酸能够控制肾小球系膜细胞的增殖,控制肾纤维化,减轻氧化应激反应,减少尿蛋白,因此对糖尿病肾病主动脉钙化大鼠有良好的保护肾功能的作用[12]。有研究显示[13],大黄酸能够预防心血管并发症,推测与其能够控制氧化应激并减轻血管壁损伤有关。但是关于大黄酸对糖尿病肾病主动脉钙化的作用机制仍需要进一步探讨。
本次研究显示,与正常对照组相比较,模型对照组Notch1、RBP-JK、Msx2、Runx2 mRNA表达和蛋白相对表达量均显著升高,且3剂量组均明显高于正常对照组,低于模型对照组,3剂量组间相比较,低剂量组Notch1、RBP-JK、Msx2、Runx2 mRNA和蛋白相对表达量均最高,中剂量组均次之,高剂量组均最低,α-SMA mRNA及蛋白表达情况相反,可知大黄酸能够调节糖尿病肾病主动脉钙化大鼠腹主动脉组织Notch1、RBP-JK、Msx2、α-SMA、Runx2 mRNA及蛋白的表达水平。Notch1-RBP-JK/Msx2是经典的主动脉钙化信号传导调控通路,在此通路上,Notch1能够正向调控RBP-JK和Msx2,且α-SMA、Runx2的表达均受该信号通路的调控[14-16],当该信号通路受到刺激被激活,Notch1、RBP-JK、Msx2表达增强,其下游的α-SMA也可被激活,而Runx2则可受到抑制,参与主动脉钙化病变过程。在高磷、高糖的环境下和炎症因子的刺激作用下,Notch1、RBP-JK、Msx2等成骨转录因子的基因和蛋白的表达均活化,进而诱导平滑肌细胞转化成成骨细胞,并刺激矿化的发生。Msx2被认为是主动脉钙化的关键调控因子,已经被确认属于成骨分化和矿化的同源转录因子[17]。在此信号通路传导过程中,α-SMA、Runx2等成骨因子均积极参与,其中α-SMA属于平滑肌细胞标志物,其表达水平降低意味着血管平滑肌功能受损[18];Runx2具有DNA结合结构域,在前成骨细胞、前软骨细胞、成骨细胞和前肥大软骨细胞中表达,能够促进成骨转化和骨形成[19]。有报道显示,在糖尿病肾病主动脉钙化发生和发展的过程中,Notch1-RBP-JK/Msx2信号通路参与其中并发挥极大的作用,影响病情发展[20]。结合本研究结果推测大黄酸能够下调Notch1、RBP-JK、Msx2、Runx2 mRNA及蛋白表达,上调α-SMA mRNA及蛋白表达,从而发挥减轻糖尿病肾病主动脉钙化。但是关于大黄酸对上述基因和蛋白的具体调控机制尚未见相关报道,仍需深入探讨。
综上所述,大黄酸能够保护糖尿病肾病主动脉钙化大鼠的肾功能,减轻主动脉钙化,减少主动脉组织的钙含量,推测其作用机制与下调Notch1、RBP-JK、Msx2、Runx2 mRNA及蛋白表达,上调α-SMA mRNA及蛋白表达有关。本研究为糖尿病肾病主动脉钙化的治疗药物研究提供了新的方向,显示出良好的研究价值和发展前景,而该药物对上述基因和蛋白表达的具体调控机制仍需要进一步研究。
