miRNA-41调控c-myc在宫颈癌上皮间质转化中的作用
2020-03-13朱亚张伟柯丽娜朱承义李斌
朱亚 张伟 柯丽娜 朱承义 李斌
宫颈癌是全球女性中发病率第二位的恶性肿瘤,近年来其发病率逐年上升。宫颈癌的发生与发展作用机制复发,已知众多分子参与调控这一错综复杂的过程,而针对单一基因设计的靶点药物对肿瘤遏制效果并不理想[1,2]。侵袭是恶性肿瘤的重要特性之一,其与肿瘤细胞上皮间质转化(epithelial-mesenchymal transition,EMT)密不可分[3,4];EMT以上皮细胞特性的丧失及其间质细胞特性的获得为主要特征,能使局限性生长的肿瘤发展成转移性肿瘤,提高其侵袭能力[5]。肿瘤发生EMT过程中的标志是间质细胞标志分子Vimentin 表达升高, 细胞骨架重组,细胞间连接变得疏松等[6]。能诱导肿瘤细胞发生EMT的因素比较多,包括炎症刺激、化疗药物、紫外线、组织损伤、缺氧等[7]。MicroRNA即微小RNA(miRNA),是指长度21~25 nt的小型非编码RNA家族,其能够识别特定的目标mRNA,可通过促进靶mRNA的降解和(或)抑制翻译过程而发挥调控作用[8]。miRNA-41在多种恶性肿瘤中表达升高,并能够通过抑制PTEN、PDCD4、p53等抑癌基因的翻译过程参与调控多种恶性肿瘤的发生[9]。c-myc蛋白具有调节细胞增殖分化和促进细胞凋亡的作用,宫颈癌组织中伴随有c-myc的过度表达和扩增[10,11]。本文探讨miRNA-41调控c-myc在宫颈癌EMT中的作用,以明确miRNA-41的作用机制,报告如下。
1 资料与方法
1.1 一般资料 HeLa宫颈癌细胞系购自中国医学科学院基础医学研究室,培养于含10%热灭活FBS,4 mmol/L谷氨酰胺,50 U/ml青霉素和50 μg/ml链霉素的DMEM培养基,培养条件为37℃与5%CO2湿润培养,取对数生长期细胞用于实验,每隔3~5 d进行传代。miRNA-41 mimic与miRNA-41 NC购自武汉博士德生物科技有限公司。
1.2 细胞分组与转染 HeLa细胞随机分为3组:空白组、对照组与miRNA-41组。取对数生长期细胞,待细胞融合度达到70%~80%后,对照组与miRNA-41组分别用EZ Trans细胞转染试剂转染miRNA-41 NC 与miRNA-41 mimic,转染终浓度为10 nmol/L,转染后12 h更换培养液,空白组不进行转染。
1.3 qRT-PCR检测miRNA-41表达 转染后24 h与36 h,收获细胞,用刮棒刮取细胞、4℃、1 000 r/min离心10 min,去上清,收集细胞。采用Trizol法提取细胞中的总RNA,采用SYBRGreen PCR Master Mix(Applied Biosystems)系统检测miRNA-41表达,以GAPDH为反应体系内参照。
1.4 MTT法检测细胞增殖指数 收集转染后的HeLa细胞分别接种于96孔板,约5×103个/孔,转染后24 h与36 h分别去除96孔板每孔中培养液,每孔加入180 μl新鲜DMEM培养液,再加入20 μl MTT溶液,继续培养4 h。终止培养,去除孔内培养液,然后每孔加入100 μl 二甲基亚砜(DMSO),震荡培养10 min,在酶联免疫检测仪570 nm处测量各孔的吸光值,计算细胞增殖指数。
1.5 Transwell小室检测细胞侵袭指数 将分装好的Matrix 从-20℃冰箱中取出,在每个Transwell 小室中铺胶100 μl,温育3 h夹起Transwell 小室,向下室中加入600 μl含15%胎牛血清的培养基。转染后24 h与36 h,将细胞密度调整为4×105个/ml取100 μl细胞悬液垂直加入到Transwell小室中,培养24 h取出小室、固定细胞并精心染色,镜下随机取5 个视野进行拍照,记录细胞相对侵袭指数。
1.6 流式细胞术检测细胞周期 转染后36 h,胰蛋白酶消化收集细胞,离心后弃去上清,加重悬细胞,加入预冷的70%冰乙醇2~3 ml,吹打均匀,于4℃冰箱固定24 h以上。1 000 r/min 5 min离心弃去乙醇,重悬后加入碘化丙啶染液(PI染液,100 μg/ml),室温避光混合30 min,采用流式细胞仪检测细胞周期。上述实验都重复3次,取平均值。
1.7 Western Blot检测c-myc与Vimentin表达 转染后36 h,PBS洗涤细胞2次,取细胞,加入100 μl预冷的蛋白裂解液,裂解蛋白后分装并在-70℃冰箱中保存。取20 μg蛋白进行Western Blot检测应用商品化抗c-myc抗体和抗Vimentin抗体 (Abcam),以GAPDH(Abcam)为内参照。

2 结果
2.1 3组miRNA-41表达水平比较 转染后24 h与36 h,miRNA-41组的miRNA-41表达水平显著高于空白组和对照组(P<0.05),空白组与对照组比较差异无统计学意义(P>0.05)。见表1。


组别24 h36 hmiRNA-41组23.44±2.4834.77±4.51对照组1.44±0.221.51±0.33空白组1.23±0.311.33±0.11 F值67.30298.022 P值0.0000.000
2.2 3组细胞增殖指数比较 转染后24 h与36 h,miRNA-41组的细胞增殖指数显著高于空白组和对照组(P<0.05),空白组与对照组比较差异无统计学意义(P>0.05)。见表2。


组别24 h36 hmiRNA-41组134.59±24.03155.32±31.48对照组99.24±10.4298.76±9.22空白组95.92±9.7896.38±10.33 F值9.83312.430 P值0.0010.000
2.3 3组细胞周期比较 转染后36 h,miRNA-41组的G1期比例较对照组和空白组显著降低(P<0.05),S期+G2期比例显著增加,差异有统计学意义(P<0.05)。见表3。
2.4 3组细胞侵袭指数比较 转染后24 h与36 h,miRNA-41组的细胞侵袭指数显著高于空白组和对照组(P<0.05),空白组与对照组比较差异无统计学意义(P>0.05)。见表4。
2.5 c-myc与Vimentin表达比较 转染后36 h,miRNA-41组的c-myc与Vimentin蛋白相对表达量显著高于对照组和空白组,空白组与对照组比较差异无统计学意义(P>0.05)。见图1。


组别G1期S期+G2期miRNA-41组51.34±0.3348.77±0.24对照组60.00±0.6539.53±0.61空白组60.98±0.3338.92±0.55 F值5.7754.984 P值0.0080.012


组别24 h36 hmiRNA-41组1.56±0.441.78±0.56对照组1.02±0.081.07±0.11空白组1.03±0.111.06±0.05 F值23.10322.881 P值0.0000.000
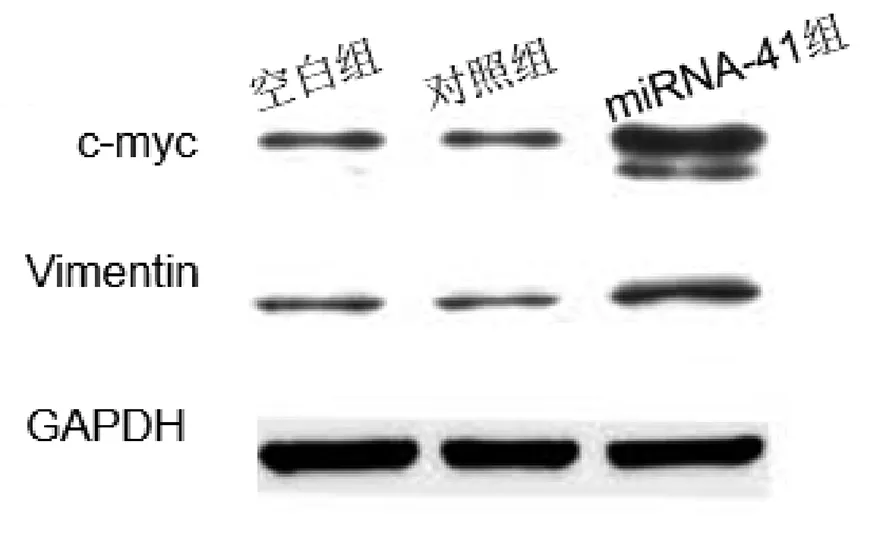
图1 3组c-myc与Vimentin表达比较
3 讨论
宫颈癌是妇科最常见的恶性肿瘤之一,发病率呈逐年上升的趋势。宫颈癌患者5年生存率一直不高,肿瘤转移是宫颈癌致死的主要原因[12]。miRNAs 作为调控基因表达的一类非编码小RNA,可参与机体大多数的生物学和病理学的进程,其主要通过与靶mRNA的核苷酸序列的碱基配对与互补调控转录后水平的基因表达。有研究显示miRNA-41在宫颈癌细胞系中呈现为高表达,反义miRNA-41能够抑制宫颈癌细胞系的生长[13]。还有研究显示转染反义miRNA-41寡核苷酸后,宫颈癌细胞增殖与侵袭能力被抑制[14]。还有学者采用qRT-PCR检测miRNA-41的表达水平,结果显示正常组织中miRNA-41表达水平很低,而宫颈癌组织中的表达量增加10倍以上[15]。宫颈癌的播散是指恶性宫颈癌在生长和发展过程中向邻近组织直接侵袭和远处转移的过程,其中主要的特征为细胞侵袭。这个过程的发生发展一般都伴有细胞极性消失、与内皮细胞基底膜的粘附能力增强、细胞间的粘附能力下降以及细胞骨架重构等[16,17]。本研究显示转染后24 h与36 h,miRNA-41组的miRNA-41表达水平显著高于空白组和对照组(P<0.05);细胞增殖指数与侵袭指数显著高于空白组和对照组(P<0.05);转染后36 h,miRNA-41组的G1期比例相对于对照组和空白组显著降低(P<0.05),S期+G2期比例则显著增加(P<0.05),表明miRNA-41的高表达能促进细胞增殖与侵袭,调节细胞周期。
癌细胞可以存在于各种表型状态,其细胞可以保持上皮性状与间充质状态,可使癌细胞具有肿瘤发生潜力[18]。EMT是一种生物过程,癌症相关的EMT有助于增加肿瘤细胞的侵袭性和转移性,多种细胞因子可诱导肿瘤细胞发生EMT[19]。Vimentin是中间纤维蛋白的一种,Vimentin高表达的结肠癌细胞系和乳腺癌细胞具有高度侵袭性,其在肿瘤中的表达上调是EMT发生的重要标志[20]。并且Vimentin的表达的逐渐上升是随着分化级别的降低而进行的,在宫颈癌的发展转移中发挥重要作用。c-myc癌基因的编码蛋白由49个氨基酸残基组成,在宫颈癌组织中经常发现c-myc 的过度表达[21]。有研究显示在宫颈组织、宫颈炎症,宫颈浸润癌,c-myc的表达呈递增趋势[22,23]。c-myc 基因扩增及过表达与肿瘤细胞的无限增殖及增殖后结局密切相关,肿瘤恶性程度越高,c-myc的表达率越高[24,25]。本研究显示转染后36 h,miRNA-41组的c-myc与Vimentin蛋白相对表达量显著高于对照组和空白组,空白组与对照组比较差异无统计学意义(P>0.05),表明过表达miRNA-41能促进c-myc与Vimentin蛋白表达,从而促使EMT的发生,提高肿瘤增殖性与侵袭性。本研究也有一定的不足,没有明确miRNA-41在宫颈癌的靶基因,miRNA-41对EMT的调控作用还有待进一步深入分析。
综上所述,miRNA-41在宫颈癌细胞中的高表达能够促进c-myc与Vimentin蛋白表达,从而促使EMT的发生,调节细胞周期,提高细胞增殖性与侵袭性。
