电解质及醇类对天然气水合物相平衡影响机理分析*
2020-03-12张高庆
张高庆
(攀枝花学院钒钛学院,四川 攀枝花 617000)
天然气水合物是由水和天然气在低温高压条件下形成的一种似冰状、非化学计量的笼形化合物[1]。虽然其资源潜力巨大,全球资源量为2×1016m3[2],在全球有机碳总含量中占了50%以上[3],但其危害也不容小觑,如天然气输送管道内形成天然气水合物时,会堵塞管道从而影响输气管道的安全、可靠运行。
自1810年气水合物在实验室被首次发现,关于气水合物的研究和探索便开始了[4]。自从1934年美国的Hammerschmidt[5]发现天然气输送管道内生成的天然气水合物会严重堵塞气体管道,为防止其形成而阻塞管道以免引起事故,许多专家和学者开始对其相平衡进行实验研究,比如Sloan[6]于1975年首先开始研究气体水合物相平衡。目前通过相平衡模拟实验来分析不同因素对天然气水合物相平衡的影响进行研究,这些因素主要包括气体组分[7-12]、盐度及离子组分[10-14]、孔隙大小[10-11,15]等。虽开展了一系列的相关实验,但对于天然气水合物相平衡机理的微观机理的认识略显不足,值得进一步研究。天然气水合物相平衡的研究对天然气水合物储运及勘探和开发等方面研究有着重要的意义,如对管道水合物的预防及自然界水合物气藏的开发有一定的指导作用。
本文在吸收前人的研究成果基础上,包括水合物形成机理及实验条件下温度、压力等因素对水分子氢键、天然气水合物形成的影响的实验成果,尽可能全面和直观地分析对天然气水合物相平衡机理进行解释。
1 天然气水合物结构及形成机理
天然气水合物是在一定温度和压力条件下,较小的烃类气体分子被束缚在由水分子通过氢键作用形成的骨架中的一种笼型化合物[1,16-17]。天然气水合物主要有三种结构(如图1[1]所示):Ⅰ型、Ⅱ型和H型(如表1[1]所示)。Ⅰ型和Ⅱ型主要是甲烷、乙烷、丙烷、异丁烷等分子,H型则为更重的烃类分子。Ⅰ型水合物中烃类主要为生物成因;Ⅱ型和H型则主要是热成因,且常与油气藏渗漏有关。与Ⅰ型天然气水合物相比,Ⅱ型和H型结构更稳定得多,可以在较高温度及较低压力下保持稳定,但自然界中以Ⅰ型为主[18-20]。

表1 三种水合物的晶体结构基本参数
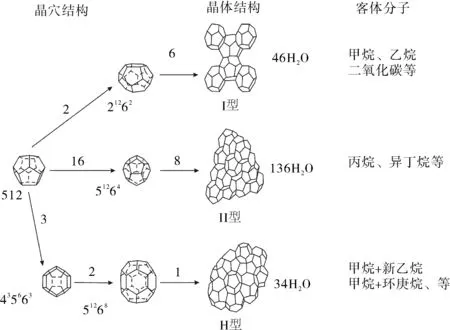
图1 自然界产出的三种天然气水合物晶体结构
微观上,天然气水合物的生成主要有4步:①天然气气体分子溶解于水中;②天然气水合物骨架的形成,也即初始成核过程,指的是溶解至水中的天然气气体分子与水形成基本骨架(一种空穴),它们再相互结合形成另一种大小不同的空穴;③天然气气体分子扩散至水合物基本骨架;④天然气气体分子选择性吸附在水合物骨架中,从而使天然气水合物晶体增长[8-9]。动力学上,它形成则分成3步:①临界半径晶核的形成;②固态晶核的长大;③组分向处于聚集状态晶核的固液界面转移。其中具有临界晶体半径晶核的形成过程如图2[11]所示[21-22]。

图2 天然气水合物晶簇生长图
2 电解质及醇类对天然气水合物相平衡影响
外界因素对对天然气水合物相平衡的影响主要表现为水合物形成时所需的温压发生变化,如某因素影响天然气水合物形成,使其可以在更高的温度或更低的压力下形成,则相平衡范围更大;反之,如该因素使天然气水合物的形成需要更低的温度或更高的压力,则相平衡范围更小。
目前通过相平衡模拟实验来分析不同因素对天然气水合物相平衡的影响进行研究,这些因素主要包括气体组分[7-12]、盐度及离子组分[10-14]、孔隙大小[10-11,15]等。在此只分析电解质及醇类对水合物相平衡的影响,影响结果如图3[23]、图4[13]所示,不难发现电解质与醇类对天然气水合物相平衡起抑制作用。

图3 含电解质和甲醇体系中天然气水合物生成压力的测定结果

图4 NaBr,KBr,CaBr2,K2CO3及MgCl2溶液中甲烷水合物实验结果
3 电解质及醇类对天然气水合物相平衡影响微观机理
由前文所述,天然气水合物的生成,实际上是水分子通过氢键作用形成骨架,然后天然气分子进入骨架形成晶核并长大的过程。因此,影响水分子氢键的形成,也就会影响天然气水合物的形成,即对天然气水合物相平衡产生影响。因此,我们从水分子间氢键方面着手分析电解质及醇类对天然气水合物相平衡影响微观机理分析。首先介绍下温压、电解质及醇类是如何影响水分子间氢键的形成。
3.1 温压、电解质及醇类对水分子间氢键形成的影响
3.1.1 温压方面
温度升高,水分子热运动加剧,破坏水中氢键并使之发生断裂,造成每个水分子具有的氢键数减少[24-27];在0~150 MPa范围时(水合物形成所需压力[1]包含在此范围内),随压力增加,氢键作用增强[28],每个水分子具有的氢键数增加[25]。因此,降低温度或升高压力,均有利于水分子间氢键的形成。
3.1.2 电解质和醇类方面
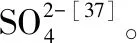
醇类对水分子间氢键的形成也有抑制作用,当水中醇类越多及醇类浓度越大,则水分子间越难形成氢键[30]。
总之,降低温度或升高压力,有利于水分子间氢键的形成;电解质及醇类都不利于水分子间氢键的形成,破坏已形成的氢键(图5)。

图5降温或升压与电解质及醇类对水分子间氢键的影响
Fig.5 Impaction of temperature decrease or pressure increase and electrolyte or alcohols on hydrogen bond among water molecules
3.2 电解质及醇类对天然气水合物相平衡影响微观机理
由前文分析可知,电解质或醇类都会破坏水分子间氢键的形成,虽影响机理不同,进而不利于天然气水合物的形成或使生成的天然气水合物产生分解。因此,为了形成天然气水合物或者使已生成的天然气水合物不再分解,就需要额外的氢键来补充那部分被破坏的氢键,而降低温度或升高压力可以实现这个目的,从而表现为加入电解质及醇类后,天然气水合物的形成需要更低的温度或更高的压力。当然,不同种类、浓度的电解质或醇类对其影响程度不同,从而需要降低的温度或升高的压力也不同。
电解质及醇类均通过影响水分子间氢键的形成来进而影响天然气水合物的形成,那从微观角度来看,它们影响方式是否相同呢?接下来分析它们是如何来影响水分子间氢键的形成。
3.2.1 电解质对天然气水合物形成的影响微观机理
电解质为离子化合物,一方面溶于水后电离出的离子对水分子产生静电作用,破坏水分子间氢键[38],另一方面水分子氢端、氧端分别与阴离子、阳离子会发生作用,使得与阴离子作用的氢原子不可能再与其它水分子保持氢键作用,也会破坏水分子间氢键[27],从而不利于天然气水合物的形成或使已生成的天然气水合物产生分解。
3.2.2 醇类对天然气水合物的形成的影响微观机理
加入醇类物质后,①由于醇类与水互溶,醇分子部分取代水氢键网络中的水分子,从而减弱了水分子中氢键[39];②极性较大的羟基与极性分子和极性基团有较强的亲和力,醇类与水分子之间有较强的相互作用,相互吸引形成氢键,便破坏了水分子间氢键形成的原有网格[27];③醇类的氢键与水分子的不同,前者为分子内氢键,而后者为分子间氢键,并且一旦某分子形成了分子内氢键,则其不再形成分子间氢键。因此,醇类从这三方面破坏水分子间氢键,使已形成的天然气水合物产生分解或不利于天然气水合物的形成。
4 关于电、磁场及微波对天然气水合物形成影响的讨论
前文已述,电解质及醇类通过影响水分子间氢键的形成,进而影响了天然气水合物的形成,那么只要能影响水分子间氢键的形成,那么就会对天然气水合物的生成产生影响。迄今为止,有学者指出电、磁场及微波对水分子间氢键的形成会产生一定的影响,具体如下:随电场强度的增加每个水分子形成氢键的平均数目增加[40],即电场促进水分子间氢键的形成,可有人却认为电场破坏水分子间氢键作用[41];水分子氢键数随磁场强度增强而稍微增加,磁场促进氢键的形成[42];微波能转化为水分子的内能,加强了水分子的震动,水分子获得能量后,使氢键断裂[41]。因此推测,在电场、磁场或微波环境下,也会对天然气水合物的形成产生影响:施加额外电场,对天然气水合物的形成也有影响,但影响结果不明;磁场的存在有利于天然气水合物的形成但微波却不利于其形成。不同能级的电、磁场及不同能量的微波下,影响天然气水合物形成的程度如何不知,需要进行相关实验具体分析。
5 结 语
影响水分子间氢键的形成,进而对由水分子间氢键形成的骨架产生影响,从而影响了天然气水合物的生成。
(1)加入电解质或醇类时,不利于水分子氢键的形成,从而不利于天然气水合物的形成,但降低温度或升高压力,有利于水分子氢键的形成,因此通过降温或升压可以形成天然气水合物。
(2)电解质及醇类对天然气水合物的形成产生影响,都是影响水分子间氢键的形成进而影响天然气水合物的形成,但影响方式不同。
(3)在体系中施加电磁场及微波,也会对天然气水合物的形成有影响,磁场的存在促进天然气水合物的形成,但微波却破坏天然气水合物的形成。
