水通道蛋白4在乳腺癌细胞侵袭转移中的作用
2020-03-12李英彬孙圣荣
李英彬 孙圣荣
乳腺癌(BC)是女性最常见的恶性肿瘤[1],其发生机制不明。水通道蛋白(aquaporin,AQP)家族是一种疏水性跨膜蛋白,大小为26~34 kDa,广泛地存在于包括哺乳动物在内的多种生物中[2]。目前,在哺乳动物中已经发现至少13种AQP亚型[3]。Aquaporin 4(AQP4)是AQP家族的一员,在维持水和离子平衡中起关键作用。有研究发现,AQP4在肿瘤的发生发展中起着重要作用[4]。敲除AQP4能抑制成年小鼠脑室下区神经干细胞的增殖,迁移和神经分化[5]。Shi等[6]筛选在乳腺癌组织中的AQP的表达谱时发现,AQP4在肿瘤组织中的表达水平显著高于正常组织,这说明它在乳腺癌发生发展中可能起一定的作用。本研究拟研究AQP4的表达水平及其在乳腺癌发生发展中的作用。
对象与方法
一、材料
人乳腺癌细胞株MDA-MB-231,T47D,MCF-7 和 ER-ZR-70均购买于中国科学院细胞生物学研究所(上海)。
二、方法
1.小干扰RNA(siRNA)处理:T47D 和MCF-7细胞瞬时转染,将siRNA和Lipofectamine 2000(Invitrogen,Carlsbad,CA)分别与Opti-MEM无血清培养基混合,再将二者混合后处理肿瘤细胞,6小时后更换为正常培养基。
2.RNA的分离和实时PCR鉴定:总RNA使用RNeasy 试剂盒进行提取。使用PrimeScript RT-PCR试剂盒对1 μg的总RNA进行反转录(Takara Bio,Tepco,Japan),通过PCR检测AQP4mRNA的表达(引物:5′-GCTCAATAGCTTTAGCAATTG-3′,吉凯基因公司合成, 上海)。
3.蛋白免疫印迹:细胞样品使用1×RIPA细胞裂解液进行蛋白裂解,超声波破碎,离心得上清,100℃煮样10分钟,SDS-PAGE胶分离蛋白,特异性抗体孵育(抗-AQP4:SantaCruzBiotechnology sc-20812,SantaCruz,CA,1:1000;抗-β-actin:SantaCruzBiotechnology sc1616,SantaCruz,CA,1:1000)。实验结果使用Odyssey®Imager 软件(LI-COR,Lincoln,NE,USA)对条带的荧光强度进行分析,以β-action条带的相对荧光强度值作为实验数据分析对照。
4.划痕试验:人乳腺癌细胞在含有1%胎牛血清的培养基中饥饿处理24小时,之后使用标准的200 μl 无菌枪头对细胞爬片进行划线。细胞划痕的愈合情况由光镜下检测到的细胞生长迁移距离来进行评估。
5.肿瘤细胞侵袭实验:肿瘤细胞侵袭实验根据细胞穿透Transwell小室(Costar,Cambridge,MA,USA)基质胶的程度来进行评估。在光镜下计数预先设立的5个区域内穿过基质胶的肿瘤细胞的数目。
三、统计学分析

结 果
1.AQP4在人乳腺癌细胞系中表达特性:首先通过Western Blot试验验证AQP4在人乳腺癌细胞系中的表达,以β-actin作为对照(图1)。
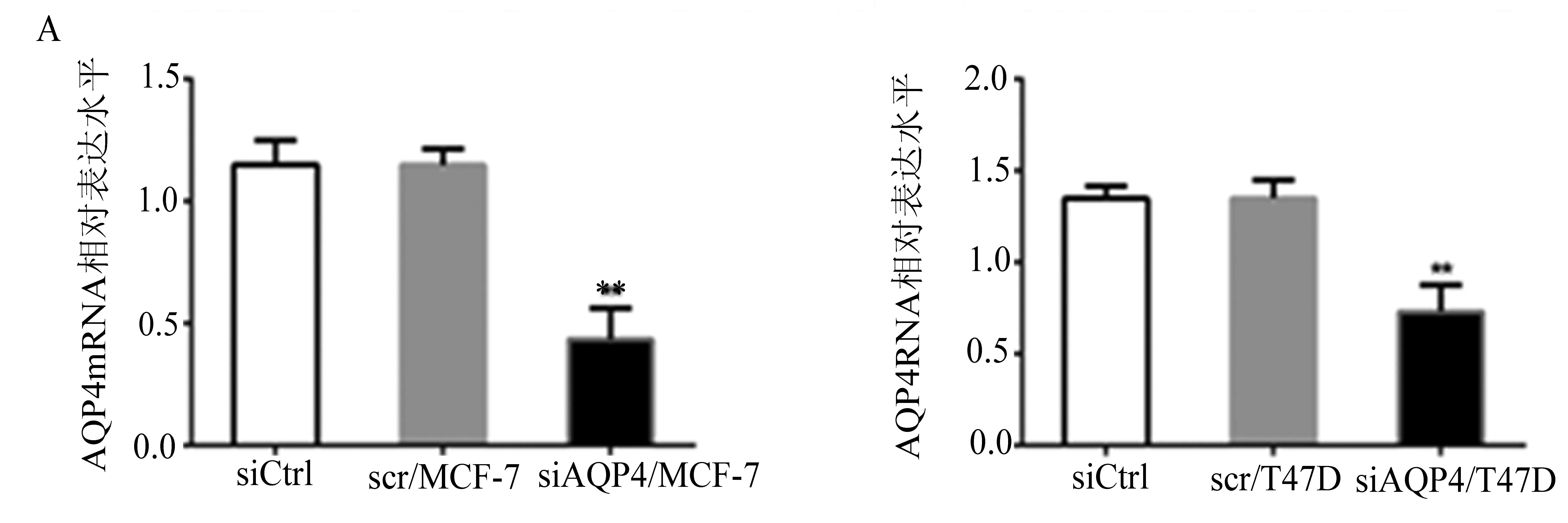
AQP4在T47D和MCF-7细胞系中的表达高于MDA-MB-231和ER-ZR-70。因此,我们选择 T47D 和MCF-7 细胞系做进一步研究。利用siRNA技术沉默T47D和MCF-7细胞中AQP4 mRNA的表达,通过RT-PCR分析和免疫印迹分析检测AQP4的表达(图2)。以无序的核苷酸序列同样转染入细胞株内作为(siCtrl)阴性对照,AQP4mRNA相对表达量,siAQP4/MCF-7组和siAQP4/T47D组均比对照siCtrl组低(P<0.01)。以β-actin蛋白为内参,AQP4蛋白的表达水平,siAQP4/MCF-7组和siAQP4/T47D组均比空白对照siCtrl组低,差异有统计学意义(P<0.05),说明经过siRNA沉默后,AQP4 mRNA和蛋白表达均明显减少。

图1 Western Blot检测不同乳腺癌细胞系中AQP4的表达情况
2.沉默AQP4显著降低乳腺癌细胞的迁移和侵袭能力:AQP4敲除的乳腺癌细胞系中,划痕愈合所需的时间明显比相应的对照组更长。敲除AQP4显著降低了乳腺癌细胞的迁移能力(图3)。迁移结果在0小时siAQP4/T47D及siAQP4/MCF-7组与siCtrl组无明显差异, 24小时内siCtrl组组内对比细胞愈合率明显上升,说明细胞迁移距离增加,24小时内siAQP4/T47D及siAQP4/MCF-7组组内对比细胞愈合率上升相对缓慢。但同时间点实验组与对照组细胞愈合率比较,差异有统计学意义(P<0.05),siAQP4组划痕愈合能力明显受到抑制,表现为划痕愈合面积缩小,划痕愈合面积内细胞迁移数量明显下降(图3)。细胞愈合率siAQP4/T47D组和siAQP4/MCF-7组低于siCtrl组,差异有统计学意义(P<0.05),表明经转染后沉默AQP4的T47D和MCF-7细胞的迁移能力下降。
将siAQP4 T47D、 siAQP4MCF-7组细胞及未处理细胞和对照组(siCrtl)细胞分别接种于Matrigel胶铺就的Transwell小室中,48小时后固定染色。
侵袭实验显示 siAQP4细胞和siCtrl细胞在侵袭能力上有明显差异(P<0.05)(图4)。细胞定量分析表明siCtrl组穿过的细胞数目较siAQP/T47D 组高2.3倍(P<0.05),较siAQP/MCF细胞高 2.0倍(P<0.05)。结果表明siAQP4组乳腺癌细胞的侵袭能力明显降低,说明AQP4蛋白对乳腺癌细胞的侵袭能力有重要作用。



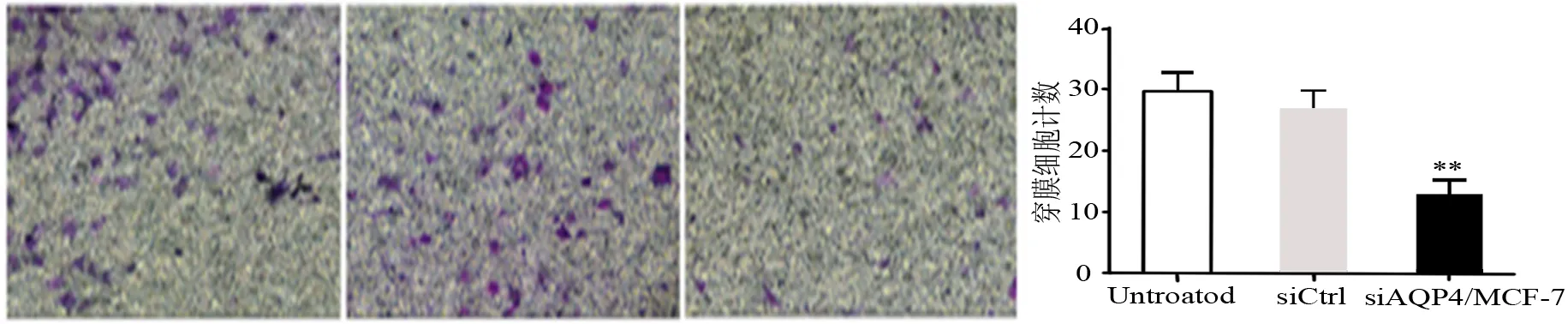
图4 Transwell小室实验
讨 论
迁移是细胞基本特性,这一过程出现在损伤后组织修复、炎症反应、新生血管形成和肿瘤扩散等生理和病理过程中[7]。细胞迁移能力降低通常会导致侵袭能力的下降[8]。根据对培养中迁移细胞的观察,将细胞迁移分为四个过程:极化、突起、牵拉和收缩[9]。其中,质膜突起由肌动蛋白重组构成伪足结构为细胞迁移提供基础,水在细胞内外的流动为细胞迁移提供动力[10]。有研究显示,AQP作为一种肌动蛋白,其聚合/解聚引起跨膜离子流结果导致靠近前缘处的迁移细胞的细胞质出现渗透压的快速变化,促进渗透水流穿过质膜渗入细胞突起,导致细胞的运动[11]。在水通道的调节中,磷酸化是一个很重要的过程,从机制上来看,AQP4含有PKA和PKC磷酸化的同源序列,这些水通道受磷酸化作用直接调节,并认为磷酸化与AQP的运输、门控以及重新分布有关,可见磷酸化直接影响其功能[12]。
肿瘤侵袭和转移是在多基因协同作用下,癌细胞通过与宿主细胞以及细胞外基质等多因素之间相互作用及信号整合的结果。在侵袭转移过程中肿瘤细胞的黏附、分泌蛋白酶、运动三种行为互相协调,在不同的时间和空间进行着精细的调控[13]。在肿瘤的转移扩散中,癌细胞与癌细胞黏附和解离起着决定的作用。有研究发现,癌细胞在原发灶脱落、侵入转移位点并增殖的一系列过程中所涉及的细胞-细胞、细胞-基质间的相互作用由特异性黏附分子介导的[14]。
乳腺癌细胞的迁移和侵袭可能与AQP磷酸化介导的细胞运动有关,在此基础上肿瘤细胞间黏附力的降低可能促进这一过程。这种生物学行为信号传导的研究是一个广泛而复杂的过程。有研究显示,替莫唑胺通过下调AQP4的表达以及激活MAPK信号通路,进而降低胶质瘤细胞的迁移及转移能力[15]。胡慧等[16]研究STAT3通路通过介导MMP-2和MMP-9的表达抑制乳腺癌的侵袭和转移。AQP在乳腺癌中作用通路研究较少,测试何种机制介导AQP在这些过程中的作用也是本实验未来研究重点。完整的通路研究有利于开发AQP4成为乳腺癌治疗的新靶点。
