马流产沙门菌重组鞭毛蛋白FliC和FljB免疫原性比较
2020-03-12王浩易鸳鸯古丽米热对山巴依樊庆庚苏艳
王浩,易鸳鸯,古丽米热·对山巴依,樊庆庚,苏艳
·动物及兽医生物技术·
马流产沙门菌重组鞭毛蛋白FliC和FljB免疫原性比较
王浩,易鸳鸯,古丽米热·对山巴依,樊庆庚,苏艳
新疆农业大学 动物医学学院,新疆 乌鲁木齐 830052
为评价与比较马流产沙门菌 () 2种不同鞭毛蛋白FliC (Flagellin C) 和FljB (Flagellin B) 的免疫原性,为进一步利用这两种蛋白奠定实验基础,本研究诱导表达及纯化FliC和FljB蛋白,将纯化后的蛋白分别免疫小鼠,对免疫后小鼠的抗体水平、滴度及抗体亚型进行检测,攻击小鼠后进行免疫相关受体检测及病理组织学观察。结果显示,成功诱导表达了重组蛋白FliC和FljB,纯化后蛋白的相对分子量分别为52 kDa和42 kDa。两种蛋白分别免疫小鼠,产生较高水平的特异性抗体IgG,FljB免疫组抗体水平高于FliC免疫组,且抗体亚型以IgG1为主。FljB免疫组攻击保护率为87.5%,高于FliC免疫组的75%,病理组织学及脏器荷菌数检测结果显示,FljB免疫组效果优于FliC免疫组;FljB免疫组诱导TLR2、TLR4、MHC-I、TCR (T细胞抗原受体) 的水平均高于FliC免疫组。该结果表明,FljB免疫组诱导小鼠免疫应答的水平高于FliC免疫组。
马流产沙门菌,FliC蛋白,FljB蛋白,免疫原性
马流产沙门菌可引起怀孕母马流产,还可引起初生幼驹败血症或局部炎症、公马鬐甲炎和睾丸炎,其感染可给养马业造成严重的经济损失[1]。鞭毛不仅是该菌的运动器官,还直接影响其致病性及对宿主细胞的黏附性和侵袭性。和基因分别编码沙门菌鞭毛蛋白的第一相和第二相鞭毛抗原,这2种基因交替表达,构成鞭毛的相变换。大肠杆菌LF82菌株在缺失编码蛋白的基因后,丧失了对肠上皮细胞的黏附和侵袭功能[2]。
天然的抗鞭毛免疫应答可对机体起到保护作用[3]。迟缓爱德华重组菌[4]及鼠伤寒沙门菌重组鞭毛蛋白FliC免疫小鼠,可诱导其产生较高水平的特异性抗体[5]。研究表明鞭毛蛋白还具有免疫增强作用,促进吞噬细胞的吞噬作用,参与诱导分泌前炎症细胞因子,介导激活T细胞和B细胞免疫应答[6-8]。
以往的研究主要集中于鼠伤寒沙门菌、肠炎沙门菌及其他细菌的鞭毛蛋白,且大多集中在一种单相鞭毛蛋白上,马流产沙门菌鞭毛蛋白及其FliC和FljB两相不同鞭毛蛋白之间的免疫生物学特性的比较和分析研究报道较少。本研究表达纯化了马流产沙门菌FliC和FljB蛋白,用其免疫小鼠后,检测血清抗体水平、抗体亚型及相关免疫分子表达水平,检测了攻击保护率、攻击后的病理组织学变化及不同脏器的荷菌量,综合比较分析了重组蛋白FliC与FljB的免疫生物学特性的差异。
1 材料与方法
1.1 菌株和质粒
马流产沙门菌新疆分离株XJMS-97由新疆农业大学动物医学学院微生物实验室分离并保存,分别含重组质粒pET28a-FliC[9]和pET28a-FljB[10]的大肠杆菌BL21(DE3),由新疆农业大学动物医学学院微生物实验室构建并保存。
1.2 主要试剂
中等分子量蛋白标准购自大连宝生物工程有限公司;HRP-IgG购自北京中杉金桥生物技术有限公司;TMB显色液购自北京索莱宝科技有限公司;QuantiNovaTMSYBR®Green PCR Kit购自QIAGEN公司;其他相关化学试剂均为国产分析纯。
1.3 实验动物
实验用SPF级6周龄18−25 g雌性昆明鼠共计30只,购自新疆维吾尔自治区疾病预防控制中心实验动物研究中心。
1.4 重组蛋白FliC、FljB的诱导表达及纯化
将含有重组表达质粒pET28a-FliC、pET28a-FljB的大肠杆菌BL21(DE3),分别接种至含有50 μg/mL卡那霉素的LB液体培养基中,37 ℃、200 r/min振荡培养至600达到0.5–0.6时,加入终浓度为1 mmol/L的IPTG进行诱导。收集的菌体经超声破碎后,取其上清液加入Ni-NTA亲和层析柱,用不同浓度咪唑对目的蛋白进行洗脱,纯化后的蛋白用SDS-PAGE进行分析。
1.5 小鼠免疫
将30只小鼠随机分为4组,每组8只,分别为FliC免疫组、FljB免疫组和PBS对照组。将纯化后的pET-28a-FliC、pET28a-FljB重组蛋白与等体积弗氏佐剂混匀,经背部皮下多点注射免疫小鼠,每只0.5 mL (100 μg/mL),每隔2周免疫1次,共免疫2次。分别于初次免疫后0、14、35、42 d采血,分离血清−20 ℃保存备用。
1.6 免疫小鼠抗体水平、效价及抗体亚型的检测
以纯化后的FliC、FljB重组蛋白包被酶标板,100 ng/孔,过夜包被。37 ℃封闭2 h,PBST洗涤3次,将各组小鼠免疫血清按照1∶300、1∶900、1∶2 700等系列梯度稀释,加入酶标板中,37 ℃作用1 h,加1∶5 000稀释HRP标记的山羊抗鼠IgG、IgG1、IgG2a、IgG2b、IgG3作为二抗,100 μL/孔,37 ℃作用30 min,PBST洗涤5次,用TMB显色,终止反应,测定450值。
1.7 免疫FliC及FljB蛋白对该菌致死性感染的评估
初次免疫后42 d,用菌株XJMS-97分别对FliC免疫组、FljB免疫组和PBS对照组小鼠进行攻击,每只小鼠腹腔接种攻击菌2×108CFU,攻击后连续14 d观察并记录小鼠的发病和死亡情况,并计算保护率。
1.8 不同脏器定殖细菌的检测
攻击后第3天,处死小鼠取肺、肝、脾和肾,加入灭菌PBS进行充分匀浆,1∶10梯度稀释后取100 μL涂布于THB固体培养基,37 ℃过夜培养;对培养细菌计数。
1.9 病理组织学观察
攻击后第10天,分别取各试验组存活小鼠肝、脾、肺和肾组织置于10%福尔马林溶液中固定,制作石蜡切片,H.E.染色,观察各脏器的病理组织学变化。
1.10 免疫小鼠攻击后细胞因子的检测
攻击后第3天,取各免疫组脾脏,提取细胞总RNA,以反转录后的cDNA为模板,根据GenBank中TLR2、TLR4、TCR、MHC-I、β-Act的基因序列,使用Primer Premier 5.0设计实时荧光定量PCR检测引物,由生工生物工程 (上海) 股份有限公司合成 (表1)。按照以下参数进行qPCR扩增。反应体系为:2×SYBR Select Master Mix 10 μL,正向引物0.25 μL,反向引物0.25 μL,QN ROX Reference Dye 2 μL,模板1 μL,ddH2O 7.5 μL。反应条件为:95 ℃预变性5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃终延伸10 min。对PCR产物进行熔解曲线分析,检测免疫相关因子的表达,计算目的基因的拷贝。
1.11 统计学分析
采用SPSS19.0分析软件对数据进行统计学分析。

表1 实时荧光定量PCR的引物序列
2 结果与分析
2.1 重组蛋白的表达及纯化
pET28a-FliC和pET28a-FljB重组菌经诱导表达后经SDS-PAGE,分别在52和42 kDa左右处出现明显的蛋白条带 (图1A和1B),与预期值相符,表明重组目的蛋白成功诱导表达。
2.2 免疫小鼠的抗体检测
2.2.1 抗体水平及效价的检测
采用间接ELISA法,对免疫后0、14、35、42 d的抗体水平进行检测,检测结果显示,各免疫组在免疫后抗体水平均升高,第二次免疫后,抗体水平显著升高,FljB免疫组的抗体水平高于FliC免疫组和PBS对照组 (图2A)。抗体效价检测结果显示,FliC和FljB免疫组在第二次免疫后14 d,免疫抗体效价均可达到1∶72 900 (图2B)。
2.2.2 抗体亚型的检测
第二次免疫后14 d,小鼠血清中特异性抗体亚型的检测结果显示,FliC和FljB免疫组小鼠均产生了较高水平的IgG抗体,且产生的特异性抗体主要以IgG1亚型为主,FljB免疫组IgG1抗体水平高于FliC免疫组 (图3)。
2.3 小鼠免疫攻击后体内免疫相关分子表达水平的检测
攻击后3 d对免疫小鼠免疫相关分子测定结果显示,不同免疫组各细胞因子产生情况不同,与对照组相比各免疫组TLR2、TLR4、TCR、MHC-Ⅰ水平均明显升高,且FljB免疫组4种免疫相关分子的表达水平均明显高于FliC免疫组 (图4)。

图1 重组蛋白FliC (A) 和FljB (B) 的SDS-PAGE分析

图2 小鼠血清中特异性抗体水平和抗体滴度检测

图3 免疫小鼠血清抗体亚型水平检测结果

图4 荧光定量PCR检测免疫相关分子的表达水平
2.4 保护率检测
第二次免疫后14 d,用XJMS-97对各免疫组和PBS对照组进行攻击保护率测试,观察小鼠死亡情况。结果显示,FljB免疫组的存活率可达87.5%,FliC免疫组的存活率可达75%,PBS对照组小鼠在攻击后2 d内全部死亡(图5A)。用.攻击小鼠后,体重变化结果显示,FliC和FljB免疫组小鼠体重均在3 d后体重开始回升,5 d后体重基本恢复到攻击前正常范围(图5B)。
2.5 病理组织学观察
2.5.1 各实验组小鼠肺脏病理组织学观察结果
肺脏病理组织学观察结果显示(图6),与未攻击对照组相比,PBS对照组攻击死亡小鼠肺脏出血,肺泡间质增厚,肺泡间可见大量的炎性细胞浸润。FliC免疫组出现组织出血、肺间质增厚,FljB免疫组小鼠病理损伤程度较FliC免疫组轻,无出血。
2.5.2 各实验组小鼠脾脏病理组织学观察结果
脾脏病理组织学观察结果显示(图7),与对照组相比,PBS对照组小鼠攻击后脾脏可见脾小体周围出现大量出血、淤血。FliC与FljB组小鼠脾脏出现轻微的出血、充血,损伤程度相对较小。

图6 小鼠肺脏病理组织学观察结果(H.E染色)

图7 小鼠脾脏病理组织学观察结果(H.E.染色)
2.5.3 各实验组小鼠肝脏病理组织学观察结果
肝脏病理组织学观察结果显示 (图8),与对照组相比,PBS对照组攻击后小鼠肝脏出现淤血,肝间质充血,大量炎性细胞浸润。FliC免疫组肾间质出现轻微出血、淤血,肾小球髓质内出现少量淤血,而FljB免疫组出血不明显,与正常小鼠肝脏组织相似。

图8 小鼠肝脏病理组织学观察结果 (H.E染色)
2.5.4 各实验组小鼠肾脏病理组织学观察结果
肾脏病理组织学观察结果显示(图9),与对照组相比,PBS对照组攻击后小鼠肾髓质与肾小管中出现大量淤血,肾间质充血,大量炎性细胞浸润。FliC免疫组肾脏组织有明显病变,肾间质出血、淤血,肾小球髓质内出现少量淤血,而FljB免疫组未见明显病变,与正常小鼠肾脏组织相似。

图9 小鼠肾脏病理组织学观察结果(H.E染色)
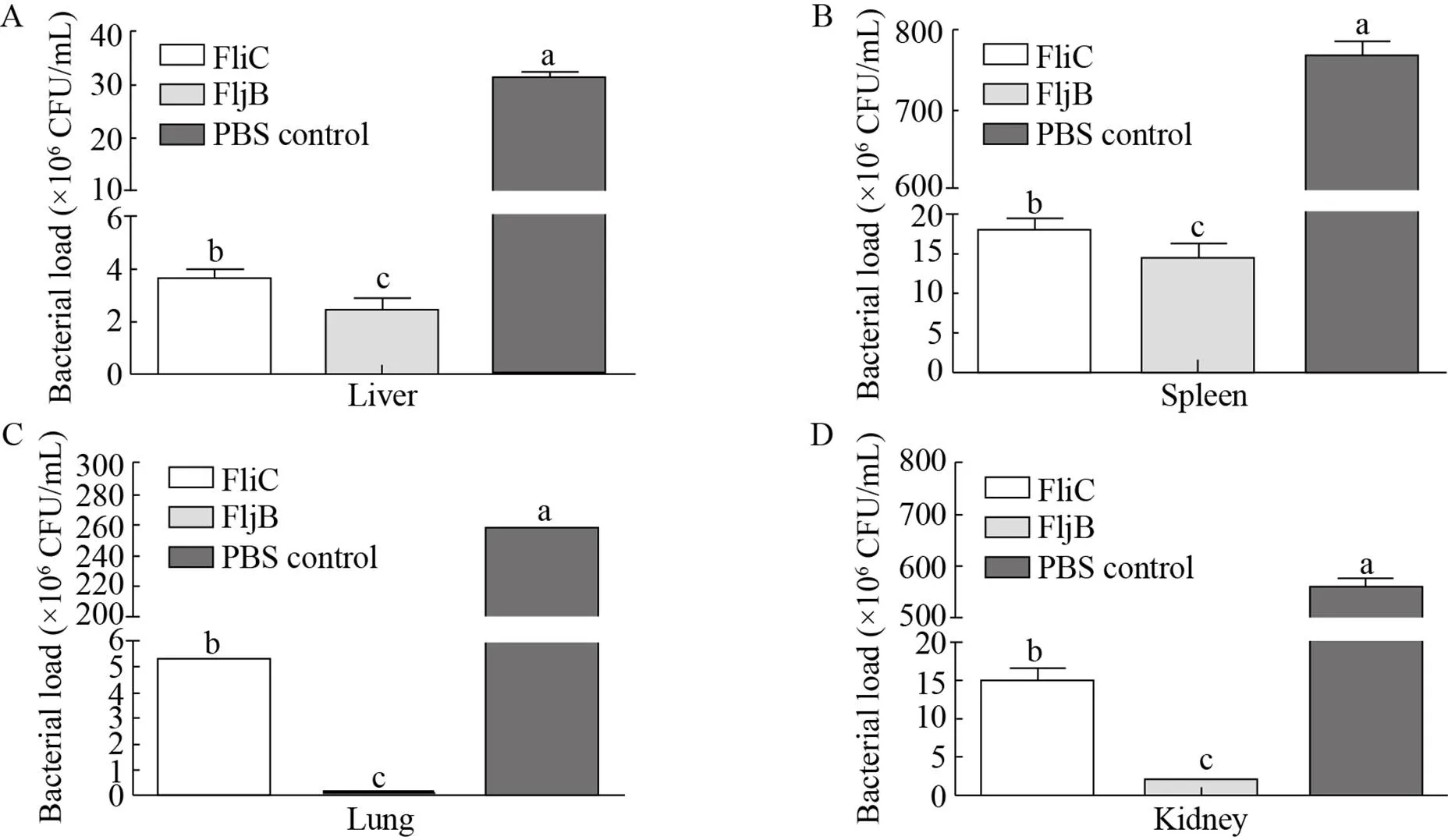
图10 小鼠脏器荷菌量检测结果
2.6 荷菌数检测结果
免疫小鼠攻击后,检测小鼠肺脏、脾脏、肾脏和肝脏组织荷菌数。结果表明,各免疫组小鼠肺脏、脾脏、肾脏和肝脏组织荷菌数均显著低于PBS对照组,FljB免疫组小鼠肝脏、脾脏、肺脏、肾脏组织荷菌数明显低于FliC免疫组 (图10)。
3 讨论
的鞭毛蛋白是一种强有力的先天和特异性免疫的启动剂,可在该菌的运动、黏附及侵袭宿主细胞等方面发挥重要作用[11]。研究显示,鞭毛蛋白可诱导机体产生先性和被动免疫应答从而增强抗原特异性淋巴细胞对抗病原体的能力[12-14]。此外细菌鞭毛蛋白可以促进树突状细胞成熟增加抗原的递呈效率,对机体免疫应答起到增强作用[15]。
史冰田等[16]证明了用诱导表达及纯化后的肠炎沙门菌FliC重组蛋白免疫SPF鸡,其抗体效价达到了1∶12 800,产生了较高水平的特异性抗体。本研究纯化的第一相和第二相鞭毛蛋白FliC和FljB,免疫小鼠后均能诱导小鼠产生较高水平的特异性抗体。首次免疫后42 d,各免疫组小鼠血清抗体效价均达到了1∶72 900,抗体亚型主要以IgG1为主,这与赵亚南等[17]用马流产沙门菌FliC蛋白免疫小鼠后,可诱导小鼠产生较高水平的IgG1抗体研究结果一致。
TLR家族在启动先天免疫应答中占据重要的地位,TLR2和TLR4是TLR家族成员,通过对病原微生物及其产物的病原相关分子模式识别介导天然免疫反应。TLR2是革兰氏阳性菌脂蛋白的主要识别受体,TLR4仅识别革兰氏阴性菌细胞壁成分脂多糖。TLR2和TLR4在抗细菌感染中起着核心作用,在机体抵御细菌感染引发炎症反应发生过程中TLR2和TLR4可降低动物机体炎症反应发生的程度[18]。TLR5参与识别革兰氏阴性菌和革兰氏阳性菌的鞭毛蛋白[19]。MHC-I类分子在体内表达主要向CD8+T细胞的T细胞受体呈递抗原,并激活T细胞[20]。T细胞受体 (TCR) 的多样性是机体能对多种抗原进行识别和发挥作用的前提,TCR发挥作用时一般与抗原肽及MHC分子同时作用。本研究对免疫后小鼠体内相关免疫分子检测结果显示,各免疫组小鼠TLR2、TLR4、TCR和MHC-I等免疫相关分子表达水平均有明显升高,且FljB免疫组4种免疫相关分子的表达量显著高于FliC免疫组 (<0.05),各免疫组TLR2和TLR4表达量显著升高,TCR和MHC-I表达水平也有升高。
本研究对小鼠的攻击保护率结果显示,FljB和FliC免疫组攻击保护率分别为75%和87.5%。病理组织学观察结果表明,FljB免疫组各脏器出血、水肿、炎性细胞浸润和组织细胞变性等病理组织变化显著少于FliC免疫组。Eom等[21]研究结果表明,对免疫过鼠伤寒沙门菌重组鞭毛蛋白FliC和FljB小鼠攻击后,脾脏和肝脏的荷菌量明显低于对照组。本研究对小鼠不同脏器的荷菌量检测结果表明,FljB免疫组小鼠各脏器的荷菌量明显低于FliC免疫组。
综上所述,两相重组鞭毛蛋白FliC和FljB,能够刺激和诱导小鼠,产生特异性抗体,诱导TLR4、TLR2、TCR及MHC-I分子的表达,减少不同脏器的菌体载量以及保护小鼠抵抗攻击,此外证明了FljB蛋白在免疫原性和保护率方面的效果优于FliC蛋白,该结果为我们深入认识鞭毛蛋白的感染和免疫特性,进一步利用其进行诊断及疫苗的研究提供了实验基础。
[1] Yang K. Study on the identification and immunization ofisolated from Xinjiang and its FliC protein enhance effect on the humoral immune response of recombinant protein SeM and gD[D]. Urumqi: Xinjiang Agricultural University, 2016 (in Chinese). 杨康. 马流产沙门氏菌新疆分离株鉴定免疫及其FliC蛋白增强SeM蛋白及gD蛋白抗体应答的研究[D]. 乌鲁木齐: 新疆农业大学, 2016.
[2] Barnich N, Boudeau J, Claret L, et al. Regulatory and functional co-operation of flagella and type 1 pili in adhesive and invasive abilities of AIEC strain LF82 isolated from a patient with Crohn’s disease. Mol Microbiol, 2003, 48(3): 781–794.
[3] Péchiné S, Gleizes A, Janoir C, et al. Immunological properties of surface proteins of. J Med Microbiol, 2005, 54(2): 193–196.
[4] Zhang ZQ, Yang N, Li YH, et al. Prokaryotic expression and immune test of FliC protein of. Prog Vet Med, 2018, 39(7): 23–27 (in Chinese). 张志强, 杨楠, 李永慧, 等. 迟缓爱德华菌鞭毛蛋白FliC原核表达及免疫试验. 动物医学进展, 2018, 39(7): 23–27.
[5] Tian WJ, Liao CS, Wang XL, et al. Expression and biological characteristics of FliC of. Chin Vet Sci, 2017, 47(7): 810–816 (in Chinese). 田文静, 廖成水, 王晓利, 等. 鼠伤寒沙门菌鞭毛蛋白FliC的表达纯化及其生物学特性的研究. 中国兽医科学, 2017, 47(7): 810–816.
[6] Zhai XX, Wen ZC, Shen XF, et al. Cloning and prokaryotic expression offlagellin flaA. Chin Anim Husband Vet Med, 2014, 41(7): 40–43 (in Chinese). 翟新新, 温振才, 沈雪飞, 等. 维氏气单胞菌鞭毛蛋白flaA的克隆及原核表达. 中国畜牧兽医, 2014, 41(7): 40–43.
[7] Lee SE, Kim SY, Jeong BC, et al. A bacterial flagellin,FlaB, has a strong mucosal adjuvant activity to induce protective immunity. Infect Immun, 2006, 74(1): 694–702.
[8] Ramos HC, Rumbo M, Sirard JC. Bacterial flagellins: mediators of pathogenicity and host immune responsesin mucosa. Trends Microbiol, 2004, 12(11): 509–517.
[9] Yang K, Yi YY, Zhao YN, et al. Prokaryotic expression of FliC protein ofand immune protection test in mice. Chin Vet Sci, 2017, 47(12): 1549–1554 (in Chinese). 杨康, 易鸳鸯, 赵亚南, 等. 马流产沙门菌鞭毛重组蛋白FliC的原核表达及对小鼠的免疫保护试验. 中国兽医科学, 2017, 47(12): 1549–1554.
[10] Chang JX, Li SC, Li Y, et al. Expression and immunogenicity analysis of FljB ofin mice. Chin J Vet Sci, 2018, 38(4): 682–686 (in Chinese). 常建新, 李善春, 李阳, 等. 马流产沙门菌鞭毛蛋白FljB的表达及对小鼠免疫效果的分析. 中国兽医学报, 2018, 38(4): 682–686.
[11] Zhu CH, Dong LW, Zhang JY, et al. Effects ofgene deletion on the formation of biofilm in. Chin J Pre Vet Med, 2016, 38(4): 303–306 (in Chinese). 朱春红, 董立伟, 张江英, 等. 鞭毛素基因的缺失对肠炎沙门氏菌生物膜形成的影响. 中国预防兽医学报, 2016, 38(4): 303–306.
[12] Skountzou I, Martin Mdel P, Wang BZ, et al.flagellins are potent adjuvants for intranasally administered whole inactivated influenza vaccine. Vaccine, 2010, 28(24): 4103–4112.
[13] Taylor DN, Treanor JJ, Strout C, et al. Induction of a potent immune response in the elderly using the TLR-5 agonist, flagellin, with a recombinant hemagglutinin influenza-flagellin fusion vaccine (VAX125, STF2.HA1 SI). Vaccine, 2011, 29(31): 4897–4902.
[14] Hajam IA, Dar PA, Chandrasekar S, et al. Co-administration of flagellin augments immune responses to inactivated foot-and-mouth disease virus (FMDV) antigen. Res Vet Sci, 2013, 95(3): 936–941.
[15] Guo ZY, Zhou MX, Duan QD, et al. Advance on the pathogenicity and immunological application of bacterial flagella–A review. Acta Microbiol Sin, 2014, 54(3): 251–260 (in Chinese). 郭志燕, 周明旭, 段强德, 等. 细菌鞭毛的致病性及其免疫学应用的研究进展. 微生物学报, 2014, 54(3): 251–260.
[16] Shi BT, Wang GL, Guo J, et al. Prokaryotic expression, purification and polyclonal antibody preparation of FliC protein of. Chin Vet Sci, 2016, 46(1): 8–12 (in Chinese). 史冰田, 王高玲, 郭杰, 等. 肠炎沙门菌鞭毛蛋白的原核表达纯化及其多克隆抗体的制备. 中国兽医科学, 2016, 46(1): 8–12.
[17] Zhao YN, Yang K, Zhang BJ, et al. Immune efficacy analysis of flagellin protein FliC ofon SeM ofsubsp,. Acta Veterin Zootechin Sin, 2018, 49(5): 1020–1026 (in Chinese). 赵亚南, 杨康, 张宝江, 等. 马流产沙门菌鞭毛蛋白FliC对马腺疫链球菌SeM蛋白免疫效应分析. 畜牧兽医学报, 2018, 49(5): 1020–1026.
[18] Andersen-Nissen E, Smith KD, Bonneau R, et al. A con-served surface on Toll-like receptor 5 recognizes bacterial flagellin. J Exp Med, 2007, 204(2): 393–403.
[19] Oliveira M, Gleeson M. The influence of prolonged cycling on monocyte Toll-like receptor 2 and 4 expression in healthy men. Eur J Appl Physiol, 2010, 109(2): 251–257.
[20] Lv D, Shen YQ, Peng YQ, et al. Neuronal MHC class I expression is regulated by activity driven calcium signaling. PLoS ONE, 2015, 10(8): e0135223.
[21] Eom JS, Kim JS, Jang JI, et al. Enhancement of host immune responses by oral vaccination toserovarharboring both FliC and FljB flagella. PLoS ONE, 2013, 8(9): e74850.
Comparison of immunogenicity between recombinant flagellins C and B of
Hao Wang, Yuanyang Yi, Duishanbayi·Gulimire, Qinggeng Fan, and Yan Su
,,830052,,
To evaluate and compare of the immunogenicity differences of flagellins FliC and FljB ofand lay the experimental foundation for the further utilization of the two recombinant proteins, FliC and FljB recombinant proteins were induced, expressed and purified. The purified FliC and FljB were used to immunize mice separately. The antibody level, titer and subtype of mice serum were detected after immunization. Immune-related receptors and histopathological changes were observed in immunized mice after challenged. The recombinant proteins FliC and FljB were successfully induced and expressed. Proteins of about 52 kDa and 42 kDa were purified. High levels of specific IgG antibodies were induced in mice immunized with these two proteins, the antibody level of FljB-immunized group was higher than that of FliC-immunized group, and IgG1 was the dominant subtype of antibody. The challenge protection rate of the FljB-immunized group was 87.5%, higher than that of FliC immunized group. Bacterial loads and observation pathological of FljB-immunized group were better than that of FliC immunized group, the levels of TCR2, TCR4, MHC-I and TCR induced by FljB-immunized group were higher than those of FliC-immunized group. The of immune response induced by FljB group was better than that of FliC group.
, flagellin C, flagellin B, immunogenicity
王浩, 易鸳鸯, 古丽米热·对山巴依, 等. 马流产沙门菌重组鞭毛蛋白FliC和FljB免疫原性比较. 生物工程学报, 2020, 36(1): 57–66.
Wang H, Yi YY, Gulimire·Duishanbayi, et al. Comparison of immunogenicity between recombinant flagellins C and B of. Chin J Biotech, 2020, 36(1): 57–66.
April 13, 2019;
July29, 2019
Supported by: University Scientific Research Projects of Xinjiang Uygur Autonomous Region (No. XJEDU2018I009).
Yan Su. Tel: +86-991-8762704; E-mail:2006au@163.com
10.13345/j.cjb.190135
新疆维吾尔自治区高校科研计划 (No. XJEDU2018I009) 资助。
2019-08-27
http://kns.cnki.net/kcms/detail/11.1998.q.20190827.0936.001.html
(本文责编 陈宏宇)
