表面等离子体共振免疫传感器检测喹乙醇
2020-03-11谢春花王敏思王霞琳张志军
谢春花,柳 双,王敏思,王霞琳,王 珅,张志军,宋 洋,*
(1.天津师范大学生命科学学院,天津市动植物抗性重点实验室,天津 300387;2.国家农产品保鲜工程技术研究中心(天津),天津市农产品采后生理与贮藏保鲜重点实验室,天津 300384)
喹乙醇(olaquindox,OLA)是一种化学合成的生长促进剂而不是抗生素药物,可促进机体蛋白质合成代谢,提高饲料能量利用率,因此加快了生长发育,提高了个体瘦肉率[1-3]。尽管当时缺乏毒性和潜在机制的证据,OLA仍被广泛用作猪的饲料添加剂,以提高饲料转化效率[4-6]。近年来,在水产饲料中,OLA曾被称为“水产养殖瘦肉精”[7-8]。研究表明,大剂量的OLA可对动物产生毒性作用,并且OLA在体内累积,当在动物体内积累到一定程度时,会对动物和人类造成致畸、致癌和致突变作用。然而,该药物的毒性根据动物的种类不同变化很大。OLA对家禽和鱼类具有显著的毒性[9]和特定的遗传毒性[10]。因此,欧盟自1999年以来完全禁止使用OLA[11-12]。2018年1月11日,农业部第2638号公告公布,自2018年5月1日起,限制使用OLA[13]。澳大利亚允许猪和禽肉中OLA的最大残留限量为300 µg/kg[14]。在日本,猪肉、鸡肉和其他动物的OLA最大残留限量控制在300 µg/kg之内。
目前表面等离子体共振(surface plasmon resonance,SPR)技术被广泛用于食品安全检测。Karczmarczyk等[15]研究了一种基于竞争性免疫测定的策略,使用与酶(碱性磷酸酶)结合的二抗作为标记,改良的金丝网印刷电极(screen-printed gold electrode,AuSPE)对霉菌毒素(赭曲霉毒素A和黄曲霉毒素M1)进行伏安检测,检出限到µg/L级别。Amjadi等[16]建立了基于银纳米棱柱(Ag nanoprisms,AgNPRs)的形态转化开发了一种灵敏的比色探针检测超痕量Se(IV),检出限为1.2 µg/L。该方法用于水和食品样品的分析。Song Yang等[17]使用PH-BSA固定的传感器芯片的SPR免疫测量苹果、桃子、卷心菜等样品中的亚胺硫磷残留量,样品的最低检出限为1.6 ng/L。赵芳等[18]采用表面自组装技术在金膜的表面修饰羧基基团,将玉米赤霉烯酮(zearalenone,ZEN)抗原与牛血清白蛋白(bovine serum albumin,BSA)偶联物(ZENBSA)通过共价键固定在芯片的表面,采用竞争法检测样品中的玉米赤霉烯酮毒素,检出限为8.2 µg/L。Pan Mingfei等[19]基于抑制形式制备了可重复的SPR免疫传感器,用于稳定和灵敏地检测动物源性食品中的4 种磺胺类药物,对纯牛奶、鸡蛋、鸡肉、牛肉与鱼样品进行检测,检测周期可在不到5 min内完成,每个SPR芯片可重复使用300 个分析周期。Zhang Lili等[20]以4-乙烯基苯硼酸为功能单体,聚乙二醇丙烯酸酯和2,2’-偶氮异丁基脒盐酸盐为交联剂和引发剂,制备了卡那霉素分子印迹SPR传感器对奶粉和蜂蜜中的卡那霉素进行检测。与非印迹传感器相比,印迹传感器对卡那霉素具有更好的印迹效果和选择性。潘明飞等[21]针对花生中高毒污染物黄曲霉毒素B1(aflatoxin B1,AFB1),开发一种可再生循环使用的抑制型SPR免疫传感器。该实验检出限(IC15)为0.004 9 µg/L,灵敏度(IC50)达到0.025 µg/L;对花生样品中AFB1的检出限(IC15)和灵敏度(IC50)分别达到0.13 µg/kg和0.74 µg/kg。
用于检测OLA免疫分析方法研究[22-24]有很多。Zhao Dan等[25]开发了用于测定动物饲料样品中OLA的高灵敏度和特异性间接竞争性酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)。OLA由N’N-羰基二咪唑激活并与BSA和卵清蛋白(ovalbumin,OVA)偶联。发现两种抗血清的灵敏度和特异性非常相似,IC50值分别为16 ng/mL和19 ng/mL。Zhao Dongyan等[26]通过使用亲水性分子印迹薄膜引入了一种替代生物抗体的新方法,开发了一种快速、新型的直接竞争仿生ELISA法测定雏鸡饲料中的OLA。在最佳条件下,灵敏度(IC50)和检出限(IC15)分别为(700f60)µg/L和(17.0f1.6)µg/L。Le Tao等[27]开发了免疫色谱(immunochromatography,ICG)条带,用于同时定量测定动物饲料中的5 种喹喔啉-1,4-二氧化物。为此目的,将具有基团特异性喹喔啉-1,4-二氧化物的多克隆抗体(PcAb)与胶体金颗粒缀合,作为ICG条带的检测试剂以测试喹喔啉-1,4-二氧化物。该方法在5~10 min内实现了喹喔啉-1,4-二氧化物的半定量检测。喹烯酮、喹赛多、卡巴氧、痢菌净和OLA条带的视觉下检出限分别为10、15、15、20 ng/mL和20 ng/mL。使用ICG条带读数器,对于喹烯酮、喹赛多、卡巴氧、痢菌净和OLA,分别计算IC50为9.1、13.5、16.6、20.2 ng/mL和21.3 ng/mL。Pei Xingyao等[28]建立了一种简单、快速、超灵敏、定量的金免疫层析法,用于分析动物饲料样品和地表水样品中的OLA,优化方法的IC50为饲料3.35 μg/L,环境水0.35 μg/L。Peng Tao等[29]基于荧光微球的ICG法已被建立用于同时检测环境水和动物食品中的5 种经典喹喔啉。在最佳条件下,它在15 min内实现了对5 种喹喔啉的定性和定量检测。环境水和动物食品中5 种喹喔啉的目测检出限分别为5~15 µg/L和100~250 µg/kg。
本实验拟建立一种基于SPR的免疫传感器,用于高效灵敏地检测动物饲料和水产养殖水中的OLA。基于全抗原芯片的SPR免疫传感器,并对实际样品进行测定。此外,针对芯片的寿命,对同源的单、多克隆OLA抗体结合芯片的稳定性进行比较。该实验可为实际样品中OLA的检测提供理论支持。
1 材料与方法
1.1 材料与试剂
饲料样品 天津市购;水样由天津市多个饲养池采集。
OLA(纯度99%)、喹烯酮(纯度99.6%)、卡巴多(纯度98.8%)、盐酸克伦特罗(纯度98%)、氯霉素(纯度99.9%) 美国Sigma Aldrich公司;乙酰甲喹(纯度97%) 加拿大TRC公司;1-(3-(二甲基氨基)丙基)-3-乙基碳二亚胺盐酸盐、N-羟基-琥珀酰亚胺(N-hydroxy-succinimide,NHS)、1-乙基-3-(3-(二甲基氨基)丙基)碳二亚胺(ethanolamine, 1-ethyl-3-(3-(di methylamino)propyl) carbodiimide,EDC)、乙醇胺(ethanolamine,EA)、10 mmol/L乙酸盐、10 mmol/L磷酸盐缓冲液(phosphate buffer saline,PBS)、甘氨酸(Gly)-HCl(10 mmol/L)、HCl、NaOH Harmonia Testing Technology天津股份有限公司。用PBS制备1.0h102mg/L OLA储备溶液并在25 ℃贮存。其他用甲醇稀释至500 mg/L的结构类似物,在4 ℃贮存。
OLA-OVA质量浓度为5.0 mg/mL,抗OLA抗体(单克隆和多克隆抗体)质量浓度均为4.3 mg/mL,由天津师范大学动植物抗性重点实验室制备。
1.2 仪器与设备
BIAcore 3000 SPR仪 美国GE公司;羧甲基化葡聚糖CM5芯片 德国Xantec公司;高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Thermo Finnegan公司。
1.3 方法
1.3.1 实验原理
将处理过的CM5芯片放入SPR仪器中。在基线稳定后,使用10 mmol/L PBS作为运行缓冲液。将NHS和EDC混合物注入仪器中以激活CM5芯片表面上的葡聚糖,注入OLA-OVA进行抗原的固定化。CM5芯片表面的葡聚糖活化后暴露出大量的羧基可以与OLA-OVA蛋白的氨基形成肽键,从而使OLA-OVA固定于芯片表面,用EA溶液封闭未结合的羧基位点。空白通道也做相应的处理。当目标抗体流过芯片表面时,抗体将特异性地与OLA-OVA结合,每次结合后用适合的再生液再生,再生液可以将结合的抗体与抗原断开,记录结合抗体后SPR信号的变化。流程如图1所示。
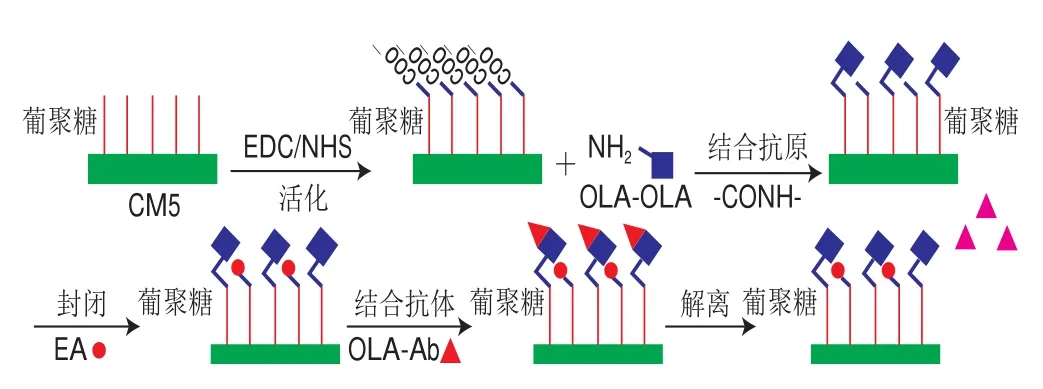
图1 SPR免疫传感器实验原理Fig. 1 Schematic demonstration of the principle of the SPR immunosensor
1.3.2 SPR方法建立
1.3.2.1 预富集与抗原固定
在激活芯片之前,进行预富集实验以确定OLA-OVA稀释剂的pH值和质量浓度,以提高偶联效率并降低配体消耗。原理参考Lu Yang等[30]。预富集可以确定抗原OLAOVA的最佳质量浓度和pH值条件。在该实验中,分别用pH 5.0、4.5和4.0的乙酸钠缓冲液将OLA-OVA稀释200、100、50、25 倍和10 倍。PBS作为运行缓冲液,流速为10 µL/min,分别将不同的处理抗原以每次10 µL的体积注入反应池中,每次反应后,用50 mmol/L NaOH溶液进行冲洗,观察响应值,确定抗原稀释液pH值及质量浓度。
EDC/NHS混合注入70 µL,活化芯片表面,将预富集选好的最适抗原质量浓度及pH值的抗原固定于芯片表面,PBS为运行缓冲液,流速10 µL/min,每次注入10 µL,根据固定的效果决定抗原固定量,用70 µL的EA封闭未偶联抗原的羧基,稳定基线10 min。
1.3.2.2 结合实验
使用10 mmol/L PBS作为运行缓冲液。将抗体分别稀释1 000、800、600、400 倍和200 倍,设置流速为20 µL/min,注射量为60 µL,解离时间为300 s,注入仪器与芯片表面的OLA-OVA进行结合。通过响应值判断结合程度,从而确定抗体的最佳质量浓度。每个质量浓度进行3 次注射,每次结合后用再生溶液进行再生,同时选择最佳再生溶液。在相同条件下,在注射抗体之前注射PBS作为对照组。
1.3.2.3 竞争实验
用PBS稀释OLA,使质量浓度为128、64、32、12、6、4、2、6 µg/L和0.1 µg/L。使用10 mmol/L PBS作为运行缓冲液,速率为20 µL/min。不同质量浓度OLA标准品和抗体以体积比1∶1混合,注射体积为60 µL,解离时间为300 s。通过响应值绘制OLA-OVA和OLA与OLA-Ab的结合曲线。每个OLA质量浓度重复3 次。
1.3.3 芯片的再生
芯片再现性是验证所建立的方法是否实用的重要评估参数。本实验比较4 种再生溶液:pH 2.2 Gly-HCl、pH 2.0 Gly-HCl、500 mmol/L NaCl和2.5 mmol/L NaOH。在每次结合实验后,分别重复注射4 种再生溶液2 次。观察并比较SPR响应的变化,选择最佳再生液。
1.3.4 交叉反应
所有结构类似物用PBS稀释至5 000、1 000、200、40、8 µg/L和1.6 µg/L。本实验选择的OLA结构类似物为喹烯酮、卡巴多、盐酸克伦特罗、氯霉素和乙酰甲喹。用IC50计算交叉反应率,如下式所示:

1.3.5 样品前处理
饲料从当地的超市购买,养殖水从天津的水产养殖场采集。在加标和回收实验之前,通过HPLC验证每个测试样品不含有OLA。
水样:(避光)取2 mL的水样于4 mL的离心管中,加入OLA储备液,使最终质量浓度为5、20 µg/L和40 µg/L。超声波60 ℃加热振荡15 min,然后过0.22 µm滤膜待测,每个质量浓度3 个平行。
饲料样品:(避光)称取1 g饲料于10 mL的离心管中,加入OLA储备液至5、20、40 µg/kg,加入2 mL水,60 ℃超声波加热15 min,以6 000 r/min离心10 min,取上清液。将上清液过0.22 µm滤膜后于4 ℃保存待测,每个质量浓度3 个平行。
1.3.6 样品测定
样品来自不同的超市与水产养殖场。样品处理同1.3.5节,不需添加OLA标准品溶液,处理后于4 ℃保存待测,每个样品重复测试3 次。
1.4 数据处理及图表绘制
每组数据的平行组均为3 组,数据统计结果均为平均值,关于SPR的直接响应值结果,在SPR仪上使用专门的软件Biacore进行图表绘制,其他图表用Origin进行绘制。
2 结果与分析
2.1 芯片预富集和抗原固定化
预富集实验中,用pH 4.0乙酸钠稀释时,抗原固定的效果明显高于其他pH值,抗原稀释10 倍时,结合量与稀释25 倍没有明显的增加,结果表明,OLA-OVA用pH 4.0乙酸钠缓冲液稀释,OLA-OVA的最佳稀释倍数为25 倍。选择原则是条件尽可能温和且成本低。
用EDC/NHS激活芯片。用pH 4.0的乙酸钠溶液将OLA-OVA稀释25 倍,以与芯片表面上的羧基结合。当注射体积为60 µL时,结合趋势基本保持不变。图2显示了绑定OLA-OVA到芯片表面的结果。
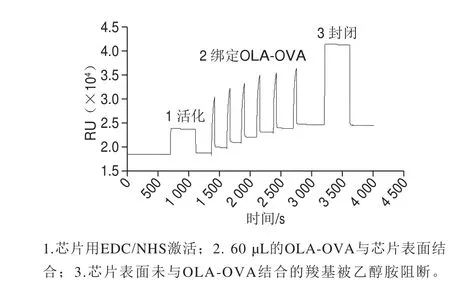
图2 芯片表面抗原的结合Fig. 2 Binding of antigen on the chip surface
2.2 抗体结合质量浓度的确定
将不同质量浓度的OLA-Ab与已结合到芯片表面的OLA-OVA进行结合。通过分析相应的响应值图,当抗体稀释200~400 倍,结合趋势减慢。为降低成本,确定OLA-Ab的最佳结合质量浓度为10.8 mg/L(抗体稀释400 倍)。每个质量浓度重复3 次,每次结合后要进行芯片的再生,结合结果如图3所示。
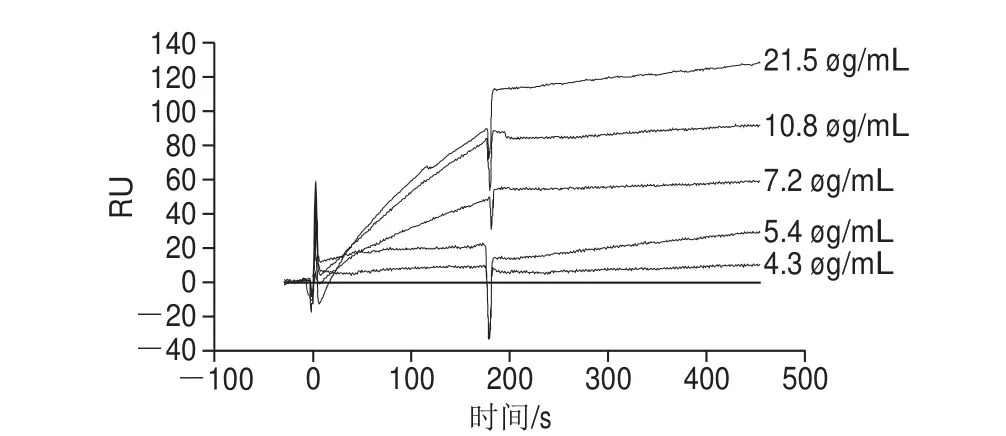
图3 不同质量浓度的抗体与OLA-OVA结合Fig. 3 Binding of different concentrations of antibodies to OLA-OVA
2.3 再生液的确定
如图4所示,经过实验对比,不同pH值的Gly-HCl不能将抗体与抗原分离,基线不能回到起始值,再生效果不理想;NaCl基线可以,但每次再生效果不稳定;NaOH再生效果良好,基线基本平坦,结合水平基本稳定,因此确定2.5 mmol/L NaOH溶液是最合适的再生剂。
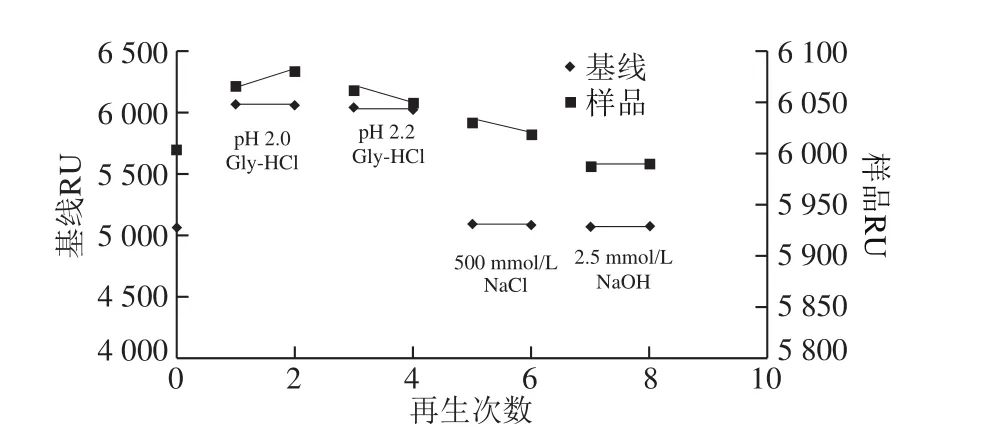
图4 不同再生剂的结果Fig. 4 Regeneration efficiencies of different regenerants
2.4 OLA标准曲线建立
传感器的检测原理基于分析物与其抗原的间接竞争性免疫反应。将抗体与OLA混合,混合物注入传感器芯片中。通过SPR检测与OLA-OVA结合的抗体,从而将SPR获得的响应与OLA质量浓度相关联。在该实验中,将OLA-Ab(10.8 mg/L)与等体积不同质量浓度的OLA混合,注入反应池。为OLA-OVA与0、0.6、2、4、6、12、32、64、128 µg/L OLA之间竞争抗体的结果见图5。

图5 OLA与OLA-OVA竞争结果Fig. 5 Results of competition between OLA and OLA-OVA
图6显示了抑制程度和OLA质量浓度之间的依赖性曲线,证明了OLA对OLA-Ab和OLA-OVA之间结合反应的抑制。抑制程度取决于与OLA-Ab混合的游离OLA质量浓度的线性变化。在最佳条件下,线性检测范围为0.5~64.0 µg/L OLA,检出限为0.5 µg/L(RSN=3),检测时间为10 min。
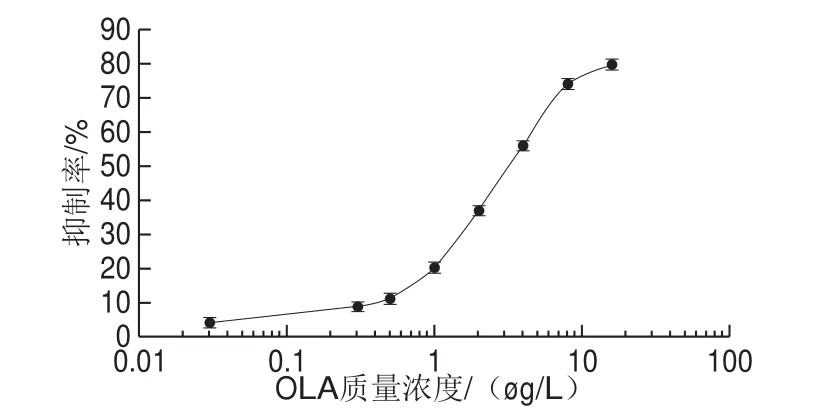
图6 OLA的SPR检测拟合性曲线Fig. 6 Standard curve for SPR detection of OLA
2.5 特异性确定
用SPR方法测定抗体与OLA及其结构类似物的交叉反应评估抗体的特异性。从表1可以看出,OLA抗体与OLA结构类似物(喹烯酮、卡巴多、盐酸克伦特罗、氯霉素和乙酰甲喹)的交叉率均小于5%,表明该抗体可以特异性地识别OLA。
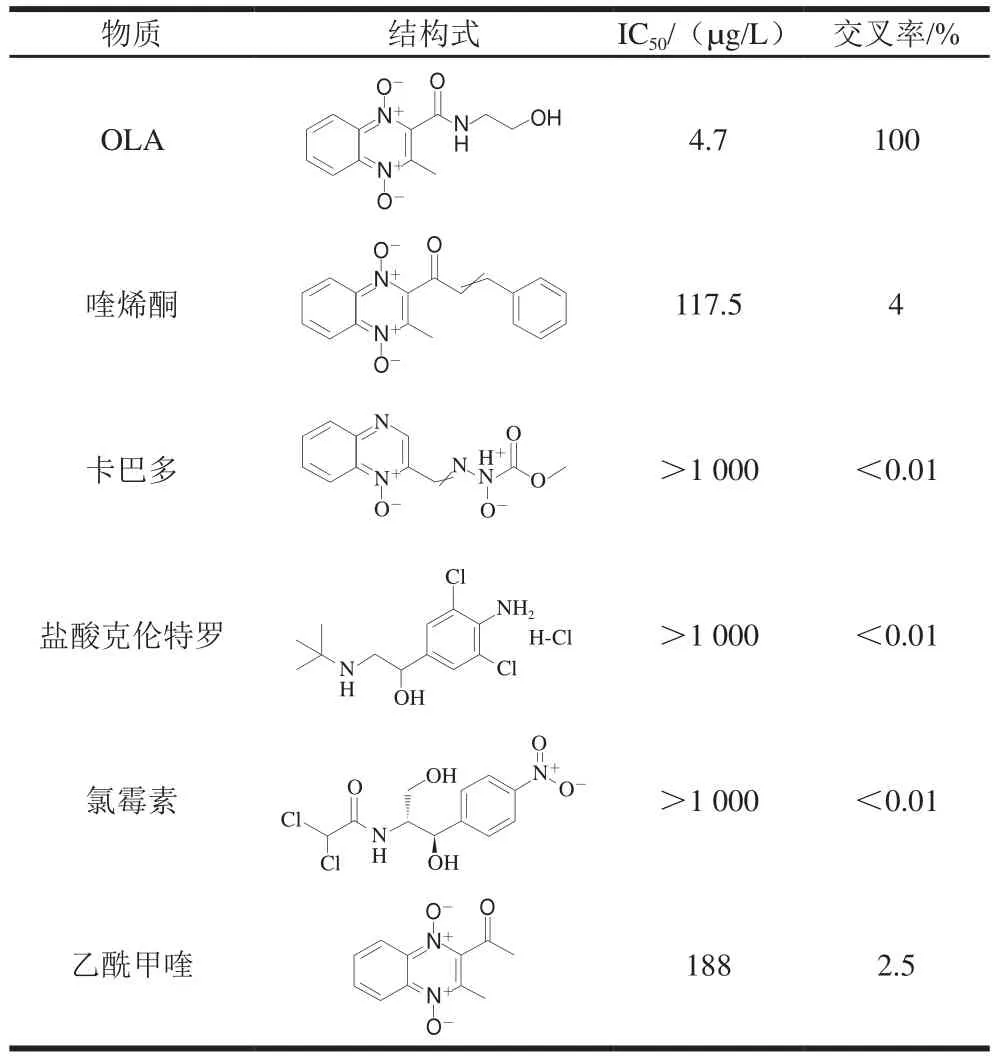
表1 SPR中OLA与OLA结构类似物的交叉反应Table 1 Cross-reactivity of OLA with analogues in SPR
2.6 样品检测结果
基质效应包括饲料中的维生素、蛋白质、脂肪和水产养殖水中的固体杂质和微生物。对于含有蛋白质和脂肪的鱼饲料和鸡饲料样品,通过离心、稀释和超滤可以简单地减少基质干扰。对于含有固体杂质和微生物的鱼养殖水和虾养殖水样,可以通过滤膜消除基质效应。
在养殖水和饲料样品中加入5、20、40 µg/L OLA标准品。如表2所示,养殖水样:回收率为84.7%~99.3%,变异系数(coefficients of variation,CV)为1.2%~8.3%。饲料样品:回收率为89.3%~93.4%,CV为2.3%~10.1%。实验测得鱼饲料、鸡饲料、鱼养殖水、虾养殖水中的测定灵敏度分别为8.9、8.7、5.5 µg/L和5.9 µg/L。证明该方法可以用于实际样品检测。
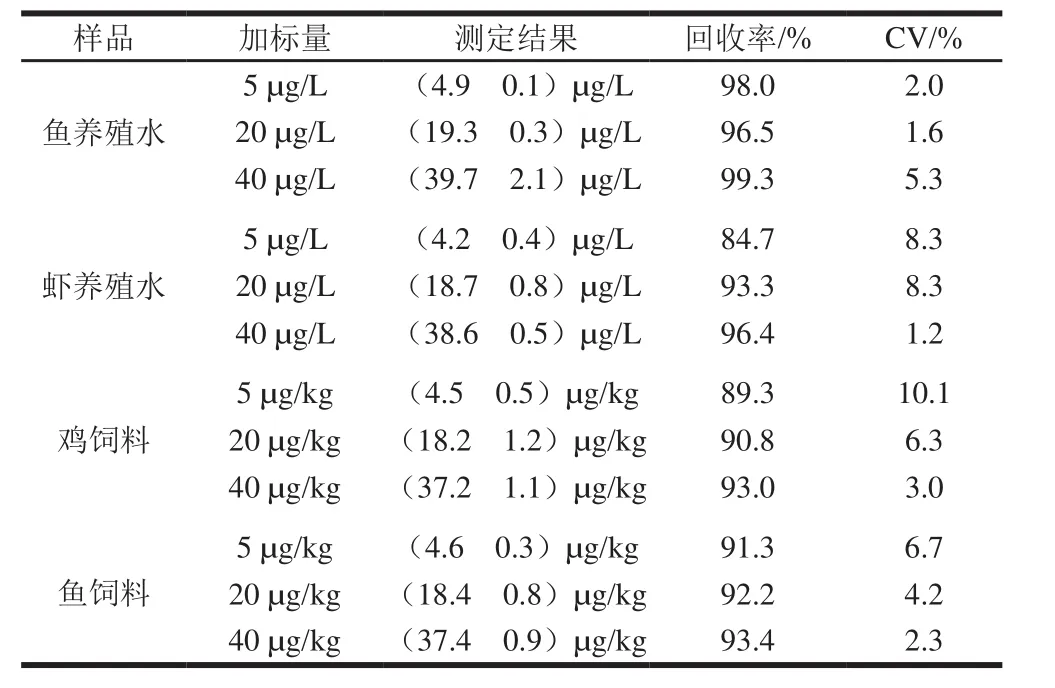
表2 SPR生物传感器在3 个水平下的样品回收率实验(n= 3)Table 2 Recoveries for samples at three spiked concentration levels (n= 3)
为验证该方法,同时用HPLC对样品进行添加回收实验,SPR与HPLC这2 种方法的检测结果呈线性关系,线性方程式为y=0.983 5x+0.152 8,相关系数为0.997 2,表明两种方法有较高的一致性。
建立的SPR方法用于检测不同来源实际样品水产养殖水和饲料中OLA的含量。多次检测结果,在鱼养殖水中,OLA质量浓度为5.0 µg/L,鸡饲料中OLA质量浓度为6.1 µg/L;虾养殖水与鱼饲料中均未检测到OLA,结果如表3所示。
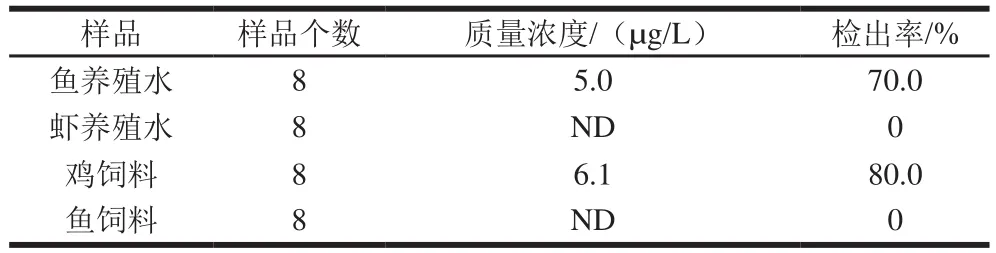
表3 SPR方法检测实际样品的结果(n=3)Table 3 Results for detection of OLA in actual samples with SPR (n= 3)
2.7 芯片重复性
实验对结合同源单、多克隆OLA抗体的芯片使用率进行了对比,表4表明,单克隆抗体的亲和性高于多克隆抗体,检测时间比较短,但结合同源多克隆OLA-Ab的芯片用2.5 mmol/L NaOH溶液再生60 次,活性衰减只有2.5%,而结合单克隆抗体的芯片同样再生15 次,芯片的活性衰减已经为11.7%,检出限与灵敏度也是多克隆抗体芯片比较好,因此,结合同源多克隆OLA-Ab,稳定性和芯片回收率较好,该实验芯片具有良好的重复性,可重复使用。

表4 多克隆OLA-Ab与单克隆OLA-Ab的对比Table 4 Comparison of polyclonal OLA-Ab with monoclonal OLA-Ab
虽然单克隆抗体的亲和力更强,但多克隆抗体可以识别多个表位,即使少量抗原表位被破坏或抗原的构象发生变化,实验结果也不会受到影响,同时成本比较低,目前大多研究中均使用多克隆抗体进行实验,在我们的工作中,使用多克隆OLA-Ab。
3 结 论
本实验开发了一种固定在CM5芯片表面的OLA-OVA的SPR生物传感器,用于检测饲料和水样中的OLA。该方法可以在样品中检测OLA时实现高效、快速、简便。样品检测可在10 min内完成,包括结合180 s、解离300 s和再生60 次。OLA质量浓度在0.5~64 µg/L内有良好的线性,建立了SPR标准曲线。结合同源多克隆OLA-Ab,SPR芯片良好的稳定性,可以重复使用60 个循环,响应值衰减小于5%。研究SPR对鸡饲料、鱼饲料、鱼养殖水和虾养殖水中OLA定量的测定,回收率为84.7%~99.3%,CV为1.2%~10.1%(n=3),并且该SPR方法与HPLC方法具有良好的一致性。而该方法的灵敏度是Zhao Dan等[25]采用间接竞争性ELISA检测OLA的3~4 倍,且成本低、时间短;是Zhao Dongyan等[26]采用新型的直接竞争仿生ELISA法测定雏鸡饲料中的OLA的136~161 倍;也比Le Tao等[27]开发的ICG条带检测法更灵敏,是它的4 倍;比Peng Tao等[29]基于荧光微球的ICG法建立的用于同时检测环境水和动物食品中OLA的方法,用的时间更短,检测更加灵敏。该SPR方法可用于全面快速和选择性检测饲料和水样品中OLA。
