HPLC-PDA法分析不同茶树品种类胡萝卜素香气前体
2020-03-11坤吉瑞童华荣
陈 丽,坤吉瑞,王 静,童华荣*
(西南大学食品科学学院,重庆 400715)
茶叶中的类胡萝卜素占干质量的0.032%~0.125%[1],不但可以作为色素影响干茶和叶底的色泽,还可在光合作用中起到光保护作用[2],同时还参与茶叶香气的形成,对茶叶品质具有重要贡献。类胡萝卜素作为香气前体降解产生的β-大马烯酮、β-紫罗兰酮、香叶醇、橙花叔醇、α-法呢烯等香气物质占成品茶香气总量的4.3%~46.5%[3],是茶叶香气的重要组成部分。
目前分离检测类胡萝卜素的方法有柱色谱-分光光度法[4]、薄层色谱扫描定量法[5]及高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)法[6]。分光光度法定量不够精确,薄层色谱法用混合溶剂作展开剂,经单波长扫描定量,较前者有所改善,但检测效率有待提高[7]。HPLC目前在茶叶中类胡萝卜素的分析检测中最为常用,但国内用于检测茶叶中类胡萝卜素的方法大多存在提取程序繁琐、检测到的类胡萝卜素种类少等问题[8-9]。Zapata等[10]建立的以C8反相色谱柱为基础,并通过在流动相中添加吡啶作为修饰剂改善峰形的二元梯度方法被认为是目前分离效果最好、最有前途的一个色素分析方法。邓春梅等[11]对该方法的有效性进行了验证,国际上对于其应用日益增多[12-13],但在国内的茶学领域未得到应用。
茶叶中类胡萝卜素的种类和含量受茶叶成熟度、季节、加工工艺及茶树品种等因素的影响。随着茶树叶片成熟度的增高类胡萝卜素总量增高,而叶黄素与胡萝卜素的比值却有所下降[1,8];在不同季节,茶叶中的类胡萝卜素表现为夏季最高,春季最低,秋季介于二者之间[14];茶叶加工过程中类胡萝卜素的含量减少,一般情况下,乌龙茶因用成熟芽叶为原料,类胡萝卜素含量最高,红茶发酵引起类胡萝卜素降解95%左右,含量最少,绿茶介于二者之间,较鲜叶减少80%以上[15];有研究分析中国西南、江南、华南3 个产区的31 个茶树品种的7 种类胡萝卜,总量在324.8~528.8 μg/g之间,且遗传因素对类胡萝卜素的影响相对于栽培环境更大[9]。目前鲜见有关不同适制性茶树品种中类胡萝卜素的研究。
本实验运用Zapata等[10]分析脂溶性色素的方法,分析37 个不同适制性茶树品种的类胡萝卜素,旨在阐明不同适制性茶树品种中类胡萝卜素的分布规律,为茶叶香气的形成机理研究及茶叶加工中的品种选择提供参考依据。
1 材料与方法
1.1 材料与试剂
37 个不同适制性茶树品种的一芽二叶均采于2017年秋季,其中仅适制绿茶的品种有15 种:巴渝特早(重庆南川);中茶102、鄂茶1号、芙蓉6号(湖北恩施);水晶茶、中白1号(四川宜宾);碧香早、渝茶1号、渝茶2号、渝茶3号、南江1号、龙井长叶、乌牛早、中选10号、紫笋(重庆永川)。仅适制红茶的品种有5 种:蜀永703、蜀永1号、蜀永2号、台湾大叶(重庆永川);云南大叶(重庆南川)。仅适制乌龙茶的品种有5 种:金萱、金匙(重庆永川);九龙袍、紫牡丹、308(四川宜宾)。具有兼制性的品种有12 种:金牡丹(绿茶、乌龙茶,四川宜宾);春兰、梅占(绿茶、红茶、乌龙茶,四川宜宾);蜀永307、菊花春、劲峰、褚叶齐、福丰20号、浙农117、崇批71-1(绿茶、红茶,重庆永川);大树茶(绿茶、红茶,重庆南川);福鼎大白(绿茶、红茶、白茶,重庆南川)[16-17]。鲜叶采下后立即放入液氮中处理,干冰低温保护下运输,冷冻干燥固样,磨碎后过40 目筛,-40 ℃冰箱中保存备用。
黄体素、玉米黄素、β-胡萝卜素(均为标准品)上海源叶生物科技有限公司;丙酮、甲醇、乙腈、冰乙酸(均为HPLC级) 成都市科龙化工试剂厂;无水吡啶(HPLC级) 美国Aladdin公司。
1.2 仪器与设备
雷磁PHS-25 pH计 上海仪电科学仪器股份有限公司;5810R离心机 美国Eppendorf公司;M20A HPLC仪日本Shimadzu公司。
1.3 方法
1.3.1 类胡萝卜素的提取与HPLC分析条件
参考Zapata等[10]的方法。
1.3.2 类胡萝卜素的定性定量
类胡萝卜素分子结构中所具有的发色团使其在紫外-可见光区有着独特的吸收区。目前,许多类胡萝卜素的紫外-可见吸收光谱特征已被确定,如最特征吸收波长等。因此,利用类胡萝卜素在紫外-可见光区的吸收光谱可对其进行定性分析[18-19l。本实验根据参考文献[10]中类胡萝卜素的特征吸收波长,结合Suzuki[20]、邓春梅[11]等的保留时间确定各类胡萝卜素的组分。
类胡萝卜素标准品价格昂贵且多数标准品在市场上没有销售,所以本实验仅使用3 个标准品制作标准曲线进行定量。除玉米黄素和β-类胡萝卜素根据各自的标准品定量外,其余各组分最大吸收波长与黄体素最为接近,均根据黄体素的标准曲线定量。各组分430 nm波长处均有一定强度的吸收峰,因此采用此波长条件下吸收峰的面积进行定量计算。
标准曲线的制作:精确称取黄体素20.000 mg,玉米黄素25.000 mg,β-类胡萝卜素25.000 mg,分别加10 mL二氯甲烷溶解,再加纯的冰丙酮将黄体素稀释成2.0、4.0、6.0、8.0、10.0 μg/mL,玉米黄素稀释成0.25、0.50、0.75、1.00、1.25 μg/mL,β-胡萝卜素稀释成0.5、1.0、1.5、2.0、2.5 μg/mL 5 个梯度的标准溶液,分别进样10 μL,绘制质量浓度与峰面积的标准曲线。
1.4 数据统计分析
采用SPSS 2.0进行显著性和主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 茶叶类胡萝卜素的定性分析
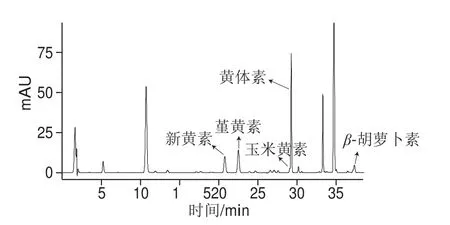
图1 茶叶中类胡萝卜素的HPLCFig. 1 HPLC analysis of carotenoids in tea leaves
对照文献的保留时间和特征波长,共确定15 种类胡萝卜素,与其他液相色谱检测方法相比,此方法分离出了茶叶中更多的类胡萝卜素组分,且玉米黄素与黄体素分离效果较好,如图1所示。因自然界中类胡萝卜素的种类繁多,且存在多种同分异构体,本实验检测到的几种类胡萝卜素组分特征吸收波长相近,因此其中9 种未能确定其具体结构。确定结构的6 种类胡萝卜素分别为新黄素、堇黄素、环氧玉米黄素、玉米黄素、黄体素以及β-胡萝卜素,如表1所示。
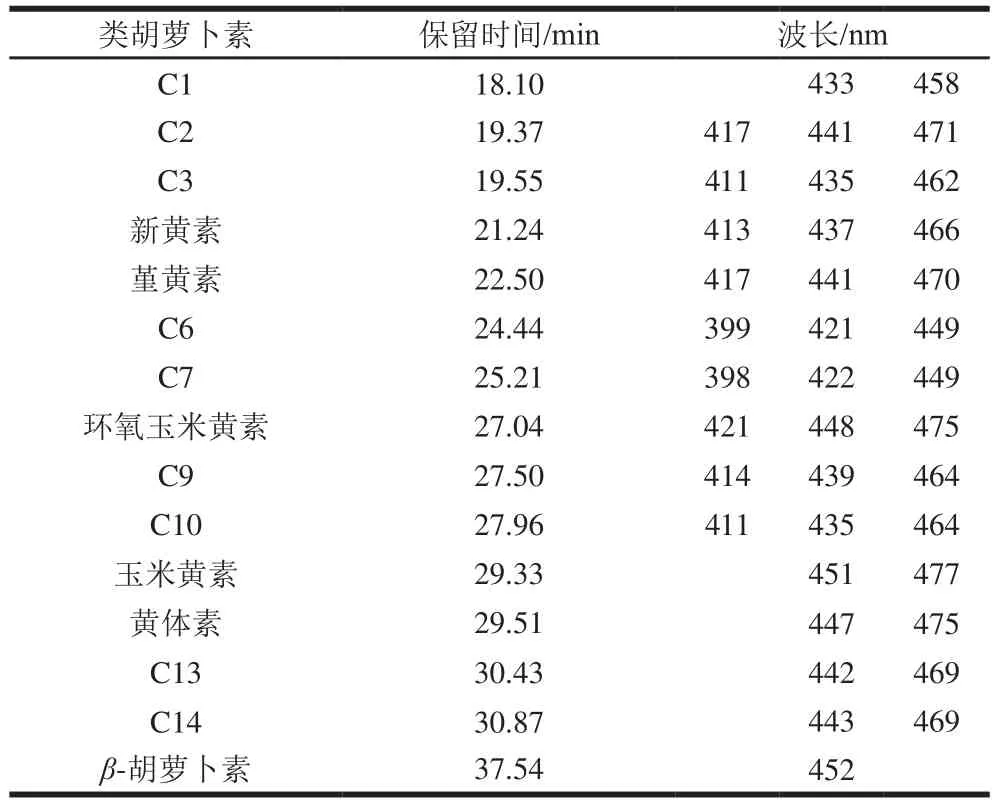
表1 类胡萝卜素的特征吸收波长Table 1 Characteristic absorption wavelengths of carotenoids
2.2 标准曲线的绘制
分别测定玉米黄素、黄体素、β-胡萝卜素3 个标准品5 个质量浓度梯度的峰面积,制作了质量浓度与峰面积的一次标准曲线如表2所示,相关系数R2均大于0.999 8,表明类胡萝卜素标准曲线可靠,可准确计算类胡萝卜素的绝对含量。

表2 类胡萝卜素标准曲线Table 2 Standard curves for three carotenoids
2.3 类胡萝卜素的测定结果
在被检测的37 个鲜叶样品中共同含有15 种类胡萝卜素,总量在524.6~1 236.7 μg/g之间,平均为(863.7f13.5)μg/g,样品间的差异十分显著。从表3可以看出,37 个被测样品所含类胡萝卜素各组分的含量虽然各不相同,但总体呈现相同趋势,即黄体素含量最高((314.6f2.0)μg/g,36.42%),其次是堇黄素((144.6f1.9)μg/g,16.74%)、新黄素((102.4f1.7)μg/g,11.86%)、β-胡萝卜素((66.6f1.6)μg/g,7.71%)和玉米黄素((56.3f1.2)μg/g,6.52%),这与Wei Xu等[9]的实验结果基本一致。
37 个品种中,适制乌龙茶的九龙袍和紫牡丹的黄体素含量较高,黄体素作为香气前体,会酶促氧化生成茶螺烯酮,茶螺烯酮是乌龙茶中对果香有贡献的重要香气物质[21]。适制红茶的云南大叶,适制乌龙茶的金萱、金匙,绿茶、红茶兼适制的蜀永307、劲峰中β-胡萝卜素含量都超过100 μg/g,β-胡萝卜素作为香气前体降解得到的β-紫罗酮对绿茶、红茶、乌龙茶甜香都有重要作用[22]。新黄素在绿茶、红茶兼适制的梅占和大树茶中含量最高,其酶解产生的β-大马烯酮是红茶茶汤的重要香气成分[23]。绿茶、红茶、白茶兼适制的福鼎大白类胡萝卜素总量最高为(1 236.7f9.5)μg/g,其中玉米黄素占25.59%,已有实验表明拟南芥、玉米等植物中的玉米黄素会在酶催化下降解为具有番红花香的藏花醛[24],而藏花醛同样在绿茶、红茶、乌龙茶及普洱中检出[3,25],说明茶叶中的藏花醛也可能由玉米黄素降解得到。总含量大于1 000 μg/g的茶树品种还有云南大叶(1 214.5 μg/g)、金萱(1 082.3 μg/g)、九龙袍(1 105.1 μg/g)、紫牡丹(1 114.6 μg/g)、308(1 003.2 μg/g)和梅占(1 068.4 μg/g),这些品种也可能加工成为高香型茶。
不同适制性的各类茶树品种所含类胡萝卜素各组分的平均值如表4所示,含量较高的组分中,除绿茶品种和红茶品种的黄体素和β-胡萝卜素无显著性差异外,4 种适制性品种的新黄素、堇黄素、环氧玉米黄素和玉米黄素均有显著性差异。各类品种的类胡萝卜素总量也存在显著性差异,乌龙茶品种的平均总量最高((1 046.0f13.9) μg/g),其次是红茶((889.4f12.8)μg/g ),绿茶含量最低((801.0f12.8))μg/g。
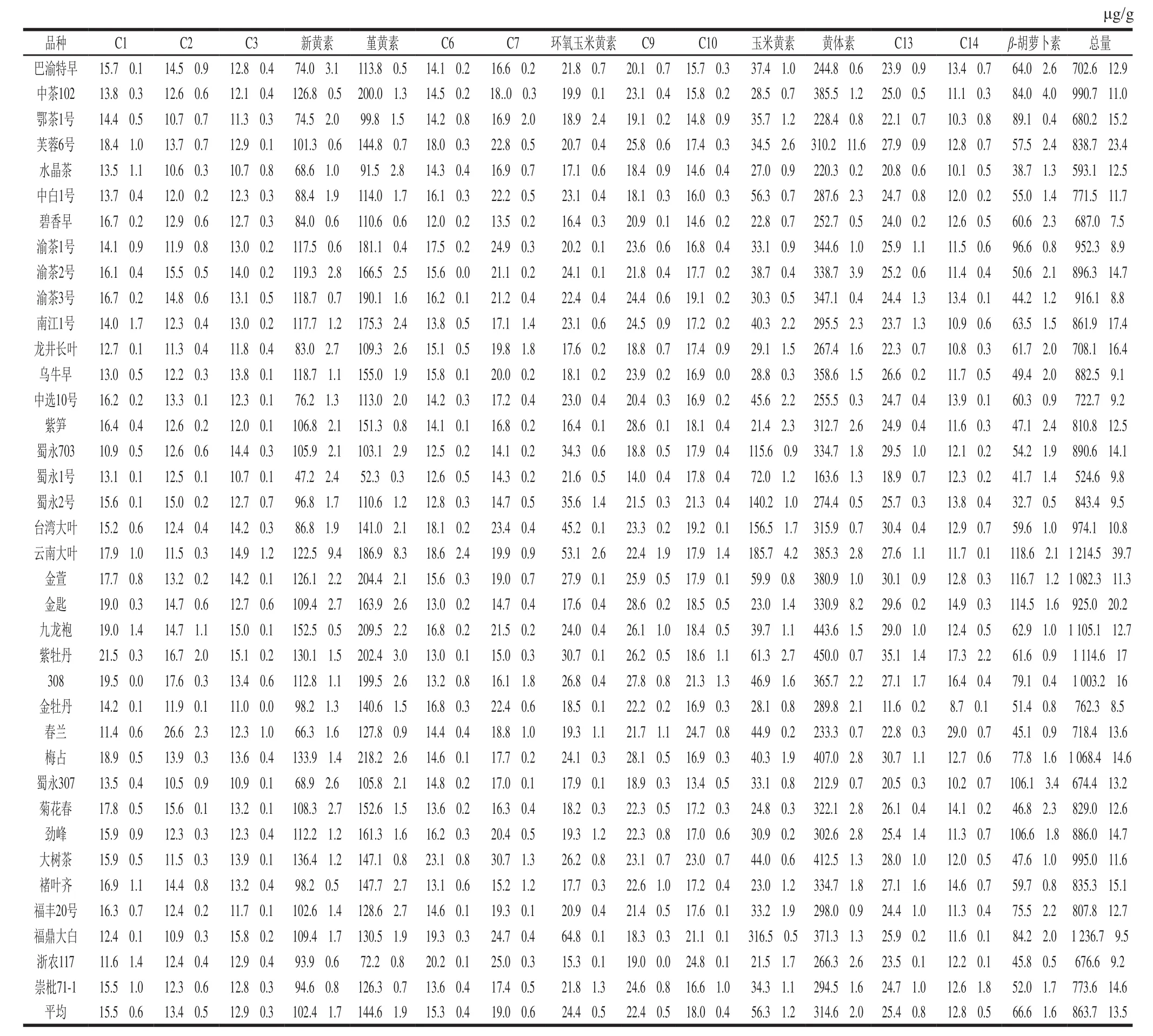
表3 37 个茶树品种中的类胡萝卜素含量Table 3 Kinds and amounts of carotenoids in 37 tea varieties
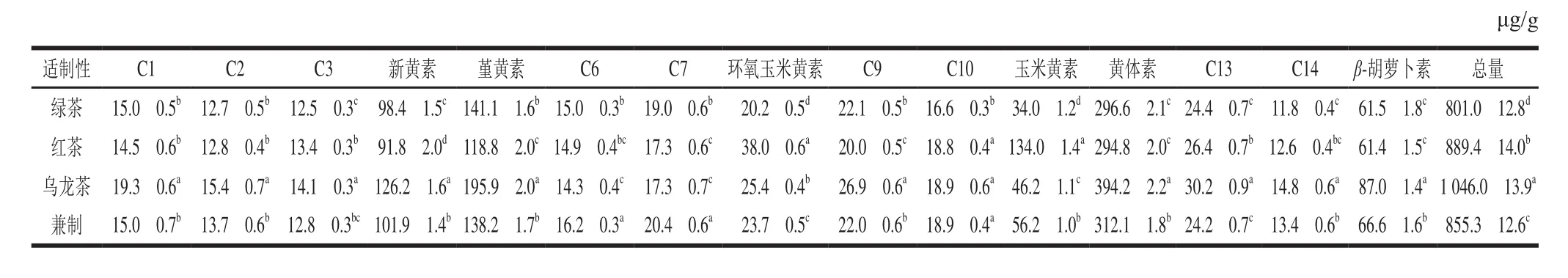
表4 不同适制性茶树品种类胡萝卜素含量Table 4 Carotenoid contents of tea leaves for different tea varieties
2.4 PCA结果
采用PCA法对检测结果进行统计学分析,以阐明样品类胡萝卜素组分及含量的内在规律[26]。15 种类胡萝卜素和37 个品种组成15h37的矩阵分析结果如下:抽样适合性检验值为0.637,P值为0,实验数据适合进行PCA。从表5可以看出,前4 种主成分累计方差贡献率达到82.919%,表明前4 个主成分能够基本解释37 个品种类胡萝卜素类香气前体的全部变量信息。
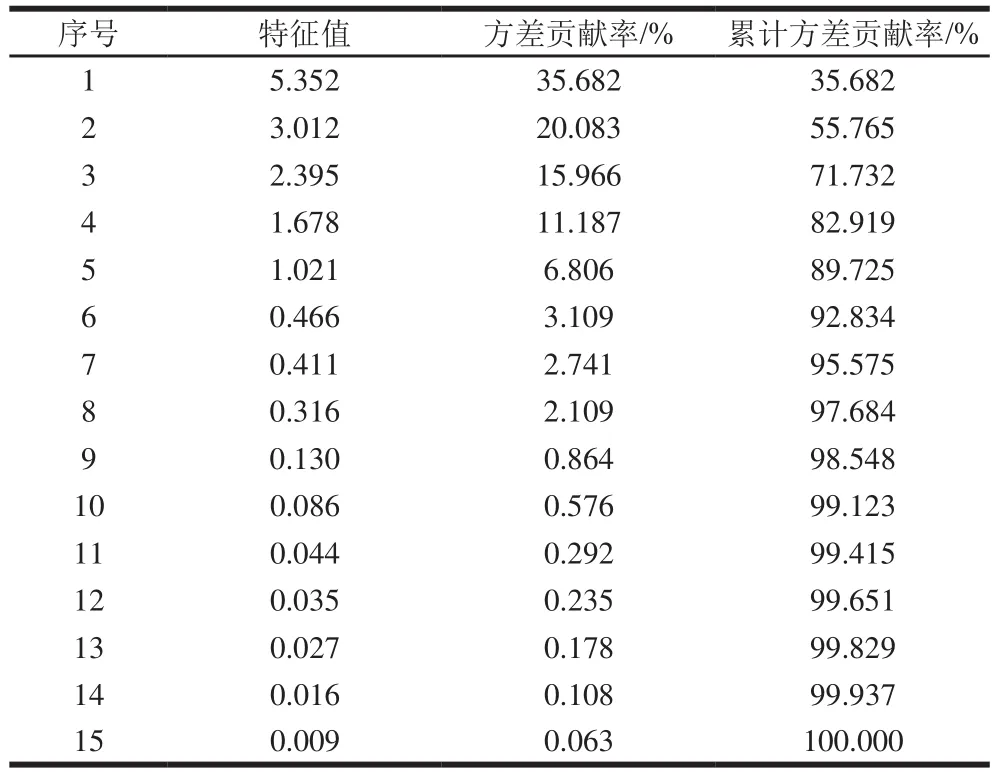
表5 主成分的特征值和方差贡献率Table 5 Eigenvalues and variance contribution rates of principal components
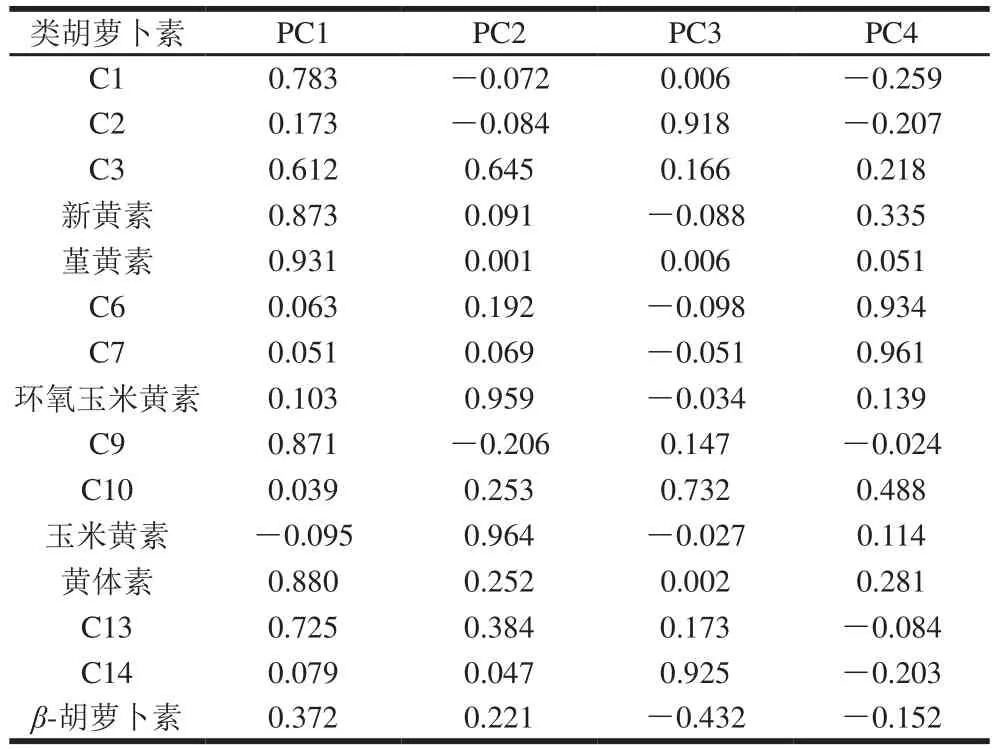
表6 前4 个主成分的载荷量Table 6 Loading capacities of fi rst four principal components
从表6可知,对PC1贡献较大的类胡萝卜素包括黄体素、堇黄素、新黄素、C9、C13和β-胡萝卜素等,这些是样品中含量较高的组分;对PC2贡献较大的是玉米黄素和环氧玉米黄素;在PC3有较大正载荷量的是C14、C2和C10;对PC4贡献较大的是C6和C7。
PC1和PC2累计贡献率最高的2 个主成分,37 个品种根据图2中各样品的相对位置,可以分析样品间的差异。相对位置越近,差异越小[27]。
如图2所示,37 个品种可以分为3 部分,PC1得分较高的5 个乌龙茶品种聚在图右侧,说明乌龙茶品种类胡萝卜素含量明显优于其他品种。黄体素酶促氧化可降解为花果香的茶螺烯酮;新黄素酶促氧化降解为玫瑰花香,李、柚等果香的β-大马烯酮;β-胡萝卜素可在物理、生物途径降解产生β-紫罗酮、二氢猕猴桃内酯、橙花叔醇和香叶基丙酮等多种香气物质。这可能是乌龙茶花果香浓郁,香气物质含量丰富的原因。图2上方分布着适制红茶的蜀永703、蜀永2号、台湾大叶、云南大叶和具有兼制性的福鼎大白,分布较为分散,说明玉米黄素和环氧玉米黄素对红茶的影响较大。玉米黄素、环氧玉米黄素参与叶黄素循环,二者之间根据光照情况可相互转化[28],类胡萝卜素裂解双加氧酶可催化玉米黄素降解为3-羟基-β-紫罗酮[29],红茶加工过程中也有该香气物质的形成,但其转化机理尚不明确[24]。其余27 个品种密集分布在X轴附近成为另外一类,它们在PC1和PC2上的得分均不高,说明其类胡萝卜素含量较低。

图2 37 个品种主成分得分图Fig. 2 Scores plot of PC1 versus PC2 for 37 tea varieties
从图2可以看出,福鼎大白和云南大叶是2 个较为特殊的品种。福鼎大白在PC2上有很高的得分,而在PC1上得分为负,原因是其含有很高的玉米黄素造成的。类胡萝卜素不但可以作为香气前体对茶叶香气有贡献,也有利于红茶红汤红叶品质特征的形成,红茶品种云南大叶在PC1和PC2上均有较高得分,说明其类胡萝卜素含量最为丰富,对香气和色泽品质都有积极作用。
3 结 论
本实验采用的HPLC-二极管阵列检测器法与国内其他分析茶叶中类胡萝卜素的方法比较,具有操作简便、快速、所需标准品少的特点。在37 个茶树品种中共检测到15 种类胡萝卜素,含量为524.6~1 236.7 μg/g,平均为(863.7f13.5)μg/g,检测结果更为全面。通过PCA得出,不同适制性茶树品种所含类胡萝卜素存在较大差异,乌龙茶的类胡萝卜素含量最高;红茶的环氧玉米黄素和玉米黄素含量高,其他品种类胡萝卜素含量低。为不同茶类的香气形成机理研究及茶叶加工中的品种选择提供理论依据。
但本实验采用的检测方法未检测出番茄红素、六氢番茄红素等对茶叶香气同样具有重要贡献的类胡萝卜素,这些类胡萝卜素在茶叶中含量较少,可在本实验方法基础上加大样品量,延长检测时间,或使用大气压化学电离离子源的质谱[30]等手段进一步探索。本实验检测出的类胡萝卜素中,一些组分结构尚不明确,需要通过HPLC-MS/MS联用、核磁共振、红外光谱等检测手段分析。后续关于类胡萝卜素香气前体的研究可进一步扩展到加工过程及成品茶中,并结合香气物质进行研究,有利于研究类胡萝卜素在茶叶中的降解机理,为茶叶加工提供参考。
