低分子肝素联合乌司他丁对脓毒症患者炎性因子和NSE水平的影响
2020-03-11刘俊灵樊雄辉樊文浩武警广东省总队医院重症监护科广东广州510507
刘俊灵,樊雄辉,樊文浩 (武警广东省总队医院重症监护科,广东 广州 510507)
据报道全球每年约有3 150万脓毒症发病患者,该病病情发展迅速,可诱发脓毒性休克、多器官功能障碍综合征等,病死率高达28%~50%[1-2]。肝素是临床上常用的抗凝药物,对脓毒症的病理生理过程的凝血活化起到有效抑制作用,也能减缓炎性反应的过度激活[3]。乌司他丁是一种广谱酶抑制剂,通过稳定细胞膜和溶酶体膜,减少炎性因子、介质的分泌,减轻组织器官损伤,同时也可改善微循环、抑制氧自由基[4]。基于此,本研究选取2016年6月~2018年6月间我院收治的脓毒症患者82例进行低分子肝素联合乌司他丁治疗,取得满意效果。
1 资料与方法
1.1一般资料:选取2016年6月~2018年6月间在我院就诊的脓毒症患者82例。脓毒症诊断符合《2012国际严重脓毒症及脓毒性休克诊疗指南》[5]标准;①感染指征:心率>90次/min,或大于不同年龄正常心率值2个标准差;发热即深部体温>38.3 ℃或低体温<36.0 ℃;呼吸频率>30次/min。②炎性反应生化指标:白细胞增多;血浆降钙素原大于正常2个标准差;血浆C-反应蛋白大于正常2个标准差;血糖>7.7 mmol/L,无糖尿病史;血浆内毒素大于正常2个标准差。同时符合感染指标2项及以上+炎性反应生化指标1项及以上即可诊断。纳入标准:①符合脓毒症诊断条件;②20岁≤年龄≤60岁;③近1个月内未给予治疗;④APACHEII评分≥12分;⑤取得患者知情,且自愿签署同意书。排除标准:①伴有造血系统、心脑血管、肝、肾、等严重障碍;②严重过敏体质者;③伴有恶性肿瘤;④合并严重感染者;⑤配合治疗性差者。参照数字表法将所有患者随机分为对照组和观察组均41例。对照组:男25例,女16例;年龄43~60岁,平均(55.25±6.83)岁;急性生理和慢性健康状况评分(APACHEⅡ)[6]:(19.39±2.40)分;急性胰腺炎17例,肺部感染16例,创伤8例。观察组:男28例,女13例;年龄44~62岁,平均(55.95±8.03)岁; APACHEⅡ评分:(19.49±2.87)分;原急性胰腺炎19例,肺部感染13例,创伤9例。两组患者基本临床资料差异无统计学意义(P>0.05),具有可比性。
1.2治疗方法:对照组:参见指南[5]采取常规治疗措施;包括积极控制原发病,控制感染,纠正水电解质酸碱紊乱,营养、呼吸、循环对症支持,适当镇痛、皮质激素、控制血糖以及预防应激性溃疡等。观察组:在对照组治疗基础上给予低分子肝素(河北常山生化药业股份有限公司,批准文号H20063909),皮下注射,0.4~0.6 ml/次,2次/d;乌司他丁注射剂(广东天普生物化学制药有限公司,批准文号H19990134),将30万乌司他丁溶于0.9% NaCl溶液50 ml中静脉滴注,3次/d。两组连续治疗1周。
1.3观察指标:①两组APACHEⅡ评分[6]:评价指标包括年龄、格拉斯评分、严重器官系统功能不全或免疫损害、生理指标,分数越高提示预后症状越差,在治疗前及治疗1周后各测评1次。②两组Marshall评分[5]:评价指标包括肝功能(血胆红素)、呼吸系统(PaO2/FiO2)、凝血系统(血小板计数)、肾功能(血肌酐)、心功能(心率×中心静脉压/平均动脉压)、神经系统(Glasgow 评分,每项按5等级记分为0~4分,最高为24分,分数越高示症状越差),在治疗前及治疗1周后各测评1次。③两组血清肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、IL-8、神经元特异性烯醇化酶(NSE)水平:晨起抽取患者空腹状态下的静脉血约4 ml,3 000 r/min 离心约10 min,取血清存于-70 ℃冰箱,待测,在治疗前及治疗1周后应用酶联免疫吸附(Elisa)法检测。
1.4疗效评判标准[7]:根据治疗前后患者的脑电图(EEG)变化进行疗效评定。显效:患者的EEG分级改善≥2级;有效:患者的EEG分级改善1级;无效:患者的EEG分级未见变化;恶化:患者的EEG分级降级≥1级。总有效率=(显效例数+有效例数)/总例数×100%。

2 结果
2.1两组APACHEⅡ和Marshall评分比较:治疗1周后,两组患者的APACHEⅡ和Marshall评分明显降低,差异有统计学意义(P<0.01)。观察组治疗1周后 APACHEⅡ和Marshall评分显著低于对照组,差异有统计学意义(P<0.01),见表1。
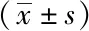
表1 两组APACHEⅡ和Marshall评分比较
注:与治疗前比较,①P<0.01;与对照组比较,②P<0.01
2.2两组EEG疗效比较:治疗1周后,观察组中EEG疗效总有效率为80.49%,显著高于对照组(58.54%),差异有统计学意义(P<0.05),见表2。
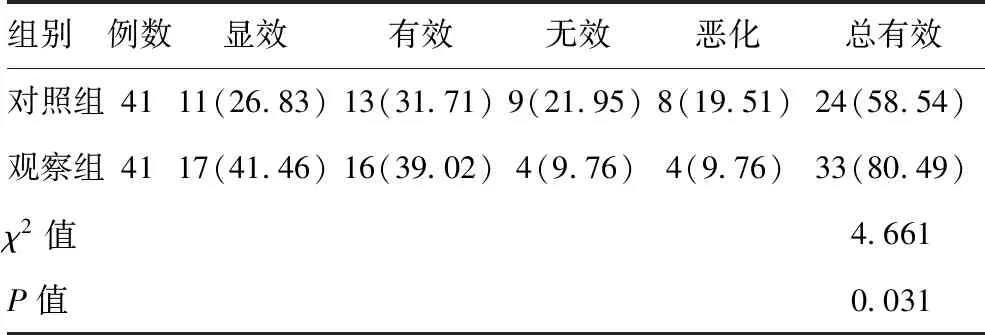
表2 两组EEG疗效比较[例(%)]
2.3两组血清TNF-α、IL-6、IL-8、NSE水平比较:治疗1周后,两组血清TNF-α、IL-6、IL-8、NSE水平明显减少,差异有统计学意义(P<0.01)。观察组治疗1周后血清TNF-α、IL-6、IL-8、NSE水平显著低于对照组,差异有统计学意义(P<0.01),见表3。
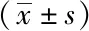
表3 两组血清TNF-α、IL-6、IL-8、NSE水平比较
注:与治疗前比较,①P<0.01;与对照组比较,②P<0.01
3 讨论
脓毒症的发病机制较为复杂,主要有炎性反应失控、免疫功能紊乱、凝血功能障碍,上述因素可使患者的血液呈高凝状态,引起机体的微循环形成血栓,导致组织缺氧、器官功能障碍等[8]。凝血系统被激活又可加剧体内的炎性反应,促进组织因子合成、分泌,这个过程反复恶性循环,不断消耗体内的抗凝物质,严重破坏凝血和抗凝间的平衡,最终导致人体的凝血机制发生严重紊乱,器官发生功能障碍和血流动力学障碍,进一步加重脓毒症甚至发生脓毒性休克[9-10]。
低分子肝素是普通肝素经亚硝酸分解纯化而成,能抵抗血栓和防止血液凝固,还有较弱的抗因子Ⅱα及较强抗Xα作用,可降低出血发生风险,由于低分子肝素抗血栓作用快速、持久,且半衰期明显长于普通肝素,在临床上被广泛应用[11-12]。乌司他丁是一种由肝脏合成分泌、从人尿液中分离的由143个氨酸构成的广谱蛋白酶抑制剂,可抑制多种蛋白酶如胰蛋白酶、糜蛋白酶等的活性以及溶酶体酶的分泌,稳定溶酶体膜,降低炎性因子释放,清除氧自由基、减少趋化因子,改善组织微循环等,以维持机体的内环境稳定[13]。文献报道,当人体受到外界各种刺激、感染以及发热等时,尿液中乌司他丁的活性会增加,说明乌司他丁在一定程度上对外来刺激具有抵抗作用[13]。研究显示,乌司他丁辅助治疗脓毒症,可明显调控炎性因子水平,抑制炎性反应,缓解脓毒症所致器官功能损伤[14];同时可抑制血管内皮细胞表达黏附因子,改善血液黏滞度,保护肝、肾功能。
本研究结果显示:观察组治疗1周后 APACHEⅡ和Marshall评分显著低于对照组,提示低分子肝素联合乌司他丁能够有效促进脓毒症患者病情的改善;观察组中EEG疗效总有效率(80.49%)显著高于对照组,说明低分子肝素联合乌司他丁治疗脓毒症的疗效更佳。脓毒症的炎性反应通过损伤脑血管内皮,使血脑屏障的通透性增加,引起脑组织缺血水肿以及神经元功能障碍等,能够使神经递质传递、微循环等发生病理性改变[15]。NSE以二聚体形式存在于神经细胞的胞浆内,在脑内的神经元被损害时NSE经血脑屏障释放入外周血中,是临床评价脑中神经元损伤的特异性标志物之一,脓毒症患者血清NSE浓度是评价患者神经元细胞受损以及病情的有效指标[16]。本组结果显示:治疗1周后,观察组患者血清中NSE含量显著少于对照组,提示低分子肝素联合乌司他丁对脓毒症患者的脑神经细胞可能具有保护作用。
全身炎性反应是脓毒症主要病理特征之一。TNF-α是脓毒症发生、病情发展的主要调节炎性因子之一,其可作用于周围组织引起多器官功能障碍,也能损伤脑部的血管内皮细胞,加剧脑部炎性反应[17]。TNF-α也是一种促炎介质,通过触发炎性反应发挥“瀑布效应”,促进IL-6、IL-8等炎性因子的分泌,对脏器和组织产生免疫性炎性反应损伤[18]。本组结果显示:观察组血清TNF-α、IL-6、IL-8水平显著低于对照组,提示低分子肝素联合乌司他丁可进一步抑制脓毒症患者的炎性因子水平,改善炎性反应,从而发挥治疗的作用。
综上所述,在常规治疗基础上,低分子肝素联合乌司他丁治疗脓毒症可改善患者的症状体征,提高临床疗效,抑制炎性因子TNF-α、IL-6、IL-8、NSE水平可能与其疗效有关。
