MIR6766的抗百草枯功能及其分子机制初探
2020-03-10李娜陈晨董研博王健李山虎
李娜,陈晨,董研博,王健,李山虎
军事医学研究院 生物工程研究所,北京 100850
百草枯(paraquat,PQ),化学名1-1-二甲基- 4-4-联吡啶阳离子盐,在溶液中以PQ2+形式存在,它可以接受一个电子形成一种稳定的紫色或蓝色的百草枯自由基即PQ·+,因此最初用做氧化还原指示剂[1]。后发现PQ能快速杀死绿色植物,但在土壤中会被灭活,对植物根及宿根不发挥作用,而成为世界上最广泛应用的农药之一。
百草枯进入体内后,多数通过多胺摄取系统特异性地集中在肺里,尤其是肺泡Ⅰ、Ⅱ型及克拉克细胞,对肺泡细胞造成极大损伤。它的毒性极大地可能源于氧化应激产生的活性氧类物质(reactive oxygen species,ROS)[2]。PQ2+可以通过细胞内的氧化还原酶,如还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶、细胞色素P450氧化还原酶(cytochrome P450 oxidoreductase,POR)、还原型烟酰胺腺嘌呤二核苷酸(NADH)泛醌/醌氧化还原酶、黄嘌呤氧化酶、一氧化氮合酶、硫氧还蛋白还原酶等[3-4]被还原为PQ·+,在有氧情况下PQ·+又重新被氧化为PQ2+,此过程可产生氧自由基(O·-)、过氧化氢(H2O2)、羟基自由基(OH·-)等一系列ROS,对细胞DNA、脂质、蛋白质、线粒体等造成伤害,引起细胞炎症,进而致细胞死亡。由于不当使用,PQ会造成人的肺、肾等多器官衰竭及神经退行性疾病,目前无特效解毒药。
Reczek等使用约含3000个代谢基因的代谢组文库通过CRISPR/Cas9技术进行百草枯抗性的筛选,发现POR、ATP7A等一系列潜在的抗性基因,经150 μmol/L PQ处理48 h后,敲除POR基因的细胞内外的H2O2水平较对照细胞均显著降低[5],提示POR基因可能是产生ROS的主要原因。百草枯引起细胞死亡的分子机制复杂,氧化应激、炎症反应及自噬都参与其中[5-7]。为了筛选出更加有效和具潜力的百草枯抗性基因,可以使用全基因组文库筛选抗性基因,以求能更清晰地阐述百草枯引起死亡的分子机制。
本研究中,我们使用CRISPR/Cas9全基因组敲除文库对A549细胞进行百草枯耐药基因筛选,筛选出一系列单链向导RNA(small guide RNA,sgRNA)富集的抗性基因,其中包含MIRNA6766与POR等基因。细胞毒性实验证实MIR6766敲除细胞表现出抗百草枯表型,其可能机制为间接降低了POR的表达水平,进而减弱了百草枯对细胞的毒性作用,为进一步研究MIR6766对百草枯抗性作用的分子机制奠定了基础。
1 材料与方法
1.1 材料
A549细胞、HEK293T细胞、大肠杆菌感受态细胞DH5α和DH10B为本实验室保存;PQ为毒物药物研究所赠送;胎牛血清(FBS)购自杭州四季青公司;青霉素和链霉素购自华北制药有限公司;DMEM高糖培养基和含0.25% EDTA的胰蛋白酶购自Gibco公司;PBS购自索莱宝公司;嘌呤霉素购自HyClone公司;Genome-scale CRISPR Knock-Out v2.0 pooled libraries(GeCKO v2 libraries)购自 Addgene公司;LipofectAMINE 3000转染试剂盒、BCA蛋白定量试剂盒购自Thermo公司;质粒提取试剂盒购自Axygen公司;miRcute增强型miRNA cDNA第一链合成试剂盒和miRcute增强型miRNA荧光定量检测试剂盒购自天根公司;Cell Counting Kit8(CCK8)试剂盒购自东仁化学科技有限公司;POR抗体购自Abcam公司;CO2恒温培养箱和MULTISKAN FC酶标仪购自Thermo公司;Q-PCR仪器购自伯乐公司。
1.2 GeCKO v2 libraries扩增及慢病毒包装
采用电击转化法将GeCKO v2 libraries A、B文库各1 μL转化大肠杆菌DH5α感受态细菌,转化后涂固体LB氨苄培养基,37℃温箱培育14 h,刮取平板上的转化子提取质粒并测定浓度后保存于-20℃。用LipofectAMINE 3000、文库质粒与包装质粒共同感染HEK293T细胞,包装出慢病毒,测定病毒滴度。
1.3 全基因组CRISPR/Cas9敲除文库筛选百草枯抗性基因
根据测定的慢病毒的滴度,将含有sgRNA的文库慢病毒感染A549细胞,使感染复数(multipilicity of infection,MOI)≤0.3,以保证每个细胞内有且只有1个sgRNA。为保证MOI在符合范围内,当细胞数达到3.6×108时,用175 cm2培养瓶接种初始细胞4×106/瓶。待嘌呤霉素筛选后将细胞平均分为3组,即0 d组(day0)、对照组(0 μmol/L百草枯)和药物筛选组(12 μmol/L百草枯)。day0组在嘌呤筛选后即开始药物筛选时冻存6×107细胞。为保证sgRNA的稳定富集,另2组分别以6×107细胞传代,每组细胞数达到1.2×108时传代,传10代后分别取6×107细胞冻存,与day0组一起送上海寻百会公司进行深度测序与生物信息分析,得到sgRNA稳定富集的基因。
1.4 候选抗百草枯基因MIR6766/POR敲除质粒构建和细胞系建立
使用CRISPR-LentiV2质粒作为构建敲除细胞的慢病毒表达载体系统,靶向MIR6766、POR,对照基因的sgRNA上下游序列由博迈德公司合成。将sgRNA上下游引物按照梯度降温的方法退火,将CRISPR-LentiV2质粒用BsmBⅠ酶切后胶回收,二者产物通过T4DNA连接酶连接,转化大肠杆菌DH10B后涂于氨苄LB固体培养基,挑取单克隆菌落培养500 μL菌液,用设计的鉴定引物菌液PCR扩增目的条带,鉴定正确后将菌液送博迈德生物公司测序,测序正确后提取目的质粒,测定浓度后于-20℃保存。
将293T细胞以70%~80%的密度接种于100 mm皿中,24 h后进行慢病毒包装。按照慢病毒包装质粒pMD2G∶包装质粒pSPA×2∶目的质粒为1∶3∶4的比例与PEI一起转染293T细胞,12 h后换液,24、48 h后分别收取含有病毒颗粒的培养液即慢病毒,用0.45 μm的滤膜过滤分装后于-80℃保存。将A549细胞以30%~40%的密度接种于100 mm皿中,24 h后进行慢病毒的感染。以完全DMEM培养液∶慢病毒为1∶1的比例加于培养皿中,并添加终浓度为10 g/L的聚凝胺,12 h后更换新鲜培养液,更换培养液后24 h加入终浓度为1.5 μg/mL嘌呤霉素进行抗性筛选48 h,存活的细胞即为感染目的质粒成功的细胞。
1.5 Q-PCR验证对照与敲除细胞的相关基因表达
感染成功的细胞采用TRIzol法提取RNA,反转录出cDNA,进行Q-PCR鉴定。
1.6 CCK8法检测细胞存活率
对照细胞与敲除细胞以7×103/孔接种于96孔培养板,20 h后用于实验。实验设空白组、对照组(不加百草枯)、100 μmol/L百草枯组、150 μmol/L百草枯组,每组3个复孔。药物作用72 h后弃去原有培养液。将CCK8液与培养液按1∶10的比例混匀后每孔加入100 μL,2 h后用酶标仪测定D450nm值。细胞存活率(%)=(D药物组-D空白组)/(D对照组-D空白组)。
1.7 Western印迹验证POR基因蛋白水平表达
将对照与敲除细胞接种于60 mm皿中,待细胞生长至80%~90%时用PBS清洗2次,吸尽残存的PBS后置于-80℃,次日取出后加入适量的细胞裂解液,冰上裂解30 min,吹打转移至离心管,4℃、12 000 r/min离心 10 min,取上清,加入5×SDS上样缓冲液,用10%分离胶进行SDS-PAGE,电泳后转膜。POR蛋白使用兔种属一抗(1∶500),4℃孵育过夜;鼠抗兔二抗(1∶2000),室温孵育1 h。GAPDH使用鼠种属一抗(1∶10 000),4℃孵育过夜;羊抗鼠二抗(1∶20 000),室温孵育30 min。化学发光系统拍照。
1.8 统计学分析
用GraphPad Prism 7软件进行数据分析及制图,连续型变量以x±s表示,组间比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 CRISPR-Cas9敲除文库筛选出A549细胞耐百草枯基因MIR6766
如图1A,用CRISPR-Cas9敲除文库慢病毒感染A549细胞,经嘌呤霉素筛选后,建立了全基因组敲除的A549细胞库。将全部细胞分为day0组、对照组(0 μmol/L PQ)和实验组(12 μmol/L PQ),筛选细胞传10代后提取基因组DNA,经高通量测序和生物信息学分析,获得了抗百草枯的候选基因(图1B),为进一步筛选百草枯的抗性基因提供依据。

图1 利用CRISPR/Cas9文库筛选出抗百草枯基因MIR6766与POR
2.2 构建敲除MIR6766、POR的细胞系
使用对照和敲除MIR6766、POR表达的sgRNA慢病毒感染A549细胞(sgRNA上下游序列见表1),经嘌呤霉素筛选后得到稳定对照细胞系(sg-control)和MIR6766敲 除 细 胞 系(sg-MIR6766)、POR基因敲除细胞系(sg-POR)。提取sg-control、sg-MIR6766的细胞总 RNA,反转录出cDNA,实时荧光定量PCR定量分析(GAPDH和MIR6766荧光定量PCR引物见表2)。以sg-control为对照样品,GAPDH表达量为对照表达量,荧光定量结果如图2A,sg-MIR6766中MIR6766表达量相对于sg-control显著降低(P<0.05),表明构建出敲除MIR6766的细胞系。Western印迹表明针对POR基因2个靶点均显著抑制POR的表达(图2B),从而构建了敲除POR基因的A549细胞系。

图2 构建MIR6766与POR敲除细胞系

表1 CRISPR/Cas9 sgRNA序列

表2 荧光定量PCR引物序列
2.3 敲除MIR6766和POR细胞系表现出百草枯耐药性
CCK8细胞毒性实验结果(图3A)表明,经100、150 μmol/L百草枯处理3 d后,对照细胞存活率分别为21%、13%,敲除MIR6766细胞系存活率为62%、43%,具有显著性差异(P<0.05)。敲除POR细胞系表现出同样的存活率差异(图3B、C)。这表明敲除MIR6766或POR基因后,细胞表现出抗百草枯表型。

图3 MIR6766与POR敲除细胞表现出百草枯抗性表型
2.4 sg-MIR6766的POR基因mRNA与蛋白表达水平降低
sg-MIR6766的POR基因mRNA表达水平显著低于对照细胞(P<0.01,图4A)。经不同浓度百草枯处理3 d后,sg-MIR6766的POR蛋白表达量显著低于对照细胞(图4B、C)。提示MIR6766可能参与调控POR基因的表达。
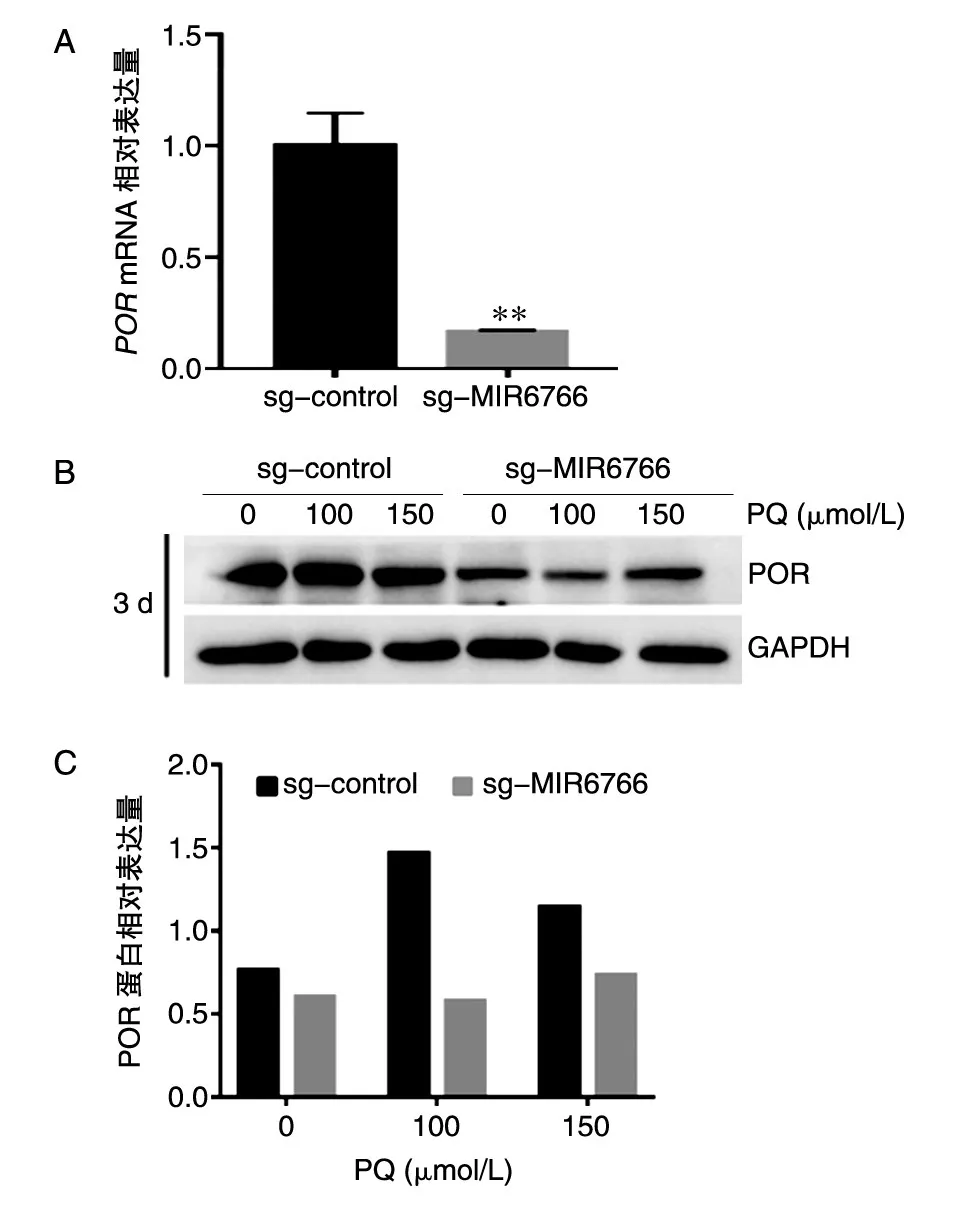
图4 MIR6766敲除细胞系中POR基因mRNA和蛋白表达水平
3 讨论
百草枯中毒解救方法是医学上的难题,临床常应用血液灌流法救治病人[8]。体外和动物实验证明,伏立诺他通过阻止Smad7在大鼠体内去乙酰化,可在一定程度上减轻百草枯诱导的肺纤维化[9];强力霉素通过抑制中性粒细胞来源的基质金属蛋白酶9,减轻百草枯引起的急性肺损伤[10];姜黄素在一定程度上对肺纤维化有改善作用[11];蜂毒肽对百草枯诱导的小鼠肺损伤具有调节氧化应激和凋亡的作用[12]。但以上救治方案效果并不理想,不能明显降低百草枯引起的毒性损伤。
本研究利用CRISPR/Cas9全基因组敲除文库在人肺癌A549细胞中筛选对百草枯耐药基因,发现在百草枯作用下A549细胞中MIR6766基因的sgRNA得到富集,提示MIR6766基因可能参与百草枯耐药表型的发生。进一步研究发现,敲除MIR6766细胞系对于百草枯引起的细胞死亡具有一定的抵抗作用,较对照细胞具有更高的存活率,表现出抗百草枯表型,提示MIR6766在百草枯引起的细胞死亡中发挥重要作用。
CRISPR/Cas9是一种古细菌防御系统,是由RNA引导的 CRISPR(clustered regularly interspaced short palindromic repeats,规律成簇间隔短回文重复)相关核酸酶Cas9切割DNA,导致在基因组的特定位点引入靶向功能突变缺失[13]。人工合成的sgRNA可以引导Cas9在特定的基因组位点使DNA双链断裂[13],产生移码突变等导致基因功能缺失。大量sgRNA的集合可形成一个sgRNA文库,从而可以编码不同细胞的不同基因[14]。随着CRISPR/Cas9高通量筛选系统的不断发展和完善,已经筛选获得了一系列药物治疗耐药基因或毒物抗性基因[15-17]。
POR基因编码的细胞色素P450氧化还原酶位于内质网膜,对细胞色素P450催化的类固醇激素、药物代谢反应等至关重要。它具有黄素腺嘌呤二核苷酸(FAD)结合结构域和黄素类毒素样结构域,可以结合2个辅助因子FAD和黄素单核苷酸(FMN),能给所有微粒体P450酶提供电子。Reczek等使用约含3000个代谢基因的sgRNA代谢组文库进行百草枯抗性筛选,发现降低POR基因表达可以降低百草枯引起的ROS水平,在百草枯引起的死亡中发挥了重要作用。本研究通过全基因组文库也筛选出POR基因,敲除POR基因细胞也出现了抗百草枯表型。
MIR6766功能尚不明确。本研究表明MIR6766敲除细胞系中POR基因的mRNA与蛋白表达量显著降低,而敲除POR基因的细胞也表现出抗百草枯表型,初步提示MIR6766可能通过影响POR基因表达量而发挥抗百草枯作用。但是两者的相互作用机制,以及与百草枯耐药的相关机制仍须深入探讨。
