铝胁迫及酸度对天山雪岭云杉菌根真菌生长的影响∗
2020-03-06王艳阳常顺利王诗慧古丽哈娜提波拉提别克张毓涛
王艳阳,常顺利,王诗慧,古丽哈娜提·波拉提别克,张毓涛
(1.新疆大学资源与环境科学学院绿洲生态教育部重点实验室,新疆乌鲁木齐830046;2.新疆林业科学院森林生态研究所,新疆乌鲁木齐830063)
0 引言
酸性土壤中,活性铝浓度增加是影响菌根真菌、植物生长和引起森林衰亡的主要原因之一[1].当土壤酸度低于5.5以下发生酸化时,土壤内部分固态的矿物铝被活化成为可溶性铝(统称为活性铝).土壤酸度越低则活性铝含量越高[2−6].活性铝浓度较高土壤中的树木易吸收大量的铝,造成植物细胞壁严重损坏,导致细胞有丝分裂和减数分裂不能正常进行[7,8],矿质元素吸收和转运受阻[9],土壤肥力下降,林木生长减弱甚至死亡[10,11].
菌根真菌(mycorrhizal fungi)可通过直接和间接途径参与植物生理代谢,进而介导植物抗逆、分解有毒物质和修复退化土壤与生境[12].菌根真菌与植物根系形成菌根共生体后,能增加氮、磷、钾、钙、镁等营养元素的吸收,改善林木营养.一些优良的菌根真菌还可以通过分泌有机酸来显著提高宿主植物的抗酸铝性[13],主要因其可与土壤中的活性铝形成稳定的螯合物,改变铝的形态,使其不能进入细胞膜,从而降低菌丝和根系细胞对铝的吸收[14].
雪岭云杉(Picea schrenkiana)是天山森林群落的单优树种,对天山的水源涵养、水土保持和林区生态系统的形成与维护起主导作用[15,16].我国天山雪岭云杉林下土壤为灰褐色土,呈酸性(pH值为5.6左右)[17],研究发现天山雪岭云杉森林存在老龄化、幼苗存活困难等更新不良问题[18].酸性条件下铝胁迫对菌根真菌生长的抑制可能是导致雪岭云杉幼苗存活困难的关键因素.然而,目前酸性条件下活性铝胁迫对菌根真菌生长的影响机理尚不清楚.
本研究选取了从天山雪岭云杉根部分离、镜检及一代测序技术鉴定得到的拟青霉(Simplicillium sp., Si)、细长孢霉(Mortierella elongate, Me)、木霉菌(Trichoderma spp., Tr)、瓶头霉(Phialocephala, Ph)和葡萄状穗霉(Stachybotrys chartarum, Sc)5种菌根真菌[19−22]为供试材料,研究不同活性铝浓度和不同pH值梯度下5种菌根真菌的生长状况,探讨以下问题:(1)铝胁迫对5种菌根真菌的生长是否存在抑制作用;(2)酸性条件对5种菌根真菌的生长有何影响.从而探讨菌根真菌耐酸铝胁迫的机理,以期对天山雪岭云杉森林的保育提供借鉴.
1 材料与方法
1.1 供试材料
本文从天山雪岭云杉根部分离筛选并通过一代测序技术鉴定得到的拟青霉(Si)、细长孢霉(Me)、木霉菌(Tr)、瓶头霉(Ph)和葡萄状穗霉(Sc)5种共生菌根真菌菌株.
1.2 试验设计
取4 ℃保存1∼2个月的上述菌株,接种于PDA固体培养基上,25 ℃条件下暗培养21 d备用.根据天山雪岭云杉森林林下土壤活性铝含量(0.05∼0.85 g·kg−1)和pH值(5.6),采用分析纯Al2(SO4)3·18H2O提供活性铝,pH值条件为6.5和5.5时设定6个Al3+浓度梯度(0、0.2、0.4、0.6、0.8、1.0 mmol·L−1),每组处理 3 次重复.另根据天山林区土壤 pH 背景值(5.6)单独设置 5 个 pH 值条件(4.5、5.0、5.5、6.0、6.5),25±1 ℃条件下暗培养14 d.测量菌株菌落直径,各处理3次重复.
1.3 测定指标与方法
培养过程中,每日同一时刻利用尺子测量培养基底部的菌落直径.
1.4 数据处理与分析
试验数据使用Excel进行基本计算,SPSS14.0统计软件进行统计分析,采用LSD(least-significant difference)多重比较方法探讨不同活性铝浓度和不同pH值间菌落直径的差异性,利用R语言系统聚类分析方法分析5种菌根真菌的耐酸铝分类情况.
2 结果与分析
2.1 活性铝胁迫对受试菌株的影响
五种菌根真菌菌落直径对活性铝胁迫的响应显示(图1),0.2 mmol·L−1Al3+浓度下,Sc菌落直径最小(平均仅为3.2 cm),比对照增加了9.7%;Me和Ph菌落直径分别比对照减少了12.9%和11.3%;Si和Tr与对照无明显差异.0.6 mmol·L−1Al3+浓度下,Me和Ph菌落直径达到最大,分别比对照增加了10.2%和17.0%;Si为最高(平均为4.1 cm),显著高于其他活性铝离子浓度(P <0.05);Tr和Sc分别比对照减少了6.8%和11.3%.1.0 mmol·L−1Al3+浓度下,Tr菌落直径增加了11.4%,达到最大(平均为8.5 cm),显著大于对照(P <0.05);而Me、Ph、Si和Sc分别比对照减少了19.9%、11.3%、20.7%和35.0%.
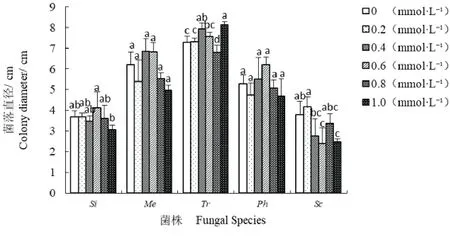
图1 不同活性铝浓度对菌根真菌菌落直径的影响Fig 1 The effects of different active Aluminum concentrations on the diameter of fungal colony
2.2 pH值对受试菌株的影响
五种菌根真菌对pH值的响应显示(图2),pH值并未引起Tr菌落直径的显著变化,Tr菌落直径最大(平均为8.5 cm).Me菌落直径次之(平均为7.7 cm),pH值为4.5∼6.5时,未引起其显著差异.Ph和Si菌落平均直径分别为3.9 cm和3.8 cm,并且随pH值降低而减小,pH值为4.5时,分别比对照减少了28.8%和19.7%,显著小于对照(P <0.05);而Ph的菌落直径在pH值为4.5∼6.0与6.5时存在显著性差异.Sc菌落直径最小(平均仅为3.4 cm),pH值为4.5时,比对照减少了22.4%,显著小于对照(P <0.05);pH值为6.0时,与对照相比菌落直径无明显变化.
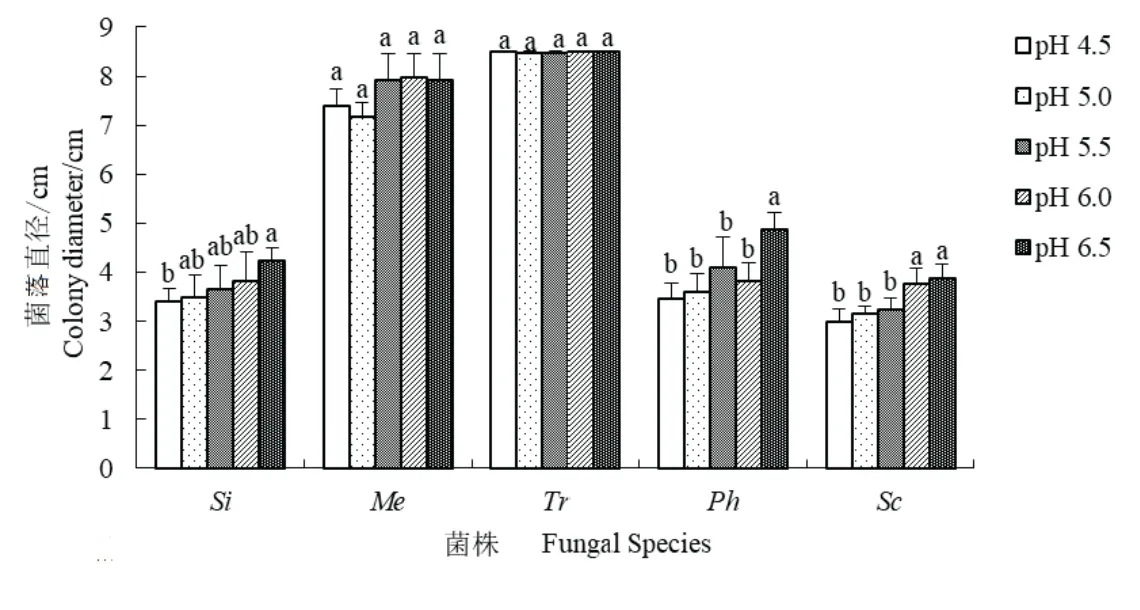
图2 pH值对菌根真菌菌落直径的影响Fig 2 The effects of pH value on the diameter of fungal colony
2.3 活性铝及pH值对菌根真菌生长的影响
五种菌根真菌受活性铝胁迫和pH值的响应显示(表1),Tr菌落直径最大,平均为8.5 cm,并且随着活性铝浓度的增加而增大;随pH值的降低而增大,pH值为5.5和6.5时,Tr菌落直径无明显差异.铝胁迫及pH值改变均未能引起其菌落直径显著变化.Ph、Me和Si的菌落直径次之,在1.0 mmol·L−1Al3+浓度及pH值为5.5时,分别比对照增加了13.6%(显著大于对照,P <0.05),2.3%和5.0%(显著小于对照,P <0.05).Sc菌落直径除在0.6 mmol·L−1Al3+浓度和pH值为5.5、6.5时与对照无明显差异外,在低pH值和0、0.2、0.4、0.8和1.0 mmol·L−1Al3+浓度时均被显著抑制(P <0.05).

表1 活性铝及pH值对菌根真菌菌落直径的影响Tab 1 Effects of interaction between active Aluminum and pH value on diameter of fungal colony
由表2可知,Tr在0∼1.0 mmol·L−1Al3+浓度及pH值在4.5∼6.5时均能正常生长,最适Al3+浓度及pH值为1.0 mmol·L−1和4.5;Ph、Me和Si最适Al3+浓度为0.6 mmol·L−1,可生长Al3+浓度范围均为0∼0.6 mmol·L−1,最适pH值分别为6.5、5.5和6.5;Sc最适Al3+浓度为0.2 mmol·L−1,可生长Al3+浓度范围为0∼0.2 mmol·L−1,最适pH值为6.5.
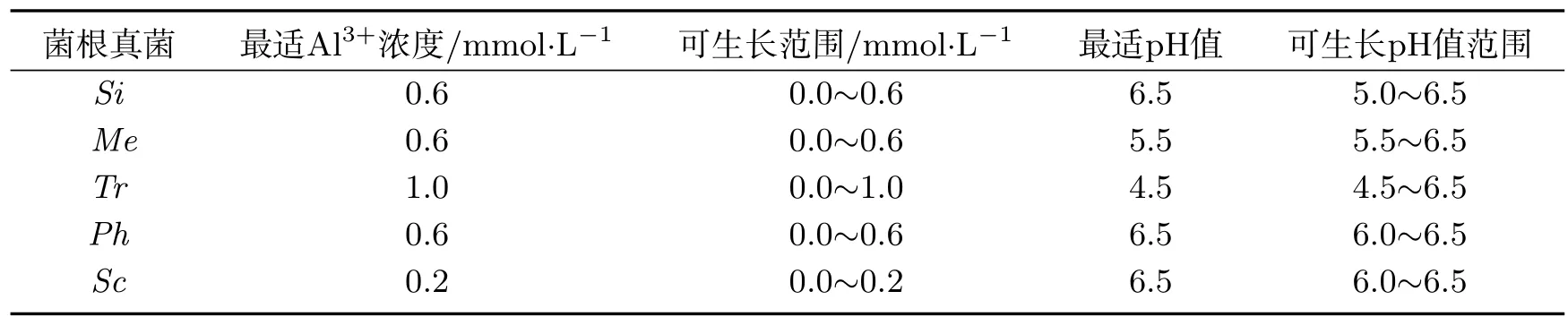
表2 不同菌根真菌对活性铝浓度及pH值适应范围Tab 2 Adaptation of different fungi to active Aluminium concentrations and pH value
2.4 受试菌株耐酸铝的聚类分析
本文通过聚类分析对五种菌根真菌的耐酸铝情况进行分类,以便更系统、全面地分析受试菌株在不同活性铝浓度和pH值条件下的耐受程度[23].系统聚类分析5种菌根真菌的耐铝分类情况显示(图3),Si和Sc在不同活性铝浓度处理后,生长状况最为类似,可将其归为一类;同样将Me和Ph归为一类,Tr由于生长状况与其他菌株不同,单独归为一类.系统聚类分析5种菌根真菌的耐酸分类情况显示(图4),根据5种菌根真菌菌落直径随pH值梯度的变化规律,Tr和Me在不同酸性处理后,其基因表达谱的聚类关系最接近,可以归为一类;同样可将Si、Ph和Sc归为一类.系统聚类分析5种菌根真菌受铝胁迫和pH值影响的分类情况显示(图5),根据5种菌根真菌随活性铝浓度与pH值的变化规律,Me和Ph的变化最为相似,可归为一类;Si和Sc归为一类;Tr单独归为一类.
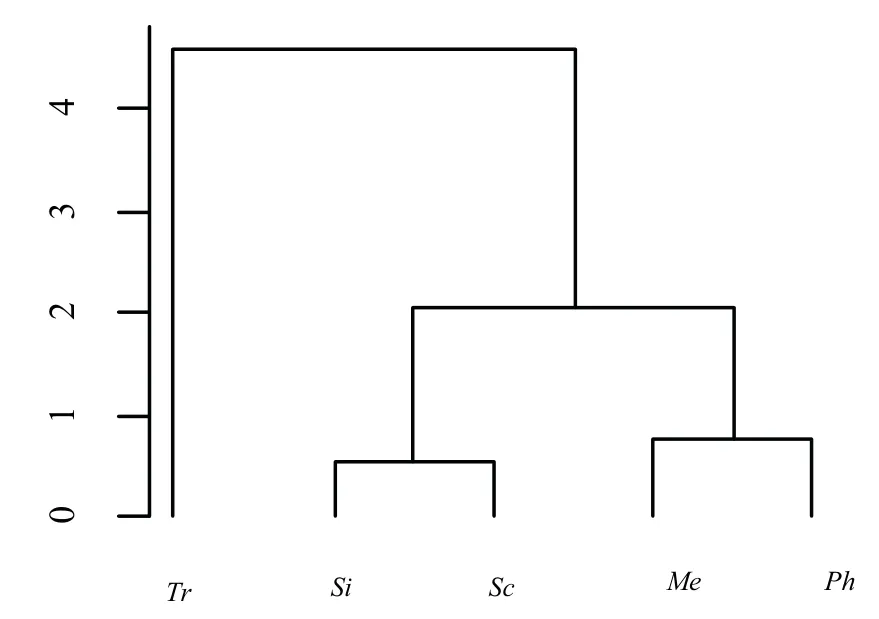
图3 系统聚类分析5种菌根真菌的耐铝分类情况Fig 3 Clustering analysis of Aluminum tolerance of five fungi
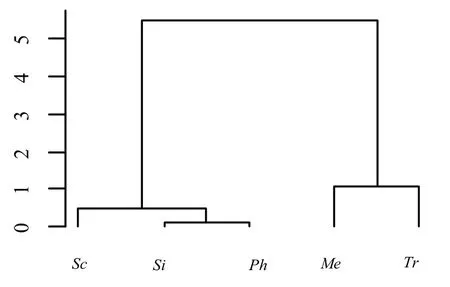
图4 系统聚类分析5种菌根真菌的耐酸分类情况Fig 4 Clustering analysis of acid tolerance of five fungi
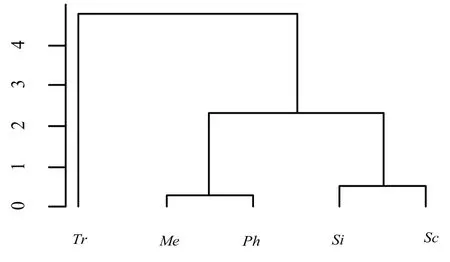
图5 系统聚类分析5种菌根真菌受铝胁迫和pH值影响的分类情况Fig 5 Clustering analysis of the classification of five fungi under Aluminum stress and pH values affecting
3 讨论
3.1 活性铝浓度对菌根真菌生长的影响
菌根真菌可螯合土壤中的活性铝及其它重金属等有害物质,降低有毒物质的有效性[24].辜夕容等[25]研究发现,0∼1.0 mmol·L−1Al3+浓度对彩色豆马勃(Pt715)等菌株的生长无明显影响,这与本试验中施加相同范围活性铝浓度对菌种Tr无明显影响的结果相同.Heijden等[26]研究发现,接种菌根真菌Paxillus involutus后,受活性铝浓度影响并不显著,与Cumming等[27]的研究结果一致,彭剑涛等的研究也证实了这一结果[28].说明在本试验中Tr对活性铝浓度适应范围较广,耐铝能力相对较强(表2),可应用于活性铝浓度较高的森林土壤中.
然而不同菌根真菌对活性铝浓度的耐受程度是不同的.研究结果表明,Al3+在适当的浓度范围内会促进菌根真菌的生长,而超出一定的Al3+浓度范围会明显抑制菌根真菌的生长[29].本试验中,较低Al3+浓度时,Me、Ph、Si和Sc的菌落直径显著增加,但在高Al3+浓度时,Me、Ph、Si和Sc分别比对照减少了19.9%、11.3%、20.7%和35.0%,受Al3+胁迫作用显著.这与辜夕容等[25]研究LbS238N在低铝时表现耐铝并促进生长,而LbS238A在活性铝胁迫下生长受到显著抑制的结果相似.Jana等[30]的研究结果也证实了活性铝可降低敏感真菌鹅膏菌细胞中养分含量,从而破坏细胞固定结构,抑制菌根真菌生长.聚类分析(图3)也表明,Si和Sc在不同活性铝浓度处理后,生长状况最为类似,可将其归为一类;同样将Me和Ph归为一类,Tr由于生长状况与其他菌株不同,单独归为一类.结合以上结论可以得出:Tr的耐铝性最强,其次是Me和Ph,Si和Sc耐铝性最差.由于我国天山雪岭云杉森林土壤中活性铝浓度较高,可能由此导致云杉林下菌根真菌生长受到抑制.因此,在天山雪岭云杉森林中筛选出具有一定抗铝能力的菌根真菌来缓解铝毒显得尤为重要.
3.2 酸性条件对菌根真菌生长的影响
张茹琴等[31]研究表明,pH值4.1∼7.1范围内褐环粘盖牛肝菌和褐黄牛肝菌等菌根真菌均可生长.许美玲等[32]研究发现,松乳菇在弱酸环境下适应性更强,生长较好;而高大环柄菇则在中性条件下生长更好.本试验中,不同pH值处理下,5种菌根真菌表现出不同的抗酸性(表2).pH值在4.5∼6.5范围内并未引起Tr和Me菌落直径的显著变化,说明其在酸性条件下表现出较强的环境适应能力,在pH值较低和较高的环境中均可生长,可应用于酸性土壤森林中.Ph和Si菌落直径随pH值降低而减小,pH值为4.5时,分别比对照减少了28.8%和19.7%,显著小于对照(P <0.05),在偏酸性条件下生长显著被抑制,说明其适宜在pH值较高的环境中生长,不适宜应用于酸性土壤中.黄芳等[33]通过不同pH值等因素对4株兰花菌根真菌生理学培养特征的试验分析,发现3株菌根真菌在pH值为5的培养基中生长最佳,而菌株LH94则在pH值为6.5∼7范围内菌落直径最大.这一结果与本试验中Sc菌落直径在pH值为4.5时,显著小于对照(P <0.05)相似,说明其适宜在pH值较高的环境中生长.
聚类分析5种菌根真菌的耐酸分类情况显示(图4),根据5种菌根真菌菌落直径随pH值梯度的变化规律,Tr和Me在不同酸度处理后,生长情况较为类似,可以归为一类;同样可将Si、Ph和Sc归为一类.因此,综合以上结论,Tr和Me能在偏酸环境下不受影响,属耐酸型;Si、Ph和Sc在偏酸条件下菌落直径显著被抑制,属酸敏感型.由此可见,可将筛选出的抗酸型菌根真菌应用到天山雪岭云杉森林的保育和恢复中.
3.3 酸性条件下不同活性铝浓度对菌根真菌生长的影响
郭良栋等[34]的研究表明,酸性土壤中彩色豆马勃(Pt715)可阻止Al3+进入根系细胞,降低酸铝活性.吴雪莲等[35]的研究结果表明,Pt715等菌株在低pH值(5.0)时具有较强的耐铝毒能力,其生长未受酸度胁迫的抑制,反而促进其生长.王明霞等[36]的研究表明,低pH值和高浓度铝均能使菌根真菌的超氧化物歧化酶活性升高,酸铝胁迫对其不产生抑制作用.陆建良等[37]的研究表明,茶树(Camellia sinensis)抗酸铝菌根真菌(Neurospora sp.)的生长在高浓度铝作用下显著高于对照,可显著降低活性铝含量.本试验中,Tr菌落直径最大,随着活性铝浓度的增加以及pH值的降低而增大,低pH值和高浓度铝胁迫均未引起菌落直径的显著变化,说明Tr能够较强地适应偏酸性和高浓度铝胁迫环境.根据聚类分析(图5)可知,Tr对活性铝浓度和pH值的响应单独归为一类,进一步证实了Tr是耐酸铝型真菌.
谢一青等[38]的研究结果表明,在低pH值作用下,Al3+对3种菌根真菌的生长表现出不同程度的影响.降低pH值和增加活性铝浓度可改变土壤中菌根真菌的活性[39].在1.0 mmol·L−1Al3+浓度及pH值为5.5时,Me和Ph的菌落直径高于对照,而Si显著低于对照(P <0.05).Sc菌落直径在低pH值和各Al3+浓度时均被显著抑制(P <0.05),受铝胁迫及pH值影响显著,这说明菌株耐酸铝能力可能与自身生长环境等因素密切相关.Me和Ph的聚类分析表明其对酸铝胁迫的响应程度相似,归为一类;Si和Sc归为一类.因此,铝毒与酸性土壤环境可能是造成天山雪岭云杉菌根真菌生长缓慢的原因,但其作用机制还有待进一步验证.
4 结论
综上所述,Tr抗酸铝能力最强,Me和Ph具有较强的抗铝能力,这3种真菌菌落直径无显著差异,属于耐铝型;Si和Sc具较差的抗铝能力,属于铝敏感型.5种受试菌株中,Tr在偏酸和高浓度铝条件下适应能力最强,菌落直径最大,是能快速缓解铝毒的最具潜力菌株.但菌株耐酸铝的机理,仍需进一步证实.
