人TBC1D10C基因过表达慢病毒载体的构建及功能鉴定
2020-03-05程阔菊吴庆周殿儒冯胜红罗健华黄河王毅
程阔菊 吴庆 周殿儒 冯胜红 罗健华 黄河 王毅

【摘要】目的 构建人TBC1D10C(hTBC1D10C) 基因过表达慢病毒载体,并对其进行功能鉴定。方法 利用PCR技术扩增hTBC1D10C基因片段,构建pLVX-hTBC1D10C-mCMV-ZsGreen-PGK-Puro过表达载体质粒,将构建的过表达载体质粒和系统包装质粒应用高效转染试剂盒转染至293T细胞,以包装rLV-hTBC1D10C-zpp,在HEK293細胞中检测病毒滴度。rLV-hTBC1D10C-zpp感染H9C2心肌细胞,蛋白免疫印迹法检测hTBC1D10C 蛋白表达。结果 pLVX-hTBC1D10C-mCMV-ZsGreen-PGK-Puro过表达质粒构建成功,rLV-hTBC1D10C-zpp包装顺利,滴度为1×108 TU/ml,感染H9C2心肌细胞后,hTBC1D10C蛋白表达上调(P < 0.05)。结论 rLV-hTBC1D10C-zpp构建成功,在心肌细胞中具有高效表达hTBC1D10C的效应。
【关键词】人TBC1D10C;Carabin;慢病毒载体
【Abstract】Objective To construct a lentivirus vector overexpressing human TBC1D10C (hTBC1D10C) gene and identify its function. Methods The hTBC1D10C gene fragment was amplified by PCT. Human TBC1D10C gene fragment was inserted into the vector overexpressing pLVX-hTBC1D10C-mCMV-ZsGreen-PGK-Puro. Then, the vector plasmid overexpressing pLVX-hTBC1D10C-mCMV-ZsGreen-PGK-Puro and system packaging plasmid were transfected into 293T cells using HET high-efficiency transfection reagent to package rLV-hTBC1D10C-zpp. The viral titer was detected in HEK293 cells. H9C2 myocardial cells were infected with rLV-hTBC1D10C-zpp. The expression level of hTBC1D10C protein was detected by Western blot. Results The plasmid overexpressing pLVX-hTBC1D10C-mCMV-ZsGreen-PGK-Puro was successfully constructed. rLV-hTBC1D10C-zpp was successfully packaged with a titer of 1x108TU/ml. The expression level of hTBC1D10C protein was significantly up-regulated after H9C2 myocardial cells were infected (P < 0.05). Conclusion rLV-hTBC1D10C-zpp is successfully constructed, which can overexpress hTBC1D10C in cardiomyocytes.
【Key words】Human TBC1D10C;Carabin;Lentivirus vector
TBC1D10C是2007年在人T淋巴细胞中发现的一个新的钙调磷酸酶(CaN)结合蛋白,主要表达于脾脏及血液中,同时可与Ras结合,基于其与CaN和Ras均能相互作用的特性,将其命名为carabin[1]。有研究表明,它作为CaN的内源性负反馈抑制蛋白通过CaN和Ras信号通路负反馈抑制T淋巴细胞及B淋巴细胞的持续活化,在机体免疫中发挥着重要作用[2-4]。最近研究表明,TBC1D10C在心肌细胞中亦有表达,可通过负性调节CaN和Ras信号通路抑制心肌细胞的肥大,并有可能成为诊治心力衰竭的心肌肥厚靶点[5-6]。我们的前期研究发现,TBC1D10C在小鼠梗死心脏及经缺血/缺氧处理的人心室肌细胞株AC16中表达均显著下调,提示TBC1D10C在心肌梗死及缺血中可能会起到一定的作用,但目前尚未见相关研究报道[7]。鉴于此,本研究拟采用慢病毒载体系统,构建人TBC1D10C慢病毒过表达载体(rLV-hTBC1D10C-zpp),感染H9C2心肌细胞验证TBC1D10C过表达效果,为进一步观察TBC1D10C信号通路在心肌细胞中的作用奠定基础。
材料与方法
一、材 料
1. 材 料
293T细胞株及慢病毒过表达载体质粒(pLVX-mCMV-ZsGreen-PGK-Puro, Amp+)购自深圳百恩维生物科技有限公司。pUC57-hTBC1D10C质粒(hTBC1D10C模板质粒)由本实验室提供。
2. 主要试剂及仪器
JM109感受态细胞(深圳百恩维生物科技有限公司),DNA引物合成(美国Invitrogen公司),DNA测序(美国Invitrogen公司),限制性内切酶EcoRⅠ、BamHⅠ(美国NEB公司),胎牛血清(C2027050,美国Invitrogen公司),慢病毒包装试剂盒(BW12008-20,深圳百恩维生物科技有限公司),超净工作台BCM-1600A(苏州苏净安泰公司),Bio-Rad凝胶成像系统Gel Imager,Gel-Doc(美国Bio-Rad公司)。
3. 引物设计及合成
针对pUC57-hTBC1D10C质粒设计基因引物:pUC57-hTBC1D10C-EcoRⅠ-F:5-CCGGAATT-CGCCACCATGGCCCAGGCCCTGGGGGAG-3;pUC57-hTBC1D10C-BamHⅠ-R:5-CGCGGATCC-TCAGAAGCGGGTGTCCAGGAAGGAGGTG-3(加粗标记位点为酶切位点)。引物的设计和合成由美国Invitrogen公司完成。
二、方 法
1. pLVX-hTBC1D10C-mCMV-ZsGreen-PGK-Puro载体的构建
PCR扩增在引物中引入了EcoRⅠ和BamH Ⅰ酶切位点的hTBC1D10C,琼脂糖凝胶回收目的条带,提取目的基因NDA。对载体质粒pLVX-mCMV-ZsGreen-PGK-Puro和回收的目的hTBC1D10C基因行EcoRⅠ和BamHⅠ双酶切,酶切片段在T4 DNA Ligase的作用下连接,将连接产物转化至JM109感受态细菌,接种于含Amp+的培养基平板,次日挑选阳性单克隆菌群,Amp+药液培养过夜,提取质粒,经EcoRⅠ和BamHⅠ双酶切鉴定阳性后送美国Invitrogen公司进行测序验证。
2. rLV-hTBC1D10C-zpp慢病毒的包装、收集、扩增及滴度测定
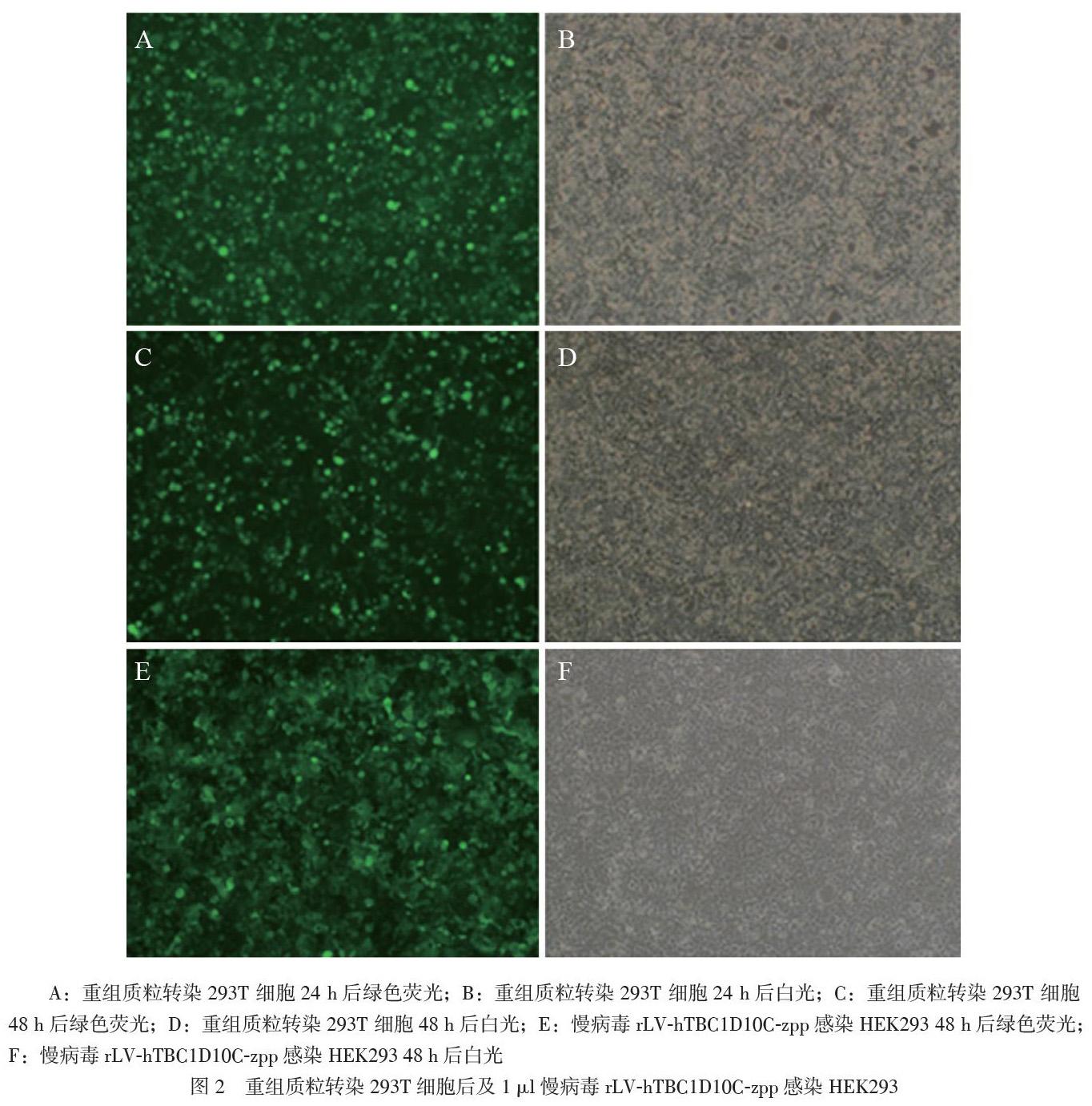
将携带目的hTBC1D10C基因的重组质粒pLVX-hTBC1D10C-mCMV-ZsGreen-PGK-Puro以及系统包装质粒用高效转染试剂盒(HET)转染至293T细胞,转染12 ~ 16 h后更换新鲜的完全培养基,换液后24 h收集病毒上清液置4℃冰箱保存,加入10 ml培养基继续培养,24 h后收集细胞和上清液置于离心管中,冻融3次与之前的病毒上清液合并,2000 rpm 离心 5 min,取上清即为病毒液初代原液。连续三代反复扩增收集病毒后,行病毒的大量扩增,对其纯化和浓缩后得到高滴度的慢病毒浓缩液,在人胚肾组织细胞293(HEK293)细胞中按照慢病毒包装试剂盒说明书测定并标定病毒滴度。
3. rLV-hTBC1D10C-zpp 功能鉴定
H9C2传代至108/L时接种于6孔板中,当细胞生长至90%融合时,每孔加入含1×105/L病毒的100 μl病毒液,孵育4 h后更换培养基,40 h后收集蛋白,蛋白免疫印迹法检测hTBC1D10C 蛋白表达。
三、统计学处理
应用SPSS 22.0对实验数据进行统计分析。正态分布计量资料采用表示,组间比较采用t检验;非正态分布计量资料以中位数(下四分位数,上四分位数)表示,组间比较采用秩和检验。P < 0.05为差异有统计学意义。
结果
一、pLVX-hTBC1D10C-mCMV-ZsGreen-PGK-Puro载体的构建DNAMAN 比对分析pLVX-hTBC1D10C-mCMV-ZsGreen-PGK-Puro质粒的基因测序结果,结果显示与hTBC1D10C序列一致(见图1),表明载体构建成功。
二、rLV-hTBC1D10C-zpp慢病毒的包装、收集、扩增及滴度测定
将制备的重组质粒pLVX-hTBC1D10C-mCMV-ZsGreen-PGK-Puro以及系统包装质粒共转染293T 细胞后,分别于24 h及48 h时进行收集。在HEK293细胞中按照慢病毒包装试剂盒说明书测定并标定病毒滴度。慢病毒rLV-hTBC1D10C-zpp滴度为:1×108 TU/ml,见图2。
三、rLV-hTBC1D10C-zpp 功能鉴定
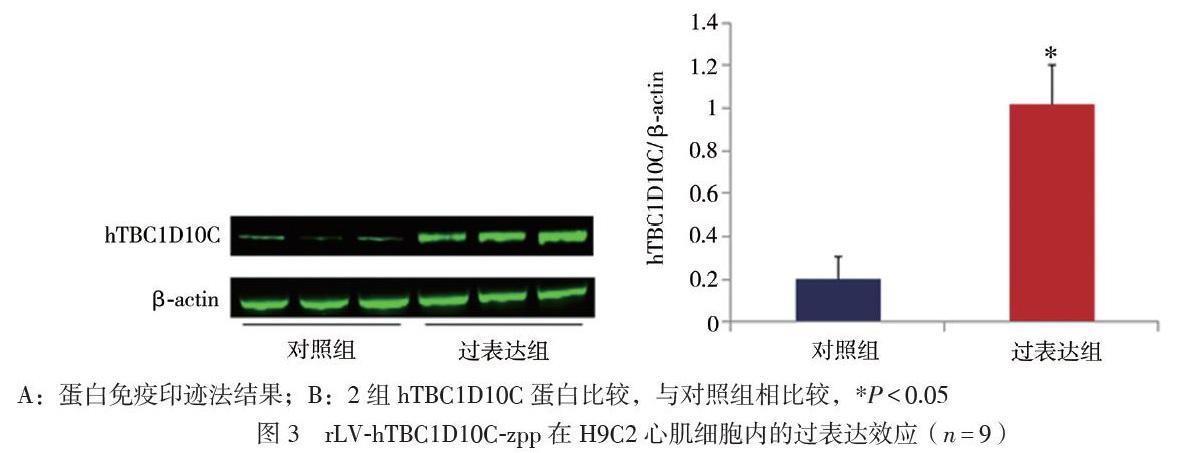
将构建成功的rLV-hTBC1D10C-zpp感染H9C2心肌细胞,48 h后提取总蛋白行蛋白免疫印迹法验证。结果显示,hTBC1D10C过表达组hTBC1D10C蛋白比对照组上升(t = 9.574,P < 0.001)。蛋白免疫印迹法验证hTBC1D10C过表达成功,结果见图3。
讨论
TBC1D10C是2007年Pan等[1]用酵母双杂交技术在人T淋巴细胞中对CaN结合蛋白进行筛选时所发现的一个新的CaN结合蛋白,同时可与Ras结合。经结构鉴定,TBC1D10C蛋白含有一個CaN 结合区域和一个Ras结合区域:CaN结合区域位于羧基端,其最小结合区域为羧基末端的41个氨基酸残基(aa406-446);Ras结合区域为氨基端的89位到294位氨基酸(aa89-294)[1]。经在体和离体实验的功能鉴定:①CaN 结合区域,TBC1D10C的转录和表达依赖于CaN信号通路的活化,而产生的TBC1D10C可与CaN结合,进而抑制CaN信号通路,因此TBC1D10C是作为CaN的负反馈抑制蛋白来发挥其调节作用的;②Ras结合区域,具有Ras GAP活性,可特异性地抑制Ras/ERK1/2信号通路。前期研究表明,在T淋巴细胞及B淋巴细胞中TBC1D10C作为CaN的内源性负反馈抑制蛋白通过CaN-NFAT和Ras/ERK1/2信号通路负反馈抑制T淋巴细胞及B淋巴细胞的持续活化,在机体免疫中发挥着重要作用[1-4]。最近研究表明,TBC1D10C在心肌细胞中亦有表达,可通过负性调节CaN-NFAT、Ras/ERK1/2CaN及Ras-CaMKⅡ信号通路抑制心肌细胞的肥大,并有可能成为诊治心衰的心肌肥厚靶点[5-6]。
我们的前期研究显示,在小鼠冠状动脉左前降支结扎诱导的心肌梗死动物模型中,术后第7日及第14日梗死区域TBC1D10C的mRNA及蛋白表达水平均显著下调,同时在经缺血/缺氧处理的人心室肌细胞株AC16中表达亦均显著下调[7]。那么下调的TBC1D10C在心肌梗死中是否会起到一定的作用呢,目前尚无相关研究报道。如前所述,TBC1D10C为一新发现的蛋白,目前尚未发现其特异性激活剂,鉴于此,本研究利用慢病毒载体,定向克隆人TBC1D10C基因,以此达到TBC1D10C过表达的作用,为TBC1D10C的研究奠定基础。
伴随着分子生物学技术的不断发展与成熟,各种可以改变基因表达水平的手段和方法日趋进步。目前,用于外源性基因导入的载体主要包括质粒、腺病毒、腺相关病毒、慢病毒和逆转录病毒载体。与其他载体相比,慢病毒载体对非分裂和分裂细胞均具有感染能力,可以将外源基因有效地整合到宿主细胞染色体上,使外源性基因能长期稳定的高效表达[8-10]。使得慢病毒成为实现长期稳定高效表达的理想载体。因考虑后期研究涉及动物及细胞实验,对过表达转染效率要求高,因此研究组决定采用腺病毒载体构建人TBC1D10C过表达载体。
在rLV-hTBC1D10C-zpp构建过程中,我们首先将人TBC1D10C基因定向克隆至pLVX-hTBC1-D10C-mCMV-ZsGreen-PGK-Puro载体,经测序验证后与系统包装质粒共转染293T细胞,培养24 ~ 48 h后收集病毒原液,再连续三代反复行病毒扩增。病毒滴度测定后,感染H9C2心肌细胞行rLV-hTBC1D10C-zpp功能鉴定,蛋白免疫印迹法验证hTBC1D10C过表达成功说明rLV-hTBC1D10C-zpp构建成功。rLV-hTBC1D10C-zpp的成功构建为TBC1D10C在心肌梗死及缺血中的作用机制奠定了实验基础。
参 考 文 献
[1] Pan F, Sun L, Kardian DB, Whartenby KA, Pardoll DM, Liu JO. Feedback inhibition of calcineurin and Ras by a dual inhibitory protein Carabin. Nature, 2007, 445(7126):433-436.
[2] Schickel JN, Pasquali JL, Soley A, Knapp AM, Decossas M, Kern A, Fauny JD, Marcellin L, Korganow AS, Martin T, Soulas-Sprauel P. Carabin deficiency in B cells increases BCR-TLR9 costimulation-induced autoimmunity. EMBO Mol Med, 2012, 4(12):1261-1275.
[3] Jiang W, Zhou X, Li Z1, Liu K, Wang W, Tan R, Cong X, Shan J, Zhan Y,Cui Z, Jiang L, Li Q, Shen S,Bai M,Cheng Y,Li B, Tan M, Ma DK, Liu JO, Dang Y. Prolyl 4-hydroxylase 2 promotes B-cell Lymphoma progression via hydroxylation of Carabin. Blood,2018, 131(12):1325-1336.
[4] Hsu C, Morohashi Y, Yoshimura S, Manrique-Hoyos N, Jung S, Lauterbach MA, Bakhti M, Gr?nborg M, M?bius W, Rhee J, Barr FA, Simons M. Regulation of exosome secretion by Rab35 and its GTPase-activating proteins TBC1D10A-C. J Cell Biol, 2010, 189(2) : 223-232.
[5] Bisserier M, Berthouze-Duquesnes M, Breckler M, Tortosa F, Fazal L,de Régibus A, Laurent AC, Varin A, Lucas A, Branchereau M, Marck P, Schickel JN, Deloménie C, Cazorla O,Soulas-Sprauel P, Crozatier B, Morel E,Heymes C, Lezoualch F. Carabin protects against cardiac hypertrophy by blocking calcineurin, Ras, and Ca2+/calmodulin-dependent protein kinase II signaling. Circulation,2015, 131(4):390-400.
[6] Yi X, Li X, Jiang X. Carabin: endogenous calcineurin inhibitor, a potential diagnostic and therapeutic target for cardiac hypertrophy in heart failure. Int J Cardiol, 2016, 212:57-58.
[7] 吳庆,姚浩旗,程阔菊, 唐建芳,黄河,陈建,李洪,杨天德. Carabin 过表达对人心室肌细胞 AC16 氧糖剥夺后凋亡的影响. 第三军医大学学报, 2018, 40(22):2068-2073.
[8] 雷梅先. 慢病毒介导LXRs过表达对高糖诱导H9C2细胞凋亡的影响及机制. 南昌:南昌大学, 2014.
[9] 彭丹, 钟小敏. 应用双靶标CRISPR慢病毒载体在间充质干细胞中稳定敲除lncRNA DANCR基因. 中山大学学报(医学版), 2019, 40(1):15-22.
[10] 王萱, 易寰, 刘佳, 李敏,彭福华. 慢病毒介导BTLA转染未成熟树突状细胞的研究. 新医学, 2015, 46(12):803-807.
(收稿日期:2019-08-12)
(本文编辑:杨江瑜)
