重度脊柱侧弯术后合并肠系膜上动脉综合征肠外肠内联合营养支持一例
2020-03-04何凯茵叶艳彬杨军林阮佩珊
何凯茵?叶艳彬?杨军林?阮佩珊
【摘要】肠系膜上动脉综合征(SMAS)主要表现为腹痛、腹胀、恶心、呕吐,但由于其缺乏特异症状和体征很容易被误诊。该文对1例重度脊柱侧弯术后并发SMAS患者进行个体化营养支持,即采用了肠内营养和肠外营养联合支持治疗,明显改善了患者的胃肠道症状及营养状况,为严重脊柱侧弯术后发生的胃肠功能紊乱的营养治疗提供临床依据,该例提示重度脊柱侧弯术后合并SMAS的患者更适合肠内营养联合肠外营养支持治疗。
【关键词】 脊柱侧弯;肠系膜上动脉综合征;营养支持
Parenteral and enteral nutritional support for a severe scoliosis patient complicated with superior mesenteric artery syndrome after surgery: a case report He Kaiyin, Ye Yanbin, Yang Junlin, Ruan Peishan. Department of Clinical Nutrition, the First Affiliated Hospital of Sun Yat-sen University, Guangzhou 510080, China
Corresponding author, Ye Yanbin, E-mail: yanbinye72@163.com
【Abstract】Superior mesenteric artery syndrome (SMAS) is mainly characterized by abdominal pain, abdominal distention, nausea and vomiting. However, it is likely to be misdiagnosed due to lacking of specific signs and symptoms. In this article, one case of severe scoliosis complicated with postoperative SMAS received individualized nutritional therapy, which integrated enteral with parenteral nutritional support. The gastrointestional symptoms and nutritional status of the patient were significantly improved, which provided clinical evidence for nutritional support for gastrointestinal dysfuction after severe scoliosis surgery. This case prompts that enteral combined with parenteral nutrition therapy is recommended for severe scoliosis patients complicated with postoperative SMAS.
【Key words】Scoliosis;Superior mesenteric artery syndrome;Nutritional therapy
肠系膜上动脉综合征(SMAS)临床症状表现多样,主要为餐后呕吐伴上腹胀痛,呕吐物为含胆汁的胃内容物,通常在呕吐或变换体位后症状可缓解。由于SMAS在临床上少见,发生率仅在0.013% ~ 0.300%,很容易被误诊[1]。
脊柱侧弯术后并发SMAS的治疗一般采用非手术治疗,如胃肠减压、更换体位与营养支持等。其中,营养支持是脊柱侧弯术后并发SMAS治疗的重要环节。我院于2017年11月收治了1例重度脊柱侧弯术后并发SMAS的患者,通过联合肠外肠内营养支持治疗后,患者胃肠道症状以及各项生化指标得到明显改善,现报道如下。
病例报告
一、病史及体格检查
患者女,21岁。3岁发现背部不平,当地医院拍片提示“脊柱侧弯”,未行处理。现患者为行手术来诊,于2017年11月29日门诊拟“脊柱侧弯”收入院,cobb角大于40度,自入院以来饮食、大小便正常。体格检查:身高152 cm,体质量42.5 kg,营养风险筛查(NRS2002)评分3分,主观整体营养状况评定(SGA)B级。
二、實验室检查、治疗及转归
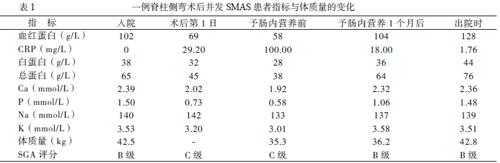
红细胞4.9×1012/L,血红蛋白102 g/L,白蛋白38 g/L,总蛋白65 g/L。心电图、X线胸片未见明显心肺异常。患者于2017年12月5日行脊柱侧弯矫正术,术后第4日出现左侧液气胸,术后第16日出现腹胀、呕吐、呼吸困难、持续发热。钡餐提示胃蠕动明显减低,考虑胃动力不足。CT提示降结肠下段-乙状结肠-直肠扩张并较多积粪积液。经胃肠外科会诊考虑SMAS,予留置鼻胃管持续胃肠减压、胸腔穿刺置管引流、全肠外营养支持(主要处方内容:脂肪乳氨基酸(17)葡萄糖(11%)注射液1440 ml+浓氯化钠+氯化钾+复合维生素及微量元素)、抗感染治疗等。术后第30日,患者腹胀呕吐好转,皮肤及巩膜黄染,仍无大便。
术后体格检查:身高163 cm,体质量35.3 kg;CRP、白细胞等感染指标及转氨酶、胆红素升高,电解质紊乱,营养指标下降(详细实验室指标变化见表1),予胃镜下置入空肠营养管行肠内营养支持(主要处方内容:低脂+谷氨酰胺+益生菌,250 ml,每日3次,可提供热量560 kCal/d,蛋白质25 g/d),继续予肠外营养并停用脂肪乳剂。8日,
患者出现腹泻,胃液引流量较多(约2100 ml/d),予调整肠内营养方案(烤米+低脂+整蛋白+谷氨酰胺+益生菌+盐,300 ml,每日3次,提供热量720 kCal/d,蛋白质37 g/d),持续胃管引流减压,随胃肠耐受情况逐渐增加肠内量及营养密度。
术后第81日,患者整体情况好转,每日2 ~ 3次成形灰黄色大便,胃液引流量减少,予胃引流管每日夹闭3 h开放1 h,逐渐增加肠内营养至1500 ml/d(烤米+整蛋白+低脂+短肽+蛋白粉+谷氨酰胺+益生菌,500 ml,每日3次,提供热量1785 kCal/d,蛋白质90 g/d),减少肠外营养量。术后第89日,予拔除胃引流管,逐渐增加肠内营养热能及蛋白质等营养(配方同前,提供热量1910 kCal/d,蛋白质97 g/d),停用肠外营养。术后第109日,患者无发热及胃肠道症状,各项感染指标及营养指标正常,可经口进食少量米糊和白粥,继续予肠内营养支持。术后第120日,患者经口进食逐渐增加,可进食云吞和半碗米饭,体质量增加至42.8 kg,予拔除空肠管后出院。
讨论
脊柱侧弯矫正术后并发SMAS的发病机制如下:首先,在脊柱矫形术后,脊柱伸直、躯干部拉长,肠系膜上动脉与腹主动脉之间的间隙由宽敞变为狭窄,导致十二指肠受压;第二,随着脊柱侧弯的矫正,Treitz韧带会产生紧张上提,有可能造成十二指肠受压梗阻;第三,脊柱侧弯矫正后,腹壁由松弛变为紧张,再加上患者术后通常使用石膏背心固定,更加会导致本来受压的十二指肠进一步出现梗阻症状;第四,患者体质量下降、内脏脂肪减少,导致肠系膜上动脉与腹主动脉之间的脂肪垫减少,从而夹角减小压迫十二指肠。
脊柱侧弯矫正术后的患者若出现肠梗阻症状时,应该考虑SMAS。SMAS首选保守治疗,可指导患者进食易消化的食物,少食多餐,切忌暴饮暴食和刺激性食物。餐后宜变换体位,采取仰卧位或膝肘位。如症状严重的患者,呕吐症状明显,胃液持续潴留,可先予禁食、持续胃肠道减压、全肠外营养支持。当患者呕吐和胃潴留症状减轻时,可开始予肠内营养联合肠外营养支持。
肠外营养支持最好使用全合一三升袋配方,提供充足非蛋白热能、氮、电解质、维生素及微量元素,安全耐受好。提高营养液的能量可以改善患者的负氮平衡,增加腹膜后脂肪含量,扩大肠系膜上动脉和腹主动脉的夹角,从而改善SMAS[2]。而通过空肠管给予肠内营养,选用低脂类和短肽类营养素,并加入益生菌和谷氨酰胺,有助于肠道吸收、改善炎症反应和调节肠道菌群。早期使用肠内营养可促进胃肠道功能的恢复,减少肠道菌群的移位[3]。
本例患者在术后初期腹胀、呕吐、胃潴留症状严重,且伴有严重的营养不良和低蛋白血症,无法经口进食进行肠内营养支持。因此我们采用持续胃肠减压和肠外营养支持。在症状减轻后,开始联合使用肠内营养与肠外营养支持,并根据患者胃肠道症状调整肠内营养液配方,选用低脂和谷氨酰胺配方减轻胃肠道刺激和改善炎症反应,后根据患者耐受情况改为整蛋白、低脂、短肽、谷氨酰胺、益生菌配方增加能量。早期使用肠内营养也有助于纠正肠道菌群失衡、提高患者免疫力、降低机体炎症反应[4]。随着肠道功能的改善,逐渐增加肠内营养的量和营养密度,减少肠外营养直至停用。患者的体质量、血红蛋白和白蛋白等营养指标及CRP感染指标明显改善,而且反复的低钾血症也得到改善。3个月后,患者可开始经口进食,大小便正常,逐停用肠外营养支持并增加肠内营养液供给量,患者营养指标恢复正常。
人体肠道有着庞大的细菌族群,是人体内细菌分布最多的场所。在正常生理情况下,人体肠道内定植的有益菌、有害菌和中性菌,以适当的比例维持着动态平衡,与人体组成微生态环境。若机体受到一些外界刺激,肠道的菌群比例就可能会发生变化,从而导致肠道菌群失衡[5]。脊柱矫正术后的患者发生肠道菌群失衡有以下原因:第一,术前肠道的准备会大量降低肠道菌群的数量;第二,手术的刺激、术后感染和抗生素的使用可直接破坏肠道的定植抗力,影响菌群类型导致菌群失衡。第三,麻醉因素,术后胃肠道并发症如呕吐、腹泻以及术后禁食和持续胃肠道减压都会导致胃肠道功能减退,进一步恶化肠道生态菌群的稳定性。
我们给本例患者的肠内营养配置液内加入益生菌2 ~ 4 g/d(每克含50亿个菌落形成单位活性益生菌,包含嗜酸乳杆菌、长双歧杆菌、副干酪乳杆菌、鼠李糖乳杆菌、发酵乳杆菌、瑞士乳杆菌、嗜热链球菌)。在肠内营养中加入益生菌,不仅可以增加肠道有益菌的数量使之容易在肠道发生定植,其中的乳酸菌还会释放乳酸,保护及改善肠道微生态环境。另外,益生菌还可以诱导机体免疫细胞的活化和降低炎症因子的水平,从而改善免疫功能、加快切口愈合、降低感染的发生[6]。另一方面,该患者的肠内营养液中加入了谷氨酰胺(15 g/d),可帮助改善肠道免疫功能、稳定肠道菌群平衡、抑制炎症及应激反应[7]。总之,早期联合使用益生菌、谷氨酰胺和肠内营养对术后患者的肠道菌群稳定、肠道免疫功能的提高、改善免疫功能及全身炎症反应安全性高且有显著疗效,值得在今后的临床中推广使用。
对于脊柱侧弯术后并发胃肠道功能紊乱及营养不良病例,采用肠内营养联合肠外营养治疗及调整肠道功能的方法效果显著,值得临床推广应用。
参 考 文 献
[1] Sabbagh C, Santin E, Potier A, Regimbeau JM. The superior mesenteric artery syndrome: a rare etiology for proximal obstr-uctive syndrome. J Visc Surg,2012,149(6):428-429.
[2] Takehara K, Sakamoto K, Takahashi R, Kawai M, Kawano S, Munakata S, Sugimoto K, Takahashi M, Kojima Y, Fukunaga T, Kajiyama Y, Kawasaki S. Superior mesenteric artery synd-rome improved by enteral nutritional therapy according to the controlling nutritional status score. Case Rep Gastroenterol,2017,11(3):729-735.
[3] 公丕欣. 加速康复外科理念在特重烧伤患者营养支持中的应用研究. 中华护理教育, 2014,11(6): 454-456.
[4] 朱永建, 舒建昌,陈健鑫,黄海锋. 急性胰腺炎的营养支持治疗研究进展.新医学,2018,49(3):145-149.
[5] Russell SL, Gold MJ, Hartmann M, Willing BP, Thorson L, Wlodarska M, Gill N, Blanchet MR, Mohn WW, McNagny KM, Finlay BB. Early life antibiotic-driven changes in microbiota enhance susceptibility to allergic asthma. EMBO Rep,2012,13(5):440-447.
[6] 尹玉花. 早期肠内营养联合益生菌对重症急性胰腺炎患者的疗效. 临床医药文献杂志(电子版), 2016, 3(18): 3703-3704.
[7] Fan J, Wu J, Wu LD, Li GP, Xiong M, Chen X, Meng QY. Effect of parenteral glutamine supplementation combined with enteral nutrition on Hsp90 expression and lymphoid organ apoptosis in severely burned rats. Burns,2016,42(7):1494-1506.
(收稿日期:2019-07-12)
(本文編辑:杨江瑜)
