GPD1L在肾透明细胞癌中的表达及其临床意义
2020-03-04刘仁许晓明罗勇冯源发周瑞钟惟德
刘仁?许晓明?罗勇?冯源发?周瑞?钟惟德


【摘要】目的 分析甘油磷酸脱氢酶1样抗原(GPD1L)在肾透明细胞癌中的表达及其临床意义。方法 选用包含79例肾透明细胞癌及10例肾脏正常组织的组织芯片,使用免疫组织化学染色法(免疫组化)检测GPD1L蛋白的表达情况,并运用癌症基因组图谱(TCGA)数据库收集包含GPD1L mRNA资料的肾透明细胞癌患者相关资料。观察组织芯片中肾脏正常组织与肾透明细胞癌组织GPD1L蛋白的表达部位及表达强度,分析TCGA中肾脏正常组织与肾透明细胞癌组织GPD1L基因的表达水平差异。按基因芯片或TCGA中肾透明细胞癌GPD1L蛋白或mRNA表达情况分为高表达组与低表达组,分析肾透明细胞癌患者GDP1L蛋白或mRNA表达与临床特征及总体生存期(OS)的关系。应用单因素和多因素Cox比例风险回归分析肾透明细胞癌患者OS的影响因素。结果 组织芯片中,GPD1L蛋白阳性染色呈棕黄色或褐色,在肾透明癌细胞与肾脏正常组织中主要表达于肾小管上皮的细胞胞质中,GPD1L蛋白在肾透明细胞癌组织表达强度低于其在正常肾脏组织中的表达强度(P < 0.001),GPD1L蛋白低表达组中病理分级高和临床分期晚者比例高于高表达组(P均< 0.05)。TCGA中,肾透明细胞癌组织GPD1L mRNA表达水平低于肾脏正常组织(P < 0.05),GPD1L mRNA低表达组中女性、病理分级高、临床分期晚、有转移、死亡者比例均高于高表达者(P均< 0.05), GPD1L mRNA低表达组OS低于高表达组(P < 0.001)。Cox比例风险回归分析显示,GPD1L mRNA表达水平、年龄、肿瘤转移为肾透明细胞癌OS的影响因素(P均< 0.05)。结论 GPD1L的表达与肾透明细胞癌密切相关,可考虑作为临床诊断及预后的分子标志物。
【關键词】肾透明细胞癌;甘油磷酸脱氢酶1样抗原;预后
Expression and clinical significance of GPD1L in clear cell renal carcinoma Liu Ren, Xu Xiaoming, Luo Yong, Feng Yuanfa, Zhou Rui, Zhong Weide. Department of Urology Surgery, Guangzhou First Peoples Hospital, Guangdong Key Laboratory of Clinical Molecular Medicine and Diagnostics, Guangzhou Medical Univ-ersity, Guangzhou 510180, China
Corresponding author, Zhong Weide, E-mail: wdezhong@ 21cn. com
【Abstract】Objective To investigate the expression and clinical significance of GPD1L (glycerol-3-phophate dehydrogenase 1 like) in clear cell renal carcinoma. Methods Tissue microarrays including 79 cases of clear cell renal carcinoma and 10 cases of normal tissuess were selected. The expression level of GPD1L protein was detected by immunohistochemistry. Relevant data including GPD1L mRNA data of patients were collected by the TCGA database. The expression location and intensity of GPD1L protein were quantitatively analyzed between two groups. The expression level of GPD1L mRNA was statistically compared between two groups in TCGA database. According to the expression levels of GPD1L protein and mRNA in the microarray or TCGA database, all patients were assigned into the high and low expression groups. The correlation between the expression of GPD1L mRNA, clinical features and overall survival (OS) was analyzed. The influencing factors of OS were identified by univariate and multivariate Coxs proportional hazard regression analyses. Results In the tissue microarray, GPD1L protein was positively stained as yellow brown or brown, mainly expressed in the cell cytoplasm of the renal tubular epithelium of the clear cell renal carcinoma and normal renal tissues. The expression intensity of GPD1L protein in the clear cell renal carcinoma was significantly lower than that in normal renal tissues (P < 0.001). The proportion of patients with high grade and late clinical stage in the low expression of GPD1L protein group was significantly higher compared with that in the high expression group (both P < 0.05). In TCGA database, the expression level of GPD1L mRNA in the clear cell renal carcinoma tissues was remarkably lower than that in the normal renal tissues (P < 0.05). In the low expression of GPD1L mRNA group, the proportion of female patients, those with high pathological grade, high clinical stage, metastasis and death was significantly higher compared with those in the high expression group (all P < 0.05). In addition, the OS in the low expression group was significantly shorter than that in the high expression group (P < 0.001). Coxs proportional hazard regression analysis demonstrated that the expression level of GPD1L mRNA, age and tumor metastasis were the influencing factors of the OS of patients (all P < 0.05). Conclusion The expression of GPD1L is intimately correlated with clear cell renal carcinoma, which can be considered as a molecular marker for clinical diagnosis and prognosis.
【Key words】Renal clear cell carcinoma;GPD1L;Prognosis
肾细胞癌起源于肾脏表皮,90%的肾癌都属于肾细胞癌。这种恶性肿瘤包括了超过10种组织和分子亚型,对后续的诊断和治疗都造成了很大的困扰。肾透明细胞癌是肾细胞癌中最常见的类型,接近75%的肾细胞癌都是肾透明细胞癌,而且也是致死率最高的肾细胞癌种类[1]。虽然肾细胞癌的临床治疗研究在近年已经取得了很大的进步,但是肾细胞癌的自然病史和预后都呈现多样性,有的发展缓慢,有的可表现出高度的侵袭性[2]。临床医师需要通过早期诊断为患者提供最佳的个体化治疗方案,所以寻找特异度高、灵敏度强的分子生物学指标势在必行。这既可以避免众多医疗资源的浪费,又可以客观评估肿瘤的潜在转移侵袭性和预后,对于肾透明细胞癌的个体化治疗有着重要的意义[3]。
甘油三磷酸脱氢酶1样抗原(GPD1L)的编码蛋白是一种蛋白酶,催化甘油三磷酸转变为磷酸甘油酮。GPD1L编码蛋白存在于与质膜相关的细胞质中,在该处结合钠通道、电压门控、V型、α亚单位(SCN5a)。该基因的缺陷可导致布鲁加达综合征2型(BRS2)和婴儿猝死综合征(SIDS)[4]。近年来,非编码RNA尤其是微小RNA(miR)和肿瘤之间的研究发展迅速,多项研究显示miR-210可以靶向抑制GPD1L从而促进了肿瘤在缺氧环境中的生长,而同时miR-210又是缺氧诱导因子-1(HIF-1)的下游靶点,在多种肿瘤生长发展中起着重要作用[5]。业已证实,GPD1L在头颈癌、肝细胞癌等肿瘤中扮演重要角色[6-7]。但是,GPD1L在肾细胞癌尤其是透明细胞癌中的作用还没有相关的文章报道。组织芯片是将许多不同个体组织标本以规则阵列方式排布于同一载体上,这样可以在同一实验条件下进行同一指标的组织学研究,一次性实验即可获得大量的结果。癌症基因组图谱(TCGA)公共数据库是通过采用高通量基因组测序、基因芯片运用多维数据整合分析方法将几乎人类所有恶性肿瘤基因表达水平图谱绘制出来的数据库,通过对TCGA数据库的研究可以为恶性肿瘤的诊断、分类标准和治疗方法提供新的策略。本次采用的组织芯片包括79例肾透明细胞癌样本及10例正常肾脏组织样本,并利用TCGA中肾透明细胞癌的mRNA数据库进行临床数据分析,旨在研究GPD1L在肾透明细胞癌中的表达及其临床意义。
材料与方法
一、材 料
组织芯片购自西安艾丽娜生物科技有限公司(BC07115a)。每张芯片包含79例肾透明细胞癌标本和10例正常肾脏组织标本,所有病例均为接受肾癌切除手术治疗,手术前均未接受放射治疗或化学治疗。所有标本均经过HE染色并由病理科医师明确诊断。每例标本均附有相关临床数据,如年龄、性别、病理分级、肿瘤分期,见表1。
二、数据下载
TCGA肾透明细胞癌数据库是一个包含553例肾透明细胞癌组织及对应癌旁肾脏正常组织的大样本基因测序库,本研究纳入其中有GDP1L基因检测结果及详细临床资料的530例肾透明细胞癌及对应癌旁肾脏正常组织进行分析,具体的临床信息和分子特征来源于TCGA网站(http:// cancergenome.nih.gov/),见表1。
三、GPD1L蛋白表达强度检测
使用迈新生物技术UltraSensitiveTM SP IHC 试剂盒对组织芯片进行免疫组织化学染色(免疫组化),60 ℃烘烤组织芯片40 min,使用二甲苯、无水酒精、95%酒精、80%酒精、70%酒精梯度脱蜡,过氧化氢溶液封闭15 min,减低内源性过氧化物酶活性,之后使用0. 01 mmol/L枸橼酸盐缓冲液(pH 6.0)进行抗原修复,待组织芯片自然冷却至室温,血清封闭。一抗GPD1L(1∶100,爱博泰克生物,货号A14392)4 ℃孵育过夜,二抗室温孵育60 min,三抗室温孵育15 min,二氨联苯胺试剂盒显色,苏木素复染细胞核。免疫组化评分由两位病理专科医师独立完成,芯片染色结果根据着色强度和着色范围进行评估。染色强度根据镜下所见的肾小管上皮细胞的颜色深度分为0、1、2、3共4个等级,染色范围分为0(无着色)、1 (0% ~ 10%)、2 (10% ~ 50%)、3(51% ~ 75%)、4(76% ~ 100%)共5个等级,最终得分为染色强度与染色范围的乘积。
四、研究方法
观察组织芯片中肾脏正常组织与肾透明细胞癌组织GPD1L蛋白的表达部位及表达强度,分析TCGA中肾透明细胞癌组织与对应癌旁肾脏正常组织GPD1L基因的表达水平差异。按基因芯片中肾透明细胞癌GPD1L蛋白表达强度分为高表达(免疫组化得分> 6分)组与低表达(免疫组化得分 ≤6分)组,按TCGA中肾透明细胞癌GDP1L mRNA表达水平分为高表达(mRNA表达水平>均值)组与低表达(mRNA表达水平≤均值)组,分析肾透明细胞癌患者GDP1L表达与临床特征的关系。观察TCGA中肾透明细胞癌患者的预后,使用总体生存期(OS)作为研究的终点,OS是指从确诊肾透明细胞癌至患者死亡或最后一次随访之间的时间,绘制肾透明细胞癌患者的生存曲线,分析GDP1L对预测肾透明细胞癌患者预后的意义。
五、統计学处理
使用SPSS 24.0处理数据。计量资料以表示,组间比较采用t检验。计数资料以例(%) 表示,组间比较采用χ2检验。采用Kaplan-Meier法绘制生存曲线。应用单因素和多因素Cox比例风险回归分析肾透明细胞癌患者预后的影响因素。P < 0.05表明差异有统计学意义。
结果
一、组织芯片中肾透明细胞癌GPD1L蛋白的表达部位及表达强度分析
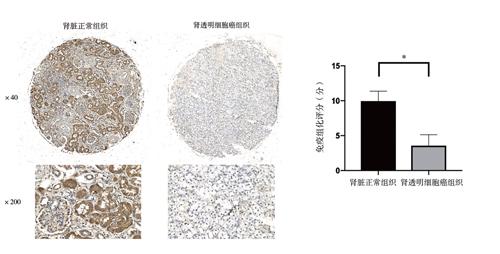
组织芯片中,GPD1L蛋白阳性染色呈棕黄色或褐色,在肾透明细胞癌与肾脏正常组织中主要表达于肾小管上皮的细胞胞质中,见图1A。免疫组化组织芯片分析显示,GPD1L蛋白在肾透明细胞癌组织表达强度为(3.32±2.65)分,在肾脏正常组织中表达强度为(9.87±1.33)分,组间比较差异有统计学意义(t = 12.705,P < 0.001),见图1B。
二、組织芯片中肾透明细胞癌GPD1L蛋白表达强度与肾透明细胞癌患者临床特征的分析
肾透明细胞癌组织芯片中,GPD1L高表达23例、低表达56例。低表达组中病理分级高和临床分期晚者比例高于高表达组(P均< 0.05),见表2。
三、TCGA中GPD1L mRNA表达水平与肾透明细胞癌患者临床特征及预后的分析
TCGA中,肾透明细胞癌组织GPD1L mRNA表达水平低于肾脏正常组织(t = 21.293,P < 0.05),
见图2A。GPD1L mRNA高表达265例、低表达265例。低表达者中女性、病理分级高、临床分期晚、有转移、死亡者比例均高于高表达者(P均< 0.05),见表2。GPD1L mRNA低表达组OS低于高表达组(P < 0.001),见图2B。
四、TCGA中影响肾透明细胞癌患者OS的单因素及多因素分析
对TCGA肾透明细胞癌患者的单因素分析显示,GPD1L mRNA低表达、年龄大、临床分期晚、病理分级高、出现转移者OS较短(P均< 0.05);多因素分析显示,GPD1L mRNA表达水平、年龄、肿瘤转移是肾透明细胞癌患者OS的影响因素(P均< 0.05),见表3。
讨论
在所有的肾细胞癌组织亚型中,肾透明细胞癌超过了80%,而且肾透明细胞癌是致死率、侵袭率、转移率最高的组织亚型,对传统化学治疗和放射治疗的抵抗也最强[8]。虽然近年肾透明细胞癌的治疗研究取得了很大的进展,新的手术方式、分子靶向药物的应用提高了患者的预后[9]。但是目前仍缺乏对肾透明细胞癌患者早期诊断和预后的有效评估指标,导致后续无法进行有针对性的个体化治疗,或是诊断过晚或病情进展迅速而耽误治疗时机,或是治疗过度而浪费了大量金钱和精力。寻找反映疾病进展过程中生理状态和细胞变化的新生物标志物对肾透明细胞癌患者进行个体化治疗和预测预后有重要意义。
GPD1L是编码催化甘油三磷酸转变为磷酸甘油酮的关键酶。已经有报道GPD1L作为miR-210的直接靶点,在肿瘤形成缺氧环境过程中发挥着重要作用,并已在肝癌、头颈癌等有相关的研究[10]。目前,GPD1L在肾细胞癌尤其是肾透明细胞癌中的作用尚缺乏相关的研究。本研究中,与肾脏正常组织相比,GPD1L在肾透明细胞癌组织中的蛋白水平下降,这表明GPD1L可能抑制了肾透明细胞癌的发生和发展。此外,GPD1L蛋白的低表达与高病理分期、临床转移相关,因此导致肾透明细胞癌患者预后较差。免疫组化检测到的GPD1L蛋白表达与TCGA数据库中mRNA低表达均为肾透明细胞癌患者OS的影响因素。
肾透明细胞癌被认为是一种代谢相关的肿瘤疾病,缺氧的微环境在其发生和发展起着重要的作用,而其中缺氧诱导因子-1α(HIF-1α)扮演着重要的角色[11]。miR-210作为HIF-1α的下游,直接抑制着GPD1L的表达;而根据本研究结果,GPD1L可考虑作为肾透明细胞癌预后预测指标,这提示miR-210可以作为肾透明细胞癌的重要靶点,2017年Costales研究团队发现了一种可以直接抑制miR-210的小分子药物可提高GPD1L的表达[12]。对于其是否可以应用在肾透明细胞癌的治疗中,还需要日后进一步的研究。
参 考 文 献
[1] Hsieh JJ, Purdue MP, Signoretti S, Swanton C, Albiges L, Schmidinger M, Heng DY, Larkin J, Ficarra V. Renal cell carcinoma. Nat Rev Dis Primers,2017,3:17009.
[2] 范大为,刘凯,袁成刚,杜晓媛. Beclin-1与 EZH2在肾透明细胞癌中的表达及其意义. 新医学, 2016,47(5): 329-334.
[3] Li QK, Pavlovich CP, Zhang H, Kinsinger CR, Chan DW. Challenges and opportunities in the proteomic characterization of clear cell renal cell carcinoma (ccRCC): a critical step towards the personalized care of renal cancers. Semin Cancer Biol,2019,55:8-15.
[4] Valdivia CR, Ueda K, Ackerman MJ, Makielski JC. GPD1L links redox state to cardiac excitability by PKC-dependent phosphorylation of the sodium channel SCN5A. Am J Physiol Heart Circ Physiol, 2009, 297(4):H1446-H1452.
[5] Gee HE, Ivan C, Calin GA, Ivan M. HypoxamiRs and cancer: from biology to targeted therapy. Antioxid Redox Signal, 2014, 21(8):1220-1238.
[6] Feng Z, Li JN, Wang L, Pu YF, Wang Y, Guo CB. The prognostic value of glycerol-3-phosphate dehydrogenase 1-like expression in head and neck squamous cell carcinoma. Histopathology, 2014, 64(3):348-355.
[7] Sulaiman SA, Abu N, Ab-Mutalib NS, Low TY, Jamal R. Signatures of gene expression, DNA methylation and microRNAs of hepatocellular carcinoma with vascular invasion. Future Oncol, 2019, 15(22):2603-2617.
[8] Barata PC, Rini BI. Treatment of renal cell carcinoma: current status and future directions. CA Cancer J Clin, 2017, 67(6):507-524.
[9] Li QK, Pavlovich CP, Zhang H, Kinsinger CR, Chan DW. Challenges and opportunities in the proteomic characterization of clear cell renal cell carcinoma (ccRCC): a critical step towards the personalized care of renal cancers. Semin Cancer Biol, 2019, 55:8-15.
[10] Kelly TJ, Souza AL, Clish CB, Puigserver P. A hypoxia-induced positive feedback loop promotes hypoxia-inducible factor 1alpha stability through miR-210 suppression of glycerol-3-phosphate dehydrogenase 1-like. Mol Cell Biol, 2011, 31(13):2696-2706.
[11] Sch?del J, Grampp S, Maher ER, Moch H, Ratcliffe PJ, Russo P, Mole DR. Hypoxia, Hypoxia-inducible transcription factors, and renal cancer. Eur Urol, 2016, 69(4):646-657.
[12] Costales MG, Haga CL, Velagapudi SP, Childs-Disney JL, Phinney DG, Disney MD. Small molecule inhibition of microRNA-210 reprograms an oncogenic hypoxic circuit. J Am Chem Soc, 2017, 139(9):3446-3455.
(收稿日期:2019-09-18)
(本文編辑:林燕薇)
