注射用头孢哌酮钠他唑巴坦钠与输液配伍稳定性研究
2020-03-04马亚松李敏贾玉捷孙燕杨宏硕华北制药河北华民药业有限责任公司河北石家庄050000
马亚松 李敏 贾玉捷 孙燕 杨宏硕(华北制药河北华民药业有限责任公司,河北 石家庄 050000)
0 引言
头孢哌酮为第三代头孢菌素类抗生素,能够抑制细菌细胞壁合成而起到杀菌作用,他唑巴坦对β—内酰胺酶有抑制作用,二者发挥协同抗菌作用。适用于上呼吸道、下呼吸道、泌尿系统等中、重度感染。在用于治疗由对头孢哌酮单药敏感菌与对头孢哌酮单药耐药、对本品敏感的产β-内酰胺酶菌引起的混合感染时,不需要加用其它抗生素。
1 仪器和试药
1.1 仪器
高效液相色谱仪(HP1100);METTLER电子天平(AB104);酸度计(上海精密科学仪器公司PHS-3C);澄明度检测仪(天津大学YB-2)。
1.2 药品和试剂
注射用头孢哌酮钠他唑巴坦钠(4:1)2.0g(自制,批号EV7 130101);头孢哌酮对照品(中国药品生物制品检定所以下简称中检所,批号130420-200304);他唑巴坦对照品(中检所,批号130511-200402)头孢哌酮杂质C(中检所,批号130617-201001);头孢哌酮S异构体(中检所,批号130412-200902);7-氨基头孢烷酸(中检所,批号130538-200902);他唑巴坦复合物A(GOK022,批号:1643394)。
2 方法和结果
2.1 实验方法
色谱条件与系统适用性:用十八烷基硅烷键合硅胶为填充剂:以甲醇0.0025mol/L四丁基氢氧化铵溶液(34:66,用磷酸调节pH值至4.0)为流动相;柱温40℃;检测波长220nm。取头孢哌酮对照品、他唑巴坦对照品、头孢哌酮杂质A及头他哌酮S异构体适量(先以乙腈溶解),再加流动相稀释成每1mL中各约含0.1mg的混合溶液,取10μl注入液相色谱仪,按头孢哌酮杂质A、他唑巴坦、头孢哌酮和头孢哌酮S异构体的顺序出峰,理论板数按他唑巴坦峰计算应不低于3500,各峰间的分离度均应符合规定。
含量测定:取约60mg样品,精密称定,置100mL量瓶中,用流动相溶解并稀释至刻度,摇匀,精密量取10μl,注入液相色谱仪,记录色谱图;取头孢哌酮对照品与他唑巴坦对照品适量,精密称定,加流动相溶解并定量稀释制成每1mL中含头孢哌酮0.5mg和他唑巴坦0.12mg的溶液,同法测定,按外标法以峰面积计算出供试品中C25H27N9O8S2和C10H12N4O5S的含量。
有关物质测定:取本品,精密称定,加流动相制成每1mL中约含头孢哌酮0.5mg与他唑巴坦0.125mg的溶液,作为供试品溶液(配制后立即测定);精密量取1mL,置100mL量瓶中,用流动相稀释至刻度,摇匀,作为对照溶液;另精密称取头孢哌酮杂质A和头孢哌酮杂质C对照品适量,加流动相溶解并定量稀释制成每1mL中分别约含10μg的头孢哌酮杂质A和5μg的头孢哌酮杂质C的混合溶液,作为杂质对照品溶液(出峰顺序依次为头孢哌酮杂质A和头孢哌酮杂质C)。照含量测定项下的色谱条件,取对照溶液20μl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为头孢哌酮满量程的15%~20%;再精密量取供试品溶液、杂质对照品溶液和对照溶液各20μl,分别注入液相色谱仪,记录色谱图至头孢哌酮峰保留时间的2.5倍。供试品溶液的色谱图中如有杂质峰,扣除流动相峰,含头孢哌酮杂质A和头孢哌酮杂质C按外标法以峰面积计算,分别不得过2.0%和1.0%,其他单个杂质峰面积不得大于对照溶液两个主峰面积和的1.5倍(1.5%),其他各杂质峰面积的和不得大于对照溶液两个主峰面积和的2倍(2.0%),供试品溶液色谱图中任何小于对照溶液两个主峰面积和0.05倍的峰可忽略不计。
2.2 试验结果
取本品8瓶,其中4瓶每瓶用5%葡萄糖溶液250ml溶解,另4瓶每瓶用0.9%氯化钠注射液250ml溶解,每种溶剂的第一瓶都是在溶解后,立刻摇匀,精密量取2ml,置25ml量瓶中,加流动相溶解稀释至刻度,经0.45μm微孔滤膜滤过,按有关物质色谱项进样分析,第二、第三和第四瓶在溶解后室温放置0.5h、1.0h和1.5h后,按第一瓶的方法测定,试验结果见表1。
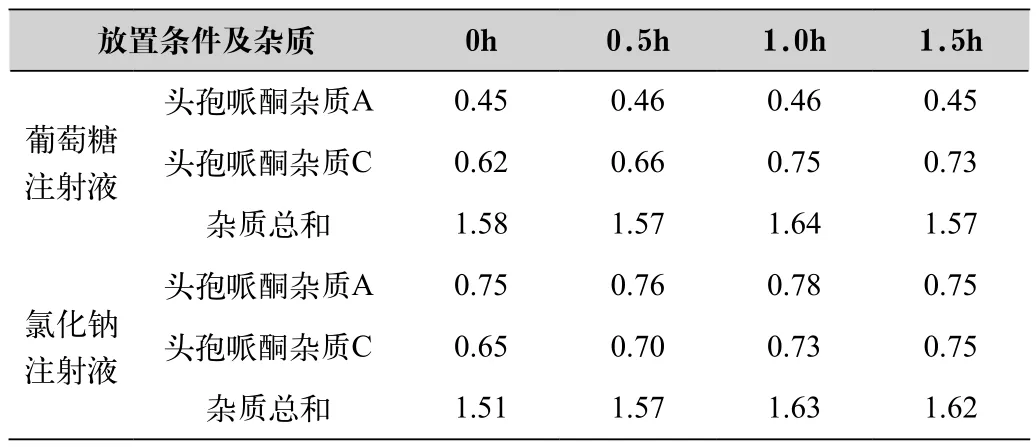
表1 供试品在不同溶液中的有关物质考察结果
取本品8瓶,除去标签,外壁用乙醇擦净,置干燥器干燥1~2h,除去铝盖,编号,内容物用葡萄糖溶液或氯化钠溶液转移至250mL量瓶中,分别再用同种溶剂溶解并稀释至刻度,再精密量取7mL,至25mL量瓶中,用相应溶剂稀释至刻度,经0.45um微孔滤膜过滤后进样分析,第二、第三和第四瓶在溶解后室温放0.5h、1.0h和1.5h后,按第一瓶的方法测定,计算含量及RSD,结果见表2。

表2 供试品在不同溶液中的含量考察结果
取本品20瓶,每5瓶为一份,每瓶分别用上述溶液4mL溶解,合并同种溶剂的溶解液,约每隔0.5h测定1次pH值,连续测定4次,样品溶液pH值变化情况见表3。
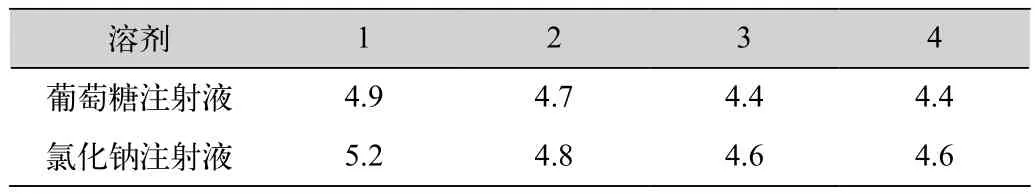
表3 供试品在不同溶液中的pH考察结果
取本品40瓶,每20瓶为1份,每瓶分别用上述两种溶液25mL溶解,合并同种溶剂溶解液,约每隔0.5h照光阻法测定1次不溶性微粒,连续测定5次,样品溶液不溶性微粒变化情况见表4。
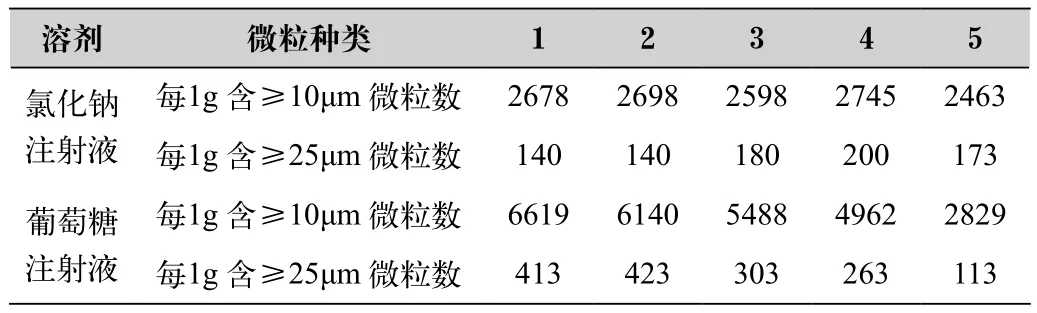
表4 供试品在不同溶液中的不溶性微粒考察结果
3 结果讨论
(1)本品在葡萄糖注射液和氯化钠注射液中的稳定性一致,检出的杂质总量接近,在1.5h内较稳定。
(2)本品在两种注射液中溶解后的含量基本一致,且在1.5h内不随放置时间的增加而变化。
(3)本品在两种注射液中pH值有差异,且随放置时间的延长有下降趋势。
(4)本品不溶性微粒数目在两种溶液中有差异,且随着放置时间的延长在葡葡糖注射液中的微粒个数有明显变化,而氯化钠溶液中所测得的微粒数基本稳定。
4 结论
本品用氯化钠注射液和葡萄糖注射液配制用于临床差异不大,但在上述溶液中放置的时间越长,产生的杂质和pH值有明显的变化,因此在上市产品说明书中强调了滴注时间应为30~60min,这也是为了保证注射本品时的安全性。
