连续药饵投喂方式下恩诺沙星及其代谢物环丙沙星在大黄鱼体内的残留消除研究
2020-03-04张天闻
张天闻
(福建省渔业资源监测中心,福建 福州 350003)
恩诺沙星(Enrofloxacin)是人工合成的第三代喹诺酮类化合物——氟喹诺酮类药物中的一种,具有抗菌谱广、抗菌活性强等特点[1],对大多数革兰氏阴性菌、部分革兰氏阳性菌及某些支原体、衣原体、立克次氏体等均有抑菌作用[2],因此在畜禽和水产养殖中被广泛使用。同时,恩诺沙星在动物体内的主要代谢产物为环丙沙星(Ciprofloxacin),环丙沙星同样也具有较强的抗菌活性,从而进一步提升了恩诺沙星作为抗菌药的使用效果。由于此类药物的滥用易引起致病菌耐药性的增强,一方面将导致生态环境的恶化,另一方面也对水产品的食用安全带来隐患[3],因此在《渔药使用规范》(SC/T 1132—2016)中将恩诺沙星列入水产养殖处方用药品种目录中,在使用过程中需严格遵守使用规定。对此我国相关部门也制定了相关要求进行控制,例如我国现行的《无公害食品 渔用药物使用准则》(NY 5071—2002)中将环丙沙星列为禁用药物;“中华人民共和国农业部公告 第235号动物性食品中兽药最高残留限量”中规定恩诺沙星及其代谢产物环丙沙星在水产动物肌肉中的总残留量不得超过100 μg/kg[4]。
大黄鱼(Larimichthyscrocea)是我国最大规模的海水养殖鱼类[5],福建为其主要养殖集中地区,2017年福建省大黄鱼养殖产量为15.05×104t,占全国大黄鱼养殖总产量的84.7%[6],2017年福建省大黄鱼出口创汇达1.78亿美元,占全国大黄鱼出口额的83.2%[7]。在开放式高密度的养殖过程中,大黄鱼常受到各种疾病的侵害,严重影响着大黄鱼养殖产量和渔民利益。其中白点病是危害大黄鱼养殖最严重的病害,其治疗特效药正是恩诺沙星[8-9],这也导致近年在相关部门的抽检中,时常发生大黄鱼恩诺沙星超标问题。目前针对恩诺沙星在水生动物体内的药物残留消除研究较多,如针对大菱鲆(Scophthalmusmaximus)[10-11]、牙鲆(Paralichthysolivaceus)[12]、鲟(Acipenser)[13]、日本鳗鲡(Anguillajaponica)[14]、中国对虾(Fenneropenaeuschinensis)[15]、罗氏沼虾(Macrobrachiumrosenbergii)[16]、凡纳滨对虾(Litopenaeusvannamei)[17]、拟穴青蟹(Scyllaparamamosain)[18]、乌鳢(Ophiocephalusargus)[19]、三疣梭子蟹(Portunustrituberculatus)[20]、中华绒螯蟹(Eriocheirsinensis)[21-22]等,但针对大黄鱼体内恩诺沙星和环丙沙星的残留消除研究较少,尤其是采用最接近实际养殖的投喂方式开展的研究尚未见报道。
本研究以大黄鱼为受试对象,模拟真实养殖过程,首次采用药饵投喂方式对恩诺沙星及其代谢物环丙沙星在大黄鱼体内的残留规律进行探索,提出养殖过程中恩诺沙星的给药方案和休药期建议,为指导大黄鱼健康养殖和保障水产品质量安全提供科学依据。
1 材料与方法
1.1 实验对象与养殖条件
于2017年4月,购买网箱养殖的大黄鱼250尾,平均体重为(250±28)g,鱼体健康。实验前在养殖池(规格为长8 m×宽4 m,装载水体20 t,材料为红砖水泥池)中暂养15 d,暂养期间每日投喂2次,减少人为因素对大黄鱼的干扰,使实验用鱼逐渐适应环境和投喂方式。暂养期间随机抽取7尾实验用鱼,进行血浆、肌肉和肝脏组织中恩诺沙星及环丙沙星检测,确认无恩诺沙星和环丙沙星残留。实验用饲料为人工配合饲料,经检测均不含恩诺沙星和环丙沙星。在整个实验过程中,大黄鱼养殖池水温维持在(20±3)℃,养殖水从海区抽取经过三级沙滤后流入养殖池,养殖过程中持续充氧,盐度为33~35,pH为8.0~8.5。实验期间实验组、对照组大黄鱼饲养成活率均为100%。
1.2 仪器与试剂
QTRAP 5500液相色谱-串联质谱仪(美国 AB SCIEX公司),Acquity I-Class超高效液相色谱仪(美国 Waters公司);BP211D电子天平(德国Sartorius公司);3-30K高速冷冻离心机(德国Sigma公司);旋转蒸发仪(瑞士Buchi公司);超声波清洗器(昆山超声仪器有限公司);Milli-Q超纯水系统(美国Millipore公司)等。
实验用恩诺沙星原粉(纯度≥98%,CNW公司)及恩诺沙星、环丙沙星标准品(纯度≥98%,CNW公司),恩诺沙星-D5、环丙沙星-D8(德国Witega公司)。肝素钠(国药集团化学试剂有限公司);乙腈、乙酸铵(色谱纯,Merck公司);甲酸(色谱纯,Tedia公司);无水硫酸钠(分析纯,国药集团),经650℃灼烧4 h,冷却后贮存于密封容器中备用。
1.3 给药方式与样品采集
精确称取恩诺沙星5.000 g,用适量5%冰醋酸溶解,再用超纯水定容至100 mL,摇匀,得到恩诺沙星溶液浓度为50 mg/mL,喷洒于1 000 g饲料上搅拌均匀,制备成恩诺沙星含量为5 mg/g的药饵颗粒。给药前1 d停饲,按每日给药量25 mg/kg鱼体质量的药饵连续饲喂5 d,其中设置1组空白对照组投喂无药饲料。第5天药饵投喂结束后,所有实验池后续均使用无药饲料进行投喂。在最后一次投喂药饵后的8、12 h以及1、2、3、7、10、15、20和30 d,每个采样时间点采集7尾大黄鱼,分别采集大黄鱼血浆、肌肉和肝脏组织,其中以尾静脉采血的方式采集血浆,将采集的血浆转移至2 mL预先用1%肝素钠溶液处理过的离心管中,以3 000 r/min离心10 min,取上清液于-20℃保存待检;肌肉和肝脏组织样品制为均匀样品后,于-20℃贮存备用。
1.4 检测方法
本研究采用高效液相色谱质谱串联法检测恩诺沙星及环丙沙星[23],方法简要介绍如下:
色谱柱为Waters Acquity BEH C18柱,50 mm×2.1 mm,粒径1.7 μm;流动相为0.1%甲酸溶液(含5 mmol/L乙酸铵)和乙腈,采用梯度洗脱分离;流速0.200 mL/min;进样量1.00 μL。使用大气压喷雾电离源(ESI),正离子模式,采用选择反应监测(MRM)扫描模式。
对于肌肉和肝脏样品,参照“农业部1077号公告-1-2008水产品中17种磺胺类及15种喹诺酮类药物残留量的测定 液相色谱-串联质谱法”[24]的方法进行样品前处理检测。对于血浆样品,取1.00 mL血浆样品至10 mL离心管中,准确加入25 μL 1.00 mg/L内标溶液,加入5 mL 1%甲酸-乙腈溶液(V/V),涡旋混合1 min,再加入3 g无水硫酸钠,再次涡旋混合1 min,以 10 000 r/min转速离心5 min。残渣重复提取一次,上清液转移至25 mL鸡心瓶中,40℃水浴旋蒸至近干,用1 mL流动相溶解,过0.22 μm滤膜后上机检测。
在样品检测过程中,通过添加平行样品、基质加标样品和空白样品进行质量控制。由于前期采样点样品中环丙沙星和恩诺沙星含量较高,因此可采用适当减少称样量,或同倍数的加大定容体积和同位素内标加入量,确保样液检测浓度在检测标准工作曲线范围内。
2 结果与分析
2.1 分析方法回收率与精密度[23]
本研究所用分析方法对恩诺沙星及环丙沙星在1~500 μg/L范围内线性关系良好,曲线方程分别为Y=1.771 0X+0.003 62和Y=1.892 67X-0.076 07,相关系数R2分别为0.999和0.998,两种沙星在血浆、肌肉和肝脏三种组织中的检测限分别为2 μg/L、1 μg/kg和2 μg/kg。在加标水平2~100 μg/L时,方法回收率在87.0%~109%,相对偏差小于8.7%(n=6),结果表明本方法满足残留分析要求。
2.2 恩诺沙星及环丙沙星在大黄鱼组织中的残留情况
连续药饵投喂大黄鱼后,其血浆、肌肉和肝脏中的恩诺沙星和环丙沙星的含量变化均随着休药时间的延长逐渐下降(图1~3)。恩诺沙星含量在大黄鱼的血浆、肝脏和肌肉中较快达到最大值,达峰时间分别为8、12和12 h,浓度分别为3.068 mg/L、3.446 mg/kg和4.089 mg/kg;在给药后的前3 d下降明显,血浆中的恩诺沙星浓度从最高的3.068 mg/L降至0.522 mg/L,肌肉和肝脏中的恩诺沙星含量分别从最高的3.446 mg/kg和4.089 mg/kg降至0.422 mg/kg和0.276 mg/kg;之后药物浓度下降速度明显变慢,一直到给药后的第30天,恩诺沙星在血浆、肌肉和肝脏中仍均可检出,浓度分别为0.017 mg/L、0.051 mg/kg和0.025 mg/kg。
相比于恩诺沙星浓度,在大黄鱼各组织中环丙沙星浓度处于较低水平,表明恩诺沙星在大黄鱼体内仅有少部分代谢成环丙沙星。血浆和肌肉中的环丙沙星峰值均出现在第8 h,峰浓度分别为0.104 mg/L和0.355 mg/kg,之后下降迅速。肝脏中的环丙沙星含量在12 h达到峰值,峰浓度为0.753 mg/kg,随后3 d内较快下降至0.059 mg/kg,之后消除速率变慢。给药10 d后,血浆中的环丙沙星不再检出,但直至给药后的第30天,肌肉和肝脏中仍可检出极低含量的环丙沙星,含量分别为5.66×10-3和2.31×10-3mg/kg。
3 讨论
3.1 环丙沙星在大黄鱼体内的残留消除规律
已有研究表明恩诺沙星进入水生生物体内后,98%仍以原药形式存在,作为其主要代谢产物的环丙沙星含量较低[25],本研究得到的结果也再次验证了这一现象。环丙沙星虽然为渔用禁用药物,但在实际使用恩诺沙星的过程中,不可避免会代谢产生环丙沙星。此外,中国农业部第235号公告[4]中的恩诺沙星残留限量也明确规定为恩诺沙星和其代谢产物环丙沙星的总残留量。因此,研究恩诺沙星代谢产物环丙沙星在大黄鱼体内的药物代谢动力学特征也同样具有重要意义。
恩诺沙星有多种代谢途径,最主要的是脱去乙基代谢成为环丙沙星,但其代谢程度存在种属差异。郑宗林等[22]研究恩诺沙星在中华绒螯蟹体内的代谢规律发现,恩诺沙星转化为环丙沙星的代谢率为1.4%~6.2%。Koc等[26]以10 mg/kg恩诺沙星口灌褐鳟(Salmotruttafario),给药后0.08~120 h,血浆中均未检测到环丙沙星。在本研究中,环丙沙星在大黄鱼血浆、肌肉和肝脏中均可检出,但环丙沙星占恩诺沙星和环丙沙星二者总量的比值较低,说明在大黄鱼中起抑菌作用的仍以恩诺沙星为主,代谢产物环丙沙星所起的作用较小。各组织间环丙沙星所占比值表现出了较大的差异性:在血浆、肌肉和肝脏中的环丙沙星分别占恩诺沙星和环丙沙星二者总量的比值为4.2%~7.5%、5.5%~16.7%、5.8%~23.8%,其中肝脏中环丙沙星的占比最高,其次为肌肉,血浆中的环丙沙星占比量最低,说明恩诺沙星主要是在肝脏中脱去乙基代谢成环丙沙星。
3.2 休药期的确定
与本实验采取药饵给药方式研究恩诺沙星在水生动物体内的药物代谢动力学不同的是,大多数研究者采取的是肌注或口灌给药方式。肌注和口灌给药方式可以精确控制每一个实验个体的药物注射剂量,但在实际养殖中操作难度较大,有可能对鱼体造成损伤,且针对种类复杂的水生生物体无法被广泛采用。投喂给药与实际生产最为接近,且适合大面积推广。但由于存在个体差异,投喂给药方式下的个体食药量无法精确控制。参考肌注或口灌给药实验模式,取样时间点样品采集较多选择为3尾[13]或5尾[18,27-29],本研究在每个取样点采集大黄鱼7尾,通过增加每批次实验个体数量,最大程度地减小个体差异带来的影响,最终得到的结果能够较好地模拟体现实际养殖中恩诺沙星在大黄鱼体内的残留代谢规律。
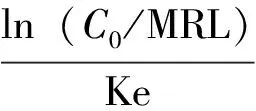
郭娇娇等[13]对杂交鲟(施氏鲟Acipenserschrenckii♂×达氏鳇Husodauricus♀)以10 mg/kg的剂量进行单次口灌给药,得到休药期至少为20 d。梁俊平等[10]以20 mg/kg的剂量对大菱鲆进行肌注和口服给药,得到休药期肌注应不低于30 d,口服应不低于45 d。李佳蔚等[31]以20 mg/kg的剂量对黑裙(Gephyrocharaxmelanocheir)单次灌服给药,得到休药期至少为35 d。徐维海等[15]以50 mg/kg的剂量对吉富罗非鱼(Oreochromisniloticus)和中国对虾连续投喂7 d,得到吉富罗非鱼的休药期为22 d,中国对虾的休药期为12 d。孙慧宇等[32]以20 mg/kg剂量连续饲喂泥鳅7 d,得到休药期应不小于32 d。余开等[20]以10 mg/kg的剂量对三疣梭子蟹(Portunustrituberculatus)口灌给药,得到三疣梭子蟹的休药期为14 d。由此可见,在不同的实验条件下,得到的恩诺沙星休药期数据均存在一定的差异,说明休药期与水产动物的种属、给药方式、给药剂量以及养殖水温等密切相关。
3.3 给药方案探讨
喹诺酮类药物对常见细菌的治疗效果通常与药动学和药效学参数有关。一般认为,当血浆中药物的峰浓度(Cmax)与最低抑菌浓度(MIC)的比值达到10以上时,即可起到良好的治疗效果,并且当Cmax/MIC=10时,效果最佳[33-34]。马寅等[35]测得恩诺沙星对溶藻弧菌(Vibrioalginolyticus)、最小弧菌(V.mimicus)、哈维氏弧菌(V.harveyi)、创伤弧菌(V.vulnificus)等4种常见的水产致病弧菌的MIC为0.1~0.8 mg/L,本研究中连续药饵投喂模式下,血浆中药物峰浓度Cmax为3.068 mg/L,处在最佳抑菌浓度范围内。可见在本实验条件下,恩诺沙星使用剂量对大黄鱼常见的细菌性疾病可以起到较好的治疗效果。
4 结论
在(20±3)℃水温条件下,以25 mg/kg恩诺沙星对大黄鱼采取连续药饵投喂给药,恩诺沙星在大黄鱼体内前期消除较快,并有少量代谢成为环丙沙星,建议在实际养殖过程中,连续投喂给药后,休药期应不少于18 d。
