僵蚕醇溶蛋白质的优化提取及其指纹图谱研究
2020-03-03王立勇黄佳滢朱锐灵徐悦汤建闻崇炜
王立勇 黄佳滢 朱锐灵 徐悦 汤建 闻崇炜

摘要:为优化僵蚕醇溶蛋白质的提取工艺,并建立相应的SDS-PAGE(十二烷基硫酸钠-聚丙烯酰胺凝胶电泳)、HPLC(高效液相色谱)、FTIR(傅里叶变换红外光谱)指纹图谱。在单因素试验的基础上,利用响应面法,以提取率为响应值建立数学模型,获得最佳工艺,用SDS-PAGE、HPLC、FTIR建立僵蚕醇溶蛋白质指纹图谱。通过单因素试验考察乙醇浓度、料液比、温度、提取时间对僵蚕醇溶蛋白质提取率的影响,进而用Box-Behnken法设计4因素3水平试验,进行响应面回归分析。结果表明,僵蚕醇溶蛋白质的最佳提取工艺条件为料液比1g∶24.22mL,乙醇浓度38.73%,温度35℃,提取时间3.94h,此时的提取率为0.5402%。用SDS-PAGE、HPLC、FTIR法建立僵蚕醇溶蛋白质指纹图谱,SDS-PAGE分析结果表明,僵蚕醇溶蛋白质分子量集中在16.7~36.2ku;HPLC分析结果表明,主要僵蚕醇溶蛋白质的保留时间为2.048min与3.354min,其含量分别占总蛋白量的31.23%与32.93%;FTIR分析结果表明,僵蚕醇溶蛋白质在2927.71、1631.71、1457.24、1310.71cm-1处有主要吸收峰。研究并建立了僵蚕醇溶蛋白质的优化提取条件,并获得了蛋白质的SDS-PAGE、HPLC、FTIR指纹图谱。
关键词:僵蚕;醇溶蛋白质;响应面法;FTIR指纹图谱;SDS-PAGE;HPLC
中图分类号:R284.2文献标志码:A
文章编号:1002-1302(2020)22-0196-06
作者简介:王立勇(1994—),男,福建福州人,硕士研究生,研究方向为分子生药学。E-mail:1395996384@qq.com。
通信作者:闻崇炜,博士,副教授,研究方向为分子生药学。E-mail:wenchw@ujs.edu.cn。
早在秦汉年间,《神农本草经》就收载僵蚕为祛风定惊、化痰散结的中品药材[1]。现代药理学研究发现,僵蚕具有抗癌、降血糖、抗菌、镇静催眠、抗凝血、神经营养及保护等多种作用[2-7]。目前研究认为,僵蚕富含的草酸铵是其抗惊厥、抗凝血的主要药理成分,槲皮素是其祛痰、止咳的药理成分。程锁明等利用反复硅胶柱色谱、十八烷基硅烷键合硅胶填料柱、液相色谱等方法进一步从僵蚕中分离得到(3α,6β)-3-苄基-6-异丙基-4-甲基-2,5-吗啡啉二酮等12个化合物[8]。殷志琦等应用硅胶柱层析和重结晶方法首次从僵蚕中分离得到6个化合物[9]。郭晓恒等从僵蚕的三氯甲烷部位分离鉴定出6,9-氧桥-麦角甾-7,22-双烯-3-醇、β-谷甾醇等多种化学成分[10]。但是,目前对僵蚕中含量最丰富的蛋白质还缺乏深入研究。
蛋白质具有重要的生物学功能,是生命活动的执行者。在稀盐、缓冲系统的水溶液作用下,蛋白质的溶解度大、稳定性好,因此它们是蛋白质提取的常用溶剂。乙醇溶液可用于提取植物中的醇溶性蛋白质[11-13],但能否用于提取僵蚕中的醇溶性蛋白质至今尚未见报道。响应面法可基于数学建模确定试验因素间的相互作用并进行工艺优化[14],目前已在蛋白质提取工艺的优化中得到广泛应用[15-18]。本研究旨在利用响应面法优化僵蚕醇溶蛋白质的提取工艺,并对其进行SDS-PAGE(十二烷基硫酸钠-聚丙烯酰胺凝胶电泳)、HPLC(高效液相色谱)、FTIR(傅里叶变换红外光谱)指纹图谱分析,旨在为其后续功能研究及开发应用提供参考。
1材料与方法
1.1材料与试剂
主要试验材料为僵蚕,购自亳州中药材市场,经江苏大学药学院欧阳臻教授鉴定为蚕蛾科昆虫家蚕4~5龄的幼蟲感染白僵菌后的致死干燥体。
主要试剂有蛋白质分子量标准品,购自赛默飞世尔科技有限公司;考马斯亮蓝R-250,购自北京中生瑞泰科技有限公司;溴酚蓝,购自Amresco公司;无水乙醇、牛血清白蛋白、甲醇、乙腈、溴化钾等试剂,均购自国药集团化学试剂有限公司。
1.2仪器与设备
主要设备有电子分析天平,购自Sartorius公司;酶标仪,购自美国MolecularDevices公司;数显恒温水浴锅,购自江苏省金坛市医疗仪器厂;微量台式离心机,购自美国ThermoScientific公司;冷冻干燥机,购自德国Marinchrist公司;Avatar-370型傅立叶变换红外光谱仪,购自美国尼高力仪器公司;安捷伦LC1200液相色谱仪,购自美国普惠公司。
1.3试验方法
1.3.1蛋白质的提取将僵蚕粉碎并过70目筛备用。取适量僵蚕粉末,按预设的料液比加入预设浓度的乙醇溶液,在恒温水浴箱中用预设温度水浴振荡提取醇溶蛋白质。水浴结束后,将样品于12000r/min离心10min,收集上清液备用。
1.3.2蛋白质提取率的测定以考马斯亮蓝法进行蛋白质定量,牛血清白蛋白为标准蛋白质,测定595nm处样品吸光度,建立标准曲线[19]。随后分别取200μL“1.3.1”节所得样品加入管A、管B中,A管加适量三氯乙酸,离心去除沉淀蛋白质;B管不作任何处理,根据A管及B管吸光度计算蛋白质吸光度,再根据标准曲线计算样品中的蛋白质含量,之后按下述公式计算蛋白质提取率:
蛋白质提取率=(mB-mA)/m×100%。
式中:mA为A管的蛋白质含量;mB为B管的蛋白质含量;m为提取用僵蚕粉末量。
1.3.3单因素试验(1)乙醇浓度对蛋白质提取率影响的试验。乙醇浓度分别设为20%、30%、40%、50%、60%、70%,温度为40℃,料液比为1g∶25mL,提取时间为4h。(2)料液比对蛋白质提取率影响的试验。料液比分别取1g∶10mL、1g∶15mL、1g∶20mL、1g∶25mL、1g∶30mL,提取温度为40℃,乙醇浓度为40%,提取时间为4h。(3)提取温度对蛋白质提取率影响的试验。提取温度分别取30、35、40、45、50、55℃,乙醇溶液浓度为40%,提取时间为4h,料液比为1g∶25mL。(4)提取时间对蛋白质提取率影响的试验。提取时间分别取1、2、3、4、5、6、7h,提取温度为40℃,乙醇浓度为40%,料液比为1g∶25mL。
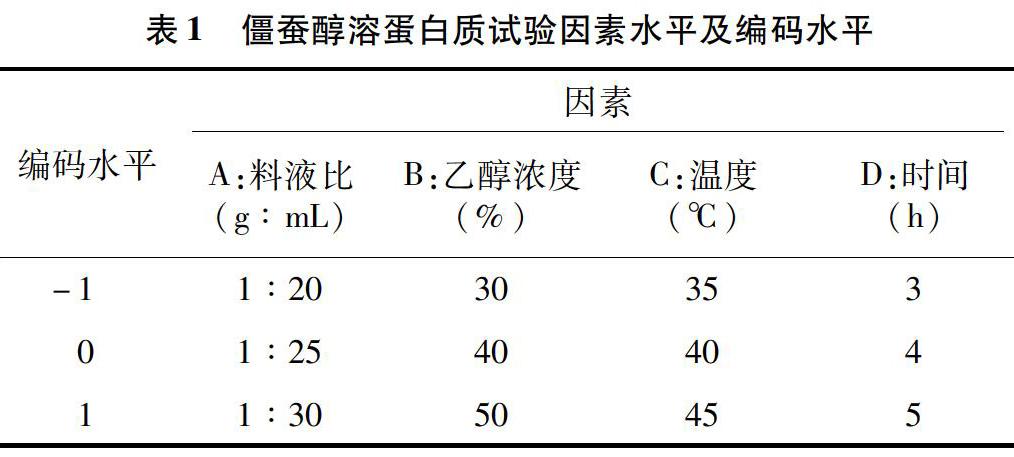
1.3.4响应面试验在单因素试验的基础上,采用Design-Expert8.0.6中的Box-Behnken中心组合试验设计响应面试验,以料液比、乙醇浓度、温度、时间为自变量,以提取率为响应值,采用响应面分析法对僵蚕醇溶蛋白质的提取工艺条件参数进行优化,其各因素的编码水平见表1。
1.3.5SDS-PAGE检测取适量蛋白质样品与上样缓冲液混合,沸水浴处理10min,得电泳样品。按照常规方法进行SDS-PAGE分析,分离胶浓度为10%,浓缩胶浓度为5%,于80V恒压电泳2h,当溴酚蓝指示剂距胶板底部边缘1~2cm时结束电泳,取下凝胶后进行染色、脱色[20]。
1.3.6凝胶分析用凝胶成像系统采集SDS-PAGE凝胶图像,用QuantityOne软件定量各条带的迁移率及灰度值,按如下公式计算各蛋白质的比例:
蛋白质比例=待测蛋白质灰度值/蛋白质总灰度值×100%。
1.3.7HPLC检测采用安捷伦LC1200液相色谱仪进行检测,色谱柱为EclipsePlusC18(100mm×4.6mmID),流动相为10%乙腈溶液,流速为0.5mL/min,进样量为20μL,检测波长为270nm。取适量冻干后的僵蚕蛋白质粉末溶解于适量流动相,再按照上述检测条件进行HPLC检测。
1.3.8FTIR检测取适量冻干后的僵蚕蛋白质粉末,加入适量溴化钾(KBr)粉末研磨混匀,压片后置于傅立叶红外光谱仪下,于4000~400cm-1范围内进行扫描。
2结果与分析
2.1单因素试验结果分析
由图1-A可知,当乙醇浓度达到40%前,提取率随着乙醇浓度的增加呈上升趋势;当乙醇浓度为40%时,提取率达到峰值为0.531%;之后继续提高乙醇浓度,提取率逐渐降低。这可能是因为乙醇浓度过高时,提取液的极性变小,使得蛋白质在提取液中的溶解度降低。因此,本研究选择乙醇提取浓度为40%。由图1-B可知,当料液比小于1g∶25mL时,随着料液比的增加,提取率呈明显上升的趋势;当料液比为1g∶25mL时,具有最大提取率,为0.532%;继续增加料液比,提取率没有显著变化。理论上说,料液比越大,提取液的黏度就越低,蛋白质就越容易溶出。当料液比达到1g∶25mL后,蛋白质的溶出趋于平衡,料液比的增加不再使提取率升高,过多的提取液反而会造成资源浪费和后续处理的困难。综合考虑,选择料液比为1g∶25mL。由图1-C可知,当温度低于40℃时,随着温度的上升,提取率逐渐升高,在温度为40℃时达到峰值,为0.519%;当温度继续提高时,提取率反而降低,这可能是因为随着温度的升高,蛋白质会发生变性,进而形成凝胶,从而增加了提取液的黏度,导致分离困难,并且过高的温度也会造成能耗的增加。综合考虑,选择提取温度为40℃。由图1-D可知,当提取时间小于4h时,提取率随着提取时间的增加而升高;当提取时间为4h时,提取率达到最大值,为0.532%,此时蛋白质的溶出率达到了动态平衡;当提取时间超过4h时,若继续增加提取时间,提取率反而下降,因此选择提取时间为4h。
2.2响应面结果分析
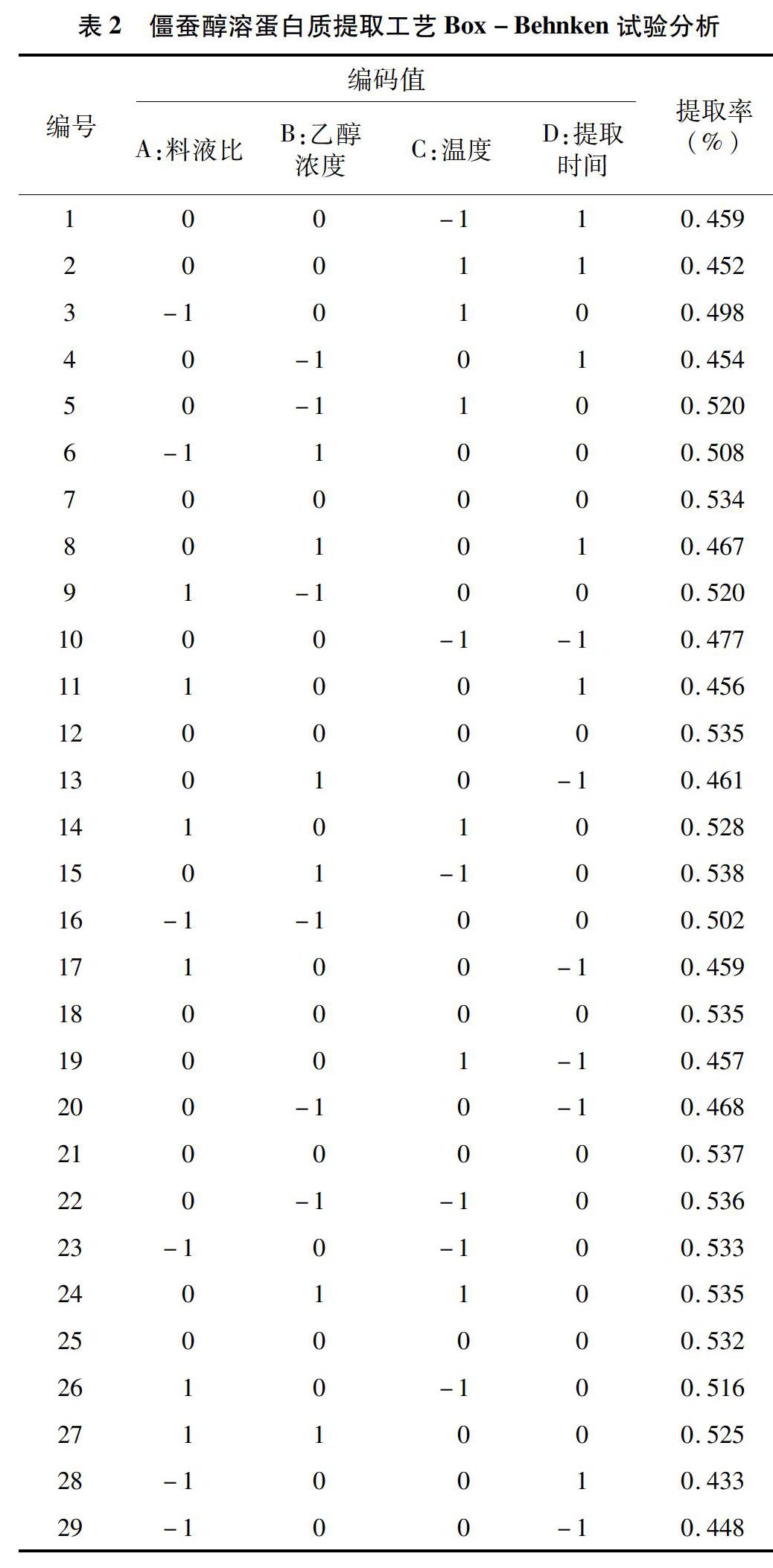
响应面法是一种结合数学方法与统计方法对所感兴趣的响应值受多个变量影响的问题进行建模和分析的数理统计方法,可以实现响应值的优化。本研究在单因素试验的基础上,以蛋白质提取率为效应值,以料液比、乙醇浓度、温度和提取时间为自变量进行响应面设计试验,结果见表2、表3。
从表3可看出,该模型P值显著、失拟项不显著,表明模型拟合得较好。另外,料液比、温度、提取时间对乙醇溶液提取僵蚕蛋白质的影响极显著,其中交互项AC、BD对僵蚕醇溶蛋白质提取率具有显著或极显著影响,结果如图2所示。
用Design-Expert8.0.6軟件对表3中的数据进行分析,拟合得回归方程:
Y=0.530+0.680A+0.280B-0.580C-0.410D-0.025AB+1.200AC+0.300AD+0.330BC+0.500BD+0.330CD-1.600A2-0.260B2-0.076C2-0.070D2。
从该回归方程可以看出,4个因素对僵蚕醇溶性蛋白质提取率影响的排序为料液比>温度>提取时间>乙醇浓度。通过软件计算分析,得出最佳僵蚕醇溶蛋白质提取工艺为料液比1g∶24.22mL,乙醇浓度38.73%,温度35℃,提取时间3.94h,在此条件下获得最佳僵蚕醇溶性蛋白质的提取率为0.5402%。
2.3验证试验
取3份僵蚕粉末,按照最佳提取工艺条件进行试验,重复3次,得到僵蚕醇溶蛋白质平均提取率为0.5417%。该结果与理论最大值一致,说明本试验的数学模型稳定可靠。
2.4SDS-PAGE指纹图谱分析
按照“1.3.5”节与“1.3.6”节方法进行僵蚕醇溶蛋白质的SDS-PAGE指纹图谱分析。由图3可以看出,用40%乙醇溶液提取的蛋白质样品为多种中小分子量(16.7~36.2ku)蛋白质形成的混合物,其中分子量较小(16.7~23.1ku)的蛋白质占蛋白质总量的74%,其迁移率为0.808~0.945;分子量较大(32.5~36.2ku)的蛋白质占蛋白质总量的24.8%,其迁移率为0.603~0.651。
2.5HPLC指纹图谱分析
按照“1.3.7”节所述方法进行僵蚕醇溶蛋白质的HPLC指纹图谱分析。如图4所示,共形成保留时间介于1.630~6.115min的6个色谱峰,其中主要醇溶蛋白质的保留时间分别为2.048、3.354min,其含量分别占总蛋白含量的31.23%、32.93%。
2.6FTIR指纹图谱分析
按照“1.3.8”节所述进行僵蚕醇溶蛋白质的FTIR指纹图谱分析。由图5可见,用40%乙醇提取的僵蚕蛋白质在4000~400cm-1范围内共有6个吸收峰,其中2927.71cm-1处为甲基、亚甲基的C—H伸缩振动峰,1631.71cm-1处为蛋白质酰胺Ⅰ带的C[FY=,1]O的伸缩振动峰,1457.24、1310.71cm-1处为C—H的弯曲振动吸收峰。冀宪领等曾报道,僵蚕75%乙醇提取物的FTIR指纹图谱的主要特征吸收峰为1723、1300、1210cm-1等[21],将其研究结果与本研究结果相结合,可为基于FTIR技术鉴定僵蚕提供较好的试验依据。
3结论与讨论
植物中含有较多的醇溶蛋白质,研究结果表
明,这些蛋白质具有良好的生物相容性、利用度及可降解性,可用作多种支架材料、黏附材料及载体材料,在食品及医药方面有广阔的应用前景[22-25]。但是,动物来源的醇溶蛋白质至今仍鲜有报道。本研究采用响应面法优化了僵蚕醇溶蛋白质的提取工艺,结果表明,最佳提取条件为料液比1g∶24.22mL,乙醇浓度38.73%,温度35℃,提取时间3.94h,蛋白质的最优提取率为0.5402%,建立了僵蚕醇溶蛋白质的SDS-PAGE、HPLC、FTIR指纹图谱,为后续僵蚕醇溶蛋白质的研究及开发利用创造了条件。
参考文献:
[1]马继兴.神农本草经辑注[M].北京:人民卫生出版社,1995:54.
[2]程杏安,蒋旭红,刘展眉,等.僵蚕七种化学成分抗肿瘤活性的初步研究[J].仲恺农业工程学院学报,2015,28(4):35-39.
[3]郭光业,王志成,晏青.运用正交试验筛选中药降血糖基本配方实验研究[J].中华实用中西医杂志,2000,13(19):1384-1386.
[4]项林平,柴卫利,王珏,等.僵蚕抑菌活性成分的提取及其对大肠杆菌的抑制作用[J].西北农林科技大学学报(自然科学版),2010,38(3):150-154.
[5]胡鹏飞,王敬平,范荣培,等.僵蚕提取物对小鼠自主活动的影响[J].时珍国医国药,2005,16(11):1113-1114.
[6]雷田香,彭延古,郝晓元,等.僵蚕抗凝作用的研究进展[J].湖南中医药大学学报,2007,27(3):76-77.
[7]KooBS,AnHG,MoonSK,etal.Bombyciscorpusextract(BCE)protectshippocampalneur-onsagainstexcitatoryaminoacid-[JP3]inducedneurotoxicity[J].ImmunopharmacologyandImmunotoxicology,2003,25(2):191-201.
[8]程锁明,翟银成,薛芳,等.僵蚕化学成分的研究[J].中草药,2015,46(24):3630-3636.
[9]殷志琦,叶文才,赵守训.僵蚕的化学成分研究[J].中国中药杂志,2004,29(1):56-58.
[10]郭晓恒,吴用彦,宋登敏,等.僵蚕氯仿部位的分离纯化及其抗惊厥活性[J].中国医药工业杂志,2014,45(5):431-433.
[11]李毳,柴宝峰,梁爱华,等.油松种子醇溶蛋白提取剂比较[J].应用与环境生物学报,2006,12(1):125-127.
[12]程谦伟,郭兴凤,熊拯.玉米的综合开发——醇溶蛋白的提取[J].粮食科技与经济,2006(6):43-45.
[13]芶琳,李文博,倪苏,等.马铃薯醇溶蛋白电泳分析方法的建立[J].安徽农业科学,2011,39(1):71-72.
[14]李莉,张赛,何强,等.响应面法在试验设计与优化中的应用[J].实验室研究与探索,2015,34(8):41-45.
[15]伊莉,吴锁柱,孟琼宇,等.响应面优化胡麻粕蛋白提取工艺及其功能性质研究[J].食品研究与开发,2019,40(18):52-57.
[16]程海涛,申献双.响应面优化喷射流空化-机械研磨协同强化大豆粕蛋白溶解的研究[J].中国油脂,2019,44(9):54-58,70.
[17]陈建旭,黄生权,敖宏,等.赤灵芝中水溶性蛋白响应面法优化提取[J].现代食品科技,2009,25(6):661-664,668.
[18]张红霞,赖佳慧,王倩,等.响应面法优化苦荞蛋白质提取工艺[J].粮食科技与经济,2019,44(8):93-96.[HJ2mm]
[19]徐杰伟,温少磊,蔡早育.考马斯亮蓝法测定微量蛋白的条件探讨[J].实验与检验医学,2003,21(5):353-354.
[20]闻崇炜,毛春友,胡萍萍,等.Tricine蛋白质电泳定量检测溶菌酶方法的研究[J].江苏农业科学,2012,40(5):290-292.
[21]冀宪领,盖英萍,牟志美,等.白僵蚕的红外指纹图谱鉴别研究[J].光谱学与光谱分析,2007,27(1):66-69.
[22]DongJ,SunQ,WangJY.Basicstudyofcornprotein,zein,asabiomaterialintissueengine-ering,surfacemorphologyandbiocompatibility[J].Biomaterials,2004,25(19):4691-4697.
[23]谢俊俊,吴鸿飞,鲁传华,等.应用生物可降解材料玉米醇溶蛋白制备胃肠道生物黏附控释片[J].中国组织工程研究与临床康复,2011,15(12):2146-2148.
[24]李敏,王瑶,王双双,等.玉米醇溶蛋白支架生物相容性及在牙周缺损修復中的应用[J].中国组织工程研究,2016,20(25):3726-3731.
[25]李晓晖,黄文娟,周伟,等.反溶剂法制备姜黄素-高粱醇溶蛋白复合颗粒及其特性分析[J].食品科学,2018,39(6):7-12.
