非小细胞肺癌患者血清HMGB1和PD-L1检测的临床分析
2020-03-03朱蓓方亮王营营
朱蓓 方亮 王营营
肺癌为近年来临床发病率及死亡率增长最快的恶性肿瘤,其在男性中的发病率及致死率均位居各肿瘤之首,在女性中也位居第2位[1],对人类的生命健康造成严重威胁。肺癌的发病机制目前尚未完全明确,长期大量吸烟、环境因素、大气污染及肺部慢性疾病等均与之相关[2]。多数肺癌源于支气管粘膜上皮,病理类型以非小细胞肺癌(non-small cell lung cancer,NSCLC)多见,约占83%[3]。随着临床对NSCLC发病机制及治疗方案不断的深入研究,在肿瘤免疫及靶向治疗方面也取得一定进展。在肿瘤的治疗过程中,肿瘤的病理特征及侵袭性对于治疗方案的选择往往起重要作用。本研究旨在探讨NSCLC患者血清HMGB 1及PD-L1水平与肿瘤病理特征及侵袭性的关系,为NSCLC的治疗后预后提供重要参考。
对象与方法
1 资料来源 选择2016年1月~2018年1月本院78例经病理确诊的NSCLC肿瘤科住院患者为观察组,NSCLC诊断及临床分型、分期参考美国国立综合癌症网络NSCLC诊断治疗指南[4]。其中男51例,女27例;年龄41~67岁,平均(53.2±6.3)岁;病理分型:腺癌47例,鳞癌31例;分级:高分化26例、中分化29例、低分化23例;分期:Ⅰ期~Ⅱ期34例,Ⅲ期21例,IV期19例;32例发生淋巴结转移,46例未发生淋巴结转移。另选取同期48例健康自愿者为对照组,其中男31例,女17例;年龄40~63岁,平均(53.5±6.6)岁。两组对象的性别、年龄构成上差异无统计学意义(P>0.05),具有可比性。纳入及排除标准:观察组均为术前未行化疗、放疗、肺部原发性病变,排除炎症、自身免疫性疾病、多器官、多系统衰竭患及合并严重内科疾病患者。本研究经医院伦理会批准通过,并经患者知情同意。
2 研究方法 受试者空腹8 h取静脉血3 mL置于真空促凝管,离心分离血清待检。采用酶联免疫吸附法(ELISA)检测HMGB 1、PD-L1。HMGB 1试剂使用日本SHINO-TEST公司产品,PD-L1试剂使用北京易科拜德科技有限公司产品,严格按试剂说明书操作,设立空白、阴阳性对照及质控,酶标仪型号北京普朗DNM-9602。比较两组研究对象血清中HMGB 1、PD-L1浓度差异,同时分析其与NSCLC病理类型、分级、分期及淋巴结转移的关系。
3 统计学处理 数据处理应用SPSS 24.0软件,两组数据行正态性检验,以 ±s表示组间均值,方差齐性比较采用t检验,方差不齐采用改良t检验(t'检验),多组间均值比较采用方差分析,组间两两比较采用SNK法,P<0.05表示差异有统计学意义。
结 果
1 两组血清HMGB 1和PD-L1水平比较 与对照组比较,观察组血清HMGB 1、PD-L1水平的差异有统计学意义(P<0.05),均明显升高,见表1。
2 不同类型NSCLC患者血清HMGB 1、PD-L1变化特点 不同病理类型和不同分化程度NSCLC患者血清HMGB 1、PD-L1比较,差异均无统计学意义(P>0.05),但不同分期NSCLC患者血清HMGB 1、PD-L1经比较,差异均存在统计学意义(P<0.05),且随着分期依次升高。NSCLC淋巴结转移患者血清HMGB 1、PD-L1高于未转移患者,差异有统计学意义(P<0.05)。见表2。
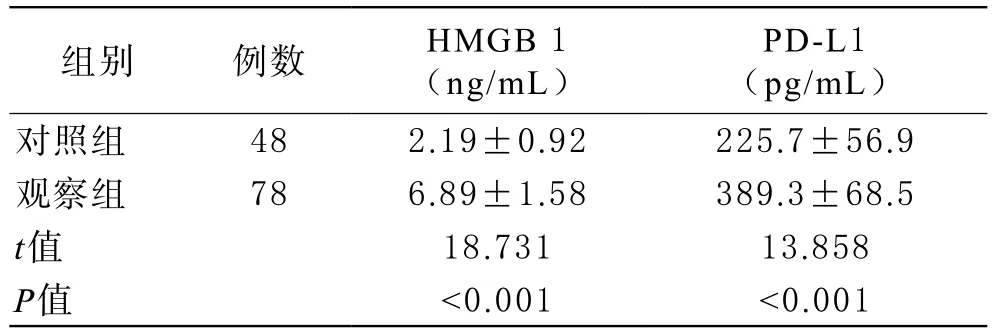
表1 NSCLC患者血清HMGB 1、PD-L1与对照组比较情况( ±s)

表2 不同类型NSCLC患者血清HMGB 1、PD-L1变化特点( ±s)
讨 论
肺癌为临床最常见的恶性肿瘤,据统计资料显示[5]:在我国,2015年肺癌的新增病例高达73.3万,死亡人数约为61万。在肺癌中83%病例属于非小细胞肺癌,鳞癌、腺癌为其主要病理组织类型。非小细胞肺癌恶性程度高,临床症状多样复杂,易发生漏诊,5年生存率仅为10%~15%[6]。肿瘤恶性程度在于肿瘤细胞的浸润及侵袭性。肺癌尤其NSCLC易发生脑、骨、肝脏、肾上腺等器官转移,大部分肺癌患者诊断时多已发生转移,错过了手术根治时机。HMGB1为真核细胞中非组蛋白染色体结合蛋白,为机体一种重要的炎症介质,与细胞分化、迁徙、增殖及凋亡相关。PD-L1为负性T细胞刺激因子配体,对CD4及CD8T细胞增殖、活化有抑制作用。近年在肿瘤的侵袭性研究中,两指标逐渐引起临床研究人员的关注。多研究显示[7-9]:HMGB1、PD-L1在多种人类肿瘤细胞中均呈现强表达,部分研究人员猜测其与肿瘤介导免疫逃逸及肿瘤细胞增殖、血管新生等生物行为密切相关。
HMGB1以其分子量小在聚丙烯酰胺凝胶高迁徙能力得名,在淋巴组织、肺、脑等组织细胞含量丰富,为细胞内DNA结合蛋白氨基酸序列呈现高度保守。最新研究显示[10]:HMGB1在多系统肿瘤细胞及癌旁组织均有表达,HMGB1通过主动分泌及被动分泌两种方式进入外周血,但目前对于外周血的研究临床仍较为少见。本研究数据显示HMGB1在NSCLC患者血清呈现高表达,腺癌、鳞癌及不同分化程度NSCLC患者血清HMGB1的差异无统计学意义,HMGB1与NSCLC病理类型、分化程度无关。HMGB1在高分期及淋巴结转移NSCLC患者中出现升高。临床分期及淋巴结转移均为影响肿瘤预后的重要因素。研究数据提示:HMGB1与NSCLC的侵袭性有关。Kristin[11]等认为HMGB1与多种肿瘤发病机制关系密切,在肿瘤浸润深度、淋巴结转移预后等方面均有重要的临床价值。肿瘤的侵袭包括粘附、降解及移动,其中细胞外基质的降解最为关键。有研究发现[12],HMGB1作为糖基化终末产物受体(RAGE)、Toll样受体可激活下游信号转导通路,促进细胞外基质降解酶类的分泌,从而促进肿瘤的浸润、转移。
PD-L1为近年肿瘤免疫治疗的热点[13],PD-L1表达于抗原提呈细胞、巨噬细胞、单核细胞及活化的T、B细胞,为PD-1配体。在我们的研究中NSCLC患者血清PD-L1出现升高,不同组织类型的NSCLC比较PD-L1与HMGB1表达呈现一致性,而在高分期及淋巴结转移NSCLC患者中PD-L1出现升高。有研究发现[14-16],PD-1/PD-L1信号通路的激活与机体肿瘤细胞的免疫逃逸密切相关。PD-1/PD-L1信号通路的激活可抑制T细胞转录因子的表达而降低T细胞免疫效应,对机体的抗肿瘤免疫应答有负性作用。另一方面,肿瘤细胞高表达PD-L1可促进抗原特异性T细胞的凋亡,并分泌抑制性细胞因子诸如IL-10、TGF-β抑制机体的抗肿瘤免疫应答。PD-L1可通过多信号通路负性调控细胞周期相关基因转录,阻碍细胞周期进展及T细胞增殖。动物实验显示[17]:特定的病理条件下PD-L1高表达可促进上皮细胞间质化,促进肿瘤细胞的浸润及转移。PD-L1与NSCLC患者免疫抑制性肿瘤微环境的免疫逃避形成及肿瘤的浸润性有关。
对于肿瘤HMGB1、PD-L1的研究,临床多见于肿瘤组织,相对于肿瘤组织,血清HMGB1、PD-L1较易获得,创伤性少,操作简便,方法学也相对更为灵敏。本研究的局限之处在于样本量尚需累积。综上所述,NSCLC患者外周血HMGB 1、PD-L1的检测对于肿瘤侵袭性及预后的预判均有重要的临床应用价值。
