找准计量关系,构建滴定计算解题思维模型
2020-03-02罗欢绵
罗欢绵
滴定法是化学中常用的定量分析方法,通过滴定可以测定某物质或某元素的含量,故该方法常被广泛应用于食品工业、医药制造、环境检测等行业中.通过分析近几年高考题可以发现,滴定计算是化学试题的常考考点之一.该类题目常以解决实际问题为背景,情境新、综合性强,既考查学生对化学基础知识的掌握情况,又考查学生的问题意识、计算能力以及证据推理、模型认知等核心素养,充分体现了以能力立意的命题思想.近3年高考全国卷化学试题关于滴定计算的题目统计如表1所示.

表1
为了提高学生对该类题目的分析能力,本文将结合典型例题进行解析,逐步引导学生找准滴定过程中重要物质之间的计量关系,从而构建出关于滴定计算的常见解题思维模型.
1 “单向一步滴定”思维模型的构建与应用
“单向一步滴定”是将已知准确浓度的标准液滴加到被测物中,直到标准液和被测物按照一定的化学计量关系定量反应为止,然后测出标准液消耗的体积,再根据标准液的消耗量便可按照一定的化学计量关系计算出待测物的含量.在该过程中,往往只需要单向一步滴定就可完成实验目的.具体思维模型如图1所示.

图1

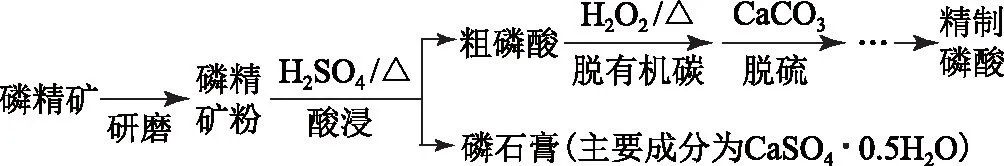
图2
取ag所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用bmol·L-1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液cmL.精制磷酸中H3PO4的质量分数是________.

n(NaOH)∶n(H3PO4)=2∶1.
接着,计算出NaOH的消耗量
n(NaOH)=c(NaOH)·V(NaOH)=
bmol·L-1×c×10-3L=bc×10-3mol.
然后,根据已推知的化学计量关系计算出H3PO4的物质的量
最后,按照题目要求计算出精制磷酸中H3PO4的质量分数
2 “单向多步滴定”思维模型的构建与应用
在该过程中,往往需要进行单向多步连续反应才能实现滴定目的.一般情况下,上一步反应的产物是下一步反应的反应物.解题时,首先根据题意分析各步反应中关键物质的化学计量关系;接着,将某中间产物作为中介物,确定被测物、中介物、已知物之间的化学计量关系;然后,将题目中已知用量代入,根据已推知的化学计量关系计算被测物的含量;最后,按题目要求进行相关物理量的转化计算.具体思维模型如图3所示.

图3


图4
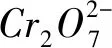

n(CuCl)∶n(FeCl2)∶n(K2Cr2O7)=6∶6∶1.
然后,将题目中已知用量
n(K2Cr2O7)=c(K2Cr2O7)·V(K2Cr2O7)=
amol·L-1×b×10-3L=ab×10-3mol
代入关系式,根据已推知的化学计量关系计算被测物CuCl的物质的量
n(CuCl)=6n(K2Cr2O7)=6ab×10-3mol.
最后,按题目要求可算出样品中CuCl的质量分数

Ⅰ. 取样、氧的固定.
用溶解氧瓶采集水样.记录大气压及水体温度.将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定.
Ⅱ. 酸化、滴定.

回答下列问题: 取100.00mL水样经固氧、酸化后,用amol·L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂,若消耗Na2S2O3溶液的体积为bmL,则水样中溶解氧的含量为________mg·L-1.

O2~2Mn(OH)2~2MnO(OH)2,
第2步反应“酸化”有关系式
MnO(OH)2~2I-~Mn2+~I2,
第3步反应“滴定”有关系式
接着,将中间产物MnO(OH)2和I2作为中介物,确定被测物O2、中介物MnO(OH)2和I2、已知物Na2S2O3之间的化学计量关系为
n(O2)∶n[MnO(OH)2]∶n(I2)∶n(Na2S2O3)=
1∶2∶2∶4.
然后,将题目中已知用量
n(Na2S2O3)=c(Na2S2O3)·V(Na2S2O3)=
amol·L-1×b×10-3L=ab×10-3mol
代入关系式,根据已推知的化学计量关系计算被测物O2的物质的量
最后,按题目要求进行相关物理量的转化计算,即可得100.00mL水样中溶解氧的质量
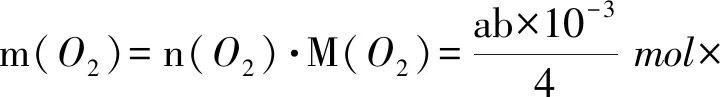
所以水样中溶解氧的含量为
3 “剩余量返滴定”思维模型的构建与应用
在该过程中,被测物会先和某一过量滴定剂进行反应,滴定剂的剩余量会通过后续加入的另一已知准确浓度的标准液进行返滴定.在解决该类题型时,首先根据题意分析各步反应中关键物质的化学计量关系;其次,找出被返滴定的过量滴定剂,由已知标准液的用量计算滴定剂的剩余量;接着,由滴定剂的总量减去剩余量,即可得出一开始与被测物反应的滴定剂消耗量;然后,根据已推知的化学计量关系计算被测物的含量;最后,按题目要求进行相关物理量的转化计算.具体思维模型如图5所示.

图5



n(Na2S2O3)=c(Na2S2O3)·V(Na2S2O3)=
0.100 0mol·L-1×V×10-3L=0.100 0 V×10-3mol,
可计算出,在第1步反应后I2的剩余量
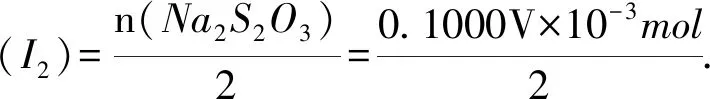
接着,由I2的总量减去剩余量,即可得出一开始与S2-反应的I2消耗量

然后,根据已推知的化学计量关系计算S2-的含量
最后,按题目要求可算出S2-的质量分数
关于滴定计算的题目常集真实性、综合性、新颖性为一体,对学生的能力提出了较高的要求.该类题目的解题关键在于要求学生能够快速、准确找出滴定过程中各种重要物质之间的计量关系,常可从以下几个方面作为分析的切入点:
1)依据物质性质及反应条件等题目信息判断出反应物和生成物;
2)依据原子守恒、电子得失守恒、电荷守恒找到反应物与生成物之间的转化关系;
3)依据物理量定义及计量关系进行相应计算.
在各种思维模型的构建与应用过程中,要抓重点,不断积累模型构建的经验,真正实现知识学习和能力培养的双重突破.
