胆总管结扎胆汁淤积性肝硬化动物模型的建立与评价
2020-03-02肖程康权罗庆
肖 程 康 权 罗 庆
胆汁淤积性肝病是人类死亡的重要原因之一,慢性胆石症、胆汁淤积性肝炎等均可发展为胆汁淤积性肝硬化。胆汁淤积性肝硬化是以胆管增生、肝细胞坏死、肝脏纤维化为特征的病理过程,目前其发生机制不完全清楚,且治疗方法有限[1,2]。胆总管结扎术因与人类发生胆汁淤积性肝硬化的机制具有一定的相似性,故可被认为是一种相对稳定、有效的构建动物模型的经典方法,在研究其病因、发病机制、治疗手段中发挥重要作用[3,4]。本文详述了balb/c小鼠经腹中线小切口行胆总管结扎手术诱导胆汁淤积性肝硬化的过程,并对该模型进行评价,发现该方法具有切口小、手术时间短、对胃肠道功能干扰小、存活率高、重复性强等诸多优点,是探索胆汁淤积性肝硬化病因、机制及治疗的理想模型。
材料与方法
一、主要材料
头戴式显微镜(德国Leica), 6-0可吸收缝线(上海金环),戊巴比妥钠(北京Notlas),山羊血清(武汉博士德),苏木素、伊红(北京索莱宝),Masson三色染色试剂盒(北京Leagene),a-SMA多克隆抗体(北京博奥森),ck-19单克隆抗体(美国Abcam),免疫组化检测试剂盒PV-9002、DAB 染液(北京中杉金桥)。
二、实验动物
周龄4~6周,体重18~23 g的健康雄性balb/c小鼠84只(购于重庆医科大学动物中心),随机分为7笼,每笼12只,标准条件下(温度18℃至22℃/湿度50%~60%)适应性喂养1周。本研究符合重庆医科大学医学研究委员会标准。
三、方法
(一)动物模型的建立
每笼balb/c小鼠随机分为实验组(胆总管结扎组)和对照组(假手术组),实验组8只,对照组4只。术前禁食8 h,手术时间定于上午9时至11时,在显微镜辅助下采用相对无菌操作。腹腔注射戊巴比妥钠(3 uL/10 g)麻醉后固定小鼠,腹部备皮、消毒、铺巾。手术切口为剑突至剑突下约1 cm腹正中线纵向切口(图1A),用眼科剪依次剪开皮肤、腹膜,暴露腹腔,选用弯头止血钳轻柔挑开肝脏,同时用生理盐水润湿的棉签将肠道组织压向小鼠尾侧以充分显露肝门,无须将肠道组织牵拉出腹腔,以免造成术后胃肠功能紊乱或肠道组织粘连,暴露过程需小心、轻柔,避免伤及肝脏组织或拉破肠系膜造成大出血。此时可见一细小、透明的胆总管位于门静脉前方,二者之间有疏松结缔组织相连。左手持眼科镊将胆总管下段提起,右手持另一把眼科镊,钝性分离结蹄组织,游离胆总管(图1B)。牵拉胆总管时轻柔,避免将其拉断或扯破门静脉。用6-0可吸收线于胆总管近心端结扎,不剪断胆总管(图1C),随后间断缝合腹膜,连续缝合皮肤。消毒手术切口,小纱布包扎,避免小鼠自行抓挠伤口。对照组不结扎胆总管,其余手术步骤均相同。术后小鼠保暖,密切观察,待完全苏醒,能自主活动后放回鼠笼。
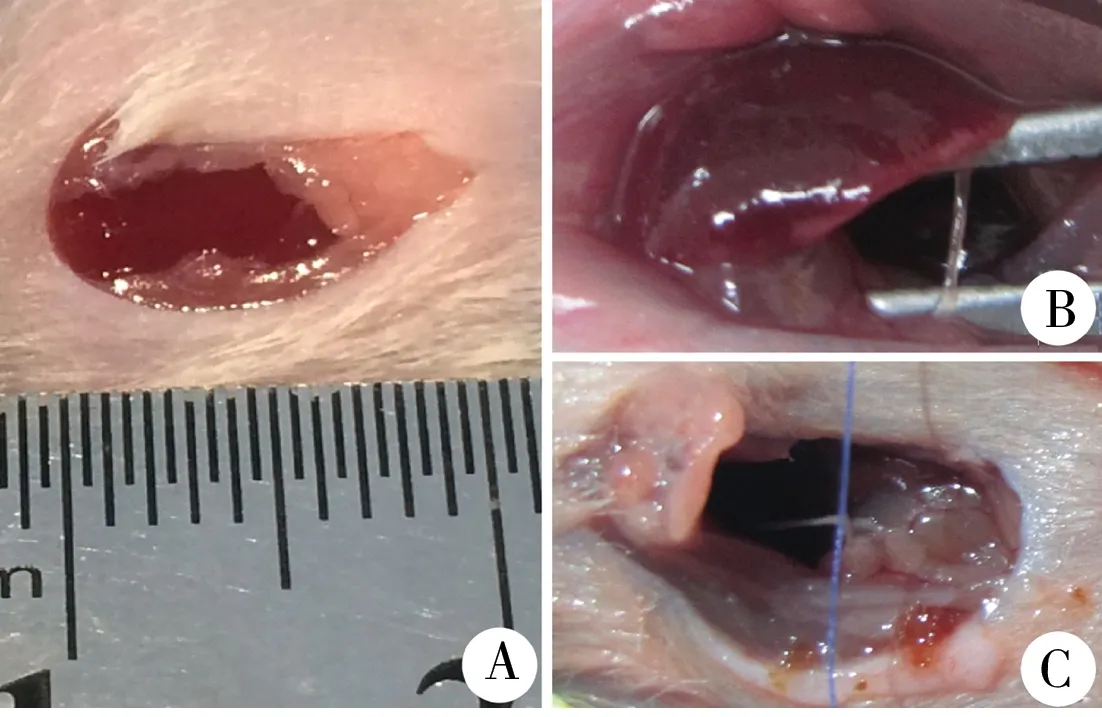
图1 balb/c小鼠胆总管结扎手术过程 A:手术切口; B:游离胆总管; C:结扎胆总管
Fig.1 Operative procedures of bile duct ligation in balb/c mice
(二)术后小鼠一般情况及肝胆大体结构观察
记录术后小鼠体重变化,观察皮毛色泽、活动情况、尿液颜色,分别于术后1 d、3 d、5 d、7 d、14 d、21 d、28 d处死实验组小鼠8只,对照组4只,取材,肉眼观察肝脏、胆囊、胆总管变化。实验过程中由逐渐增大的胆囊及血液检查结果判断,未发现小鼠胆总管再通情况。
(三)小鼠血清生化指标
术后1 d、3 d、5 d、7 d、14 d、21 d、28 d分别取实验组和对照组小鼠血液,离心机5 000 r/min,室温离心15 min,取上层血清按全自动生化分析仪标准程序检测总胆红素(total bilirubin,TBIL)、直接胆红素(direct bilirubin,DBIL)、谷氨酸转氨酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶( aspartate aminotransferase,AST)。
(四)肝脏组织苏木素-伊红(HE)染色
分别取实验组与对照组术后1 d、3 d、5 d、7 d、14 d、21 d、28 d小鼠肝脏组织(约1 cm3大小),常规脱水、包埋、切片后行HE染色,光学显微镜下观察。
(五)肝脏组织masson染色
取实验组和对照组小鼠术后28 d肝脏组织切片,按masson三色染色试剂盒标准步骤染色,观察结果。
(六)肝脏组织免疫组织化学染色
取实验组和对照组小鼠术后28 d肝脏组织,常规石蜡切片,免疫组织化学染色,检测a-SMA(a-平滑肌肌动蛋白)、CK-19(细胞角蛋白-19)表达情况。小鼠肝脏组织用10%福尔马林固定,石蜡包埋,4 um连续切片,60℃烤片过夜。一抗选择1∶300兔抗小鼠a-SMA多克隆抗体、1∶600兔抗小鼠ck-19单克隆抗体,二抗为免疫组化检测试剂盒。具体步骤:切片脱蜡、水化,微波修复15 min,3%H2O2室温孵育20 min,PBS洗净,山羊血清封闭45 min,孵育一抗,避光、4℃过夜,试剂1(聚合物辅助剂)室温20 min,试剂2(PV-9001 辣根酶标记抗兔IgG聚合物)20 min,DAB染色,苏木素复染,梯度酒精脱水,封片,显微镜下观察。
四、统计学分析
结 果
一、术后小鼠一般情况及肝胆大体结构观察
术后两组小鼠活动量均有所减少,术后第3天对照组小鼠活动量基本恢复至术前水平,其余无明显变化,而实验组小鼠活动量基本未恢复,皮毛粗糙、无光泽,耳朵、四肢、尾巴部位出现明显黄疸,尿液颜色加深至深黄色。两组小鼠体重在术后1 d均有所下降,随后对照组小鼠体重逐渐增加,而实验组小鼠体重呈下降趋势(表1)。通过取材可见,随胆总管结扎时间的延长,实验组小鼠出现腹膜黄染,胆囊和胆总管因胆汁淤积逐渐增大,肝脏质地变硬,表面出现颗粒状结节(图2)。
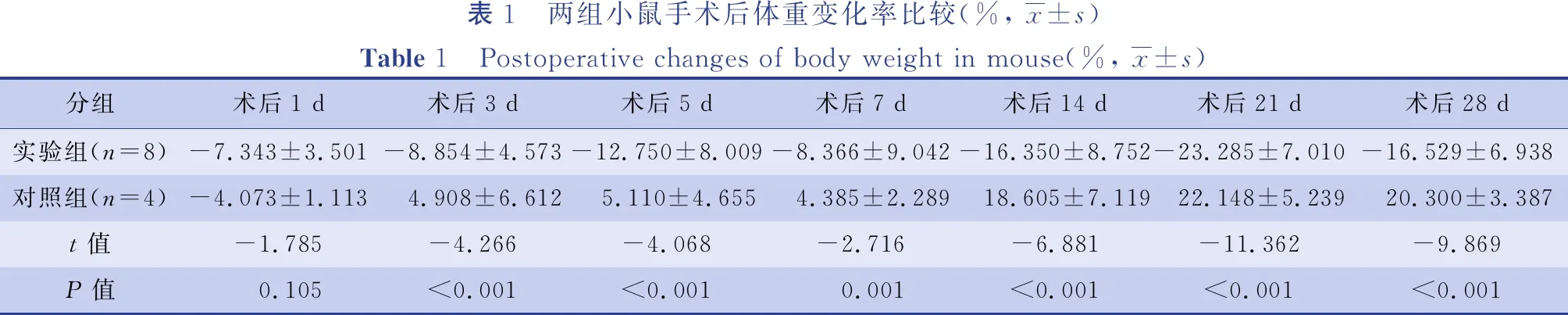
表1 两组小鼠手术后体重变化率比较(%, x±s)Table 1 Postoperative changes of body weight in mouse(%, x±s)分组术后1 d术后3 d术后5 d术后7 d术后14 d术后21 d术后28 d实验组(n=8)-7.343±3.501-8.854±4.573-12.750±8.009-8.366±9.042-16.350±8.752-23.285±7.010-16.529±6.938对照组(n=4)-4.073±1.113 4.908±6.612 5.110±4.655 4.385±2.289 18.605±7.119 22.148±5.239 20.300±3.387t值-1.785-4.266-4.068-2.716-6.881-11.362-9.869P值 0.105<0.001<0.001 0.001<0.001<0.001<0.001

图2 两组小鼠手术后不同时间点肝脏组织大体结构图 A:术后1 d; B:术后3 d; C:术后5 d; D:术后7 d; E:术后14 d; F:术后21 d; G:术后28 d ;实验组(左)与对照组(右)
Fig.2 Gross structures of murine liver tissue at different postoperative timepoints
二、小鼠生化检测结果
实验组小鼠随结扎时间延长,血清TBIL、DBIL逐渐升高,术后14 d达峰值,随后下降直至总体趋于平稳;ALT、AST于术后第1天达到高峰,随后稍有下降,第3天至第7天再次缓慢升高,随后逐步下降并趋于平稳。而对照组小鼠不同时间点血清TBIL、DBIL、ALT、AST值均无明显变化(表2、图3)。

表2 两组小鼠手术后不同时间点生化检测结果比较(x±s)Table 2 Serum biochemical profiles of mouse at different postoperative timepoints(x±s)组别时间TBIL(umol/L)DBIL(umol/L)ALT(u/L)AST(u/L)实验组对照组t值P值术后1 d 98.067±29.967 84.267±24.229 1441.983±485.0053415.383±1822.435 0.350±0.2651.200±0.23151.250±4.197 130.825±32.478 7.9878.3977.0234.414<0.001<0.001<0.001<0.001实验组对照组t值P值术后3 d 145.712±73.304126.867±46.8161137.333±478.1001317.950±710.8010.275±0.2361.200±0.29445.650±10.895145.050±45.6835.6116.5755.5914.029<0.001<0.001<0.001<0.001实验组对照组t值P值术后5 d 168.817±45.011138.283±32.8361270.983±404.3971754.067±370.6800.375±0.1501.225±0.15041.200±4.229159.850±13.4529.16610.2247.44810.524<0.001<0.001<0.001<0.001 实验组对照组t值P值术后7 d 286.900±26.605201.017±30.6351453.967±377.5761780.500±1015.9800.367±0.1531.350±0.26546.450±4.276197.950±40.54326.38015.9649.1303.811<0.001<0.001<0.001<0.001 实验组对照组t值P值术后14 d 377.260±126.88240.283±67.628633.683±133.679644.417±125.2840.400±0.1831.150±0.20852.325±8.739174.525±15.0456.6428.66110.6199.089<0.001<0.001<0.001<0.001实验组对照组t值P值术后21 d 255.100±50.560223.883±39.363409.283±114.169436.850±118.6170.3250±0.12581.100±0.182647.250±4.5332171.050±19.391212.34313.8637.7565.382<0.001<0.001<0.001<0.001 实验组对照组t值P值术后28 d 204.100±57.9378181.217±59.8222482.333±118.4465445.017±113.64470.3250±0.09571.175±0.298649.500±8.4526173.200±16.21588.6157.3728.9175.771<0.001<0.001<0.001<0.001
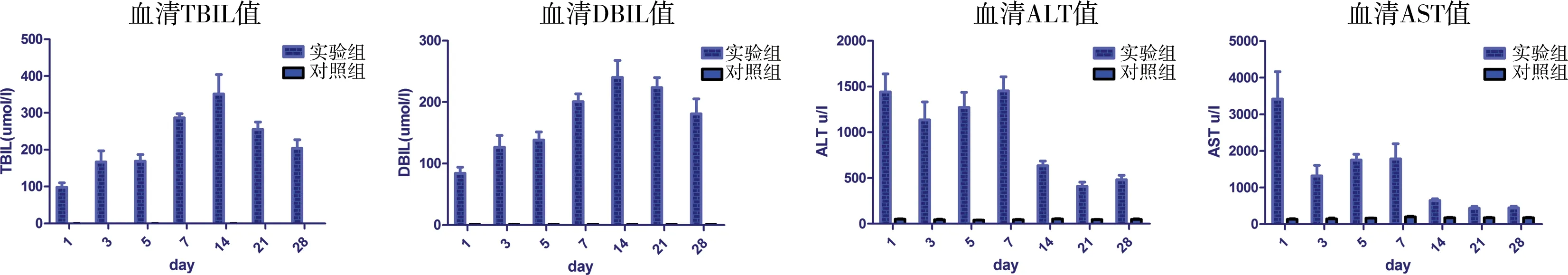
图3 两组小鼠手术后不同时间点血清生化检测结果图
Fig.3 Serum biochemical profiles of mice at different postoperative timepoints
三、 肝脏组织HE染色结果
分别取两组小鼠术后1 d、3 d、5 d、7 d、14 d、21 d、28 d肝脏组织行HE染色,实验组小鼠术后第3天标本中可见较多炎性细胞,汇管区出现胆管上皮样细胞增生、胆管扩张以及胆管周围纤维组织增生。术后28 d,实验组小鼠肝脏组织可见少量坏死肝细胞,大量增生的胆管上皮样细胞,增生胆小管周围大量胶原纤维,肝小叶结构紊乱,岛屿状假小叶结构形成。对照组小鼠肝脏组织未见炎症和坏死细胞,肝板排列整齐,肝小叶结构正常完整(图4)。
四、肝脏组织 Masson染色结果
选取两组小鼠手术后28 d肝脏组织行Masson染色,可见实验组肝脏组织结构紊乱,胶原纤维增生(病理切片图中蓝色部分);对照组小鼠肝脏组织结构正常,无胶原纤维形成(图5)。
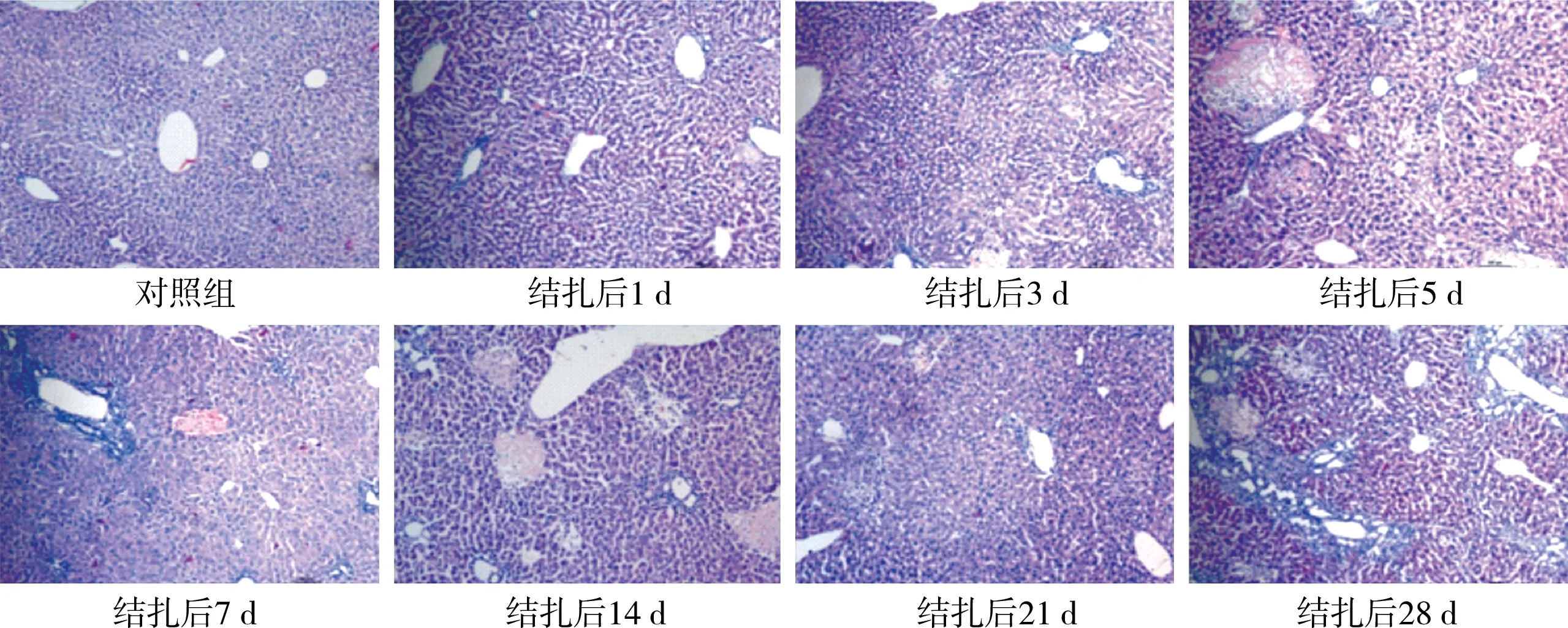
图4 两组小鼠手术后不同时间点肝脏组织形态图(HE染色,×100)

图5 两组小鼠手术后28 d肝脏纤维组织形成情况(Masson染色,×100)
Fig.5 The formation of collagen fiber in liver at 28d post-operation(Masson stain,×100)
(六)肝脏组织免疫组织化学染色
选取两组小鼠术后28 d肝脏组织行免疫组织化学染色,实验组可见a-SMA大量表达,提示肌成纤维细胞大量增生,而对照组无表达;CK-19为胆管上皮细胞标志物,与对照组相比,实验组阳性细胞(病理切片图中标棕色部分)数量明显增高,呈花环状排列(t=6.150,P<0.001),见图6。
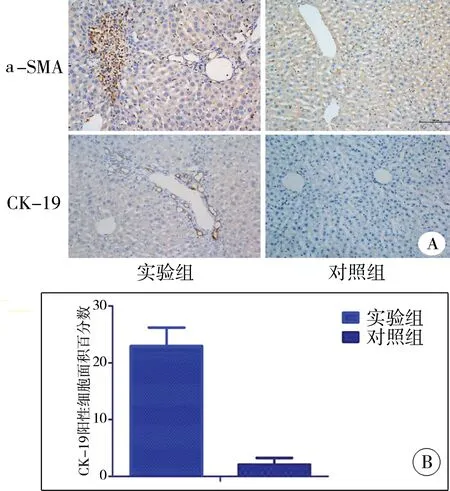
图6 两组小鼠手术后28 d肝脏组织a-SMA,CK-19表达情况(×200) A:免疫组织化学结果; B:CK-19阳性细胞面积百分比半定量分析结果
Fig.6 The expression patterns of a-SMA and CK-19 in liver at 28d post-operation(×200)
讨 论
由于胆汁淤积及胆汁酸的毒性作用,肝细胞可出现进行性损伤,最终可发展为肝硬化甚至肝衰竭。因而,胆汁淤积性损伤是肝纤维化、肝硬化的重要危险因素[5,6]。
胆总管手术动物模型自1872年首次应用以来,一直被推举为研究进行性肝损伤的经典模型。凭借简单、快速、有效等优点,广泛用于进行性肝病的多方面研究:如动态评估肝硬化形态学与生化指标,探索促纤维化信号通路,剖析不同细胞亚群、基因在肝纤维化进程中的作用,测试抗纤维化相关药物[7,8]。近年来,国内外在构建该动物模型时多采用胆总管双重结扎以避免其发生再通;如需研究较少纤维化形成和进行性肝细胞增殖的关系时,可选择结扎部分胆总管,或部分胆总管结扎联合胆囊切除术,以此来预防胆汁淤积引起的急性胆囊炎[9];更有学者熟练掌握了建立胆道吻合动物模型的先进显微技术[10]。
本研究团队通过前期不断总结,选择balb/c小鼠行经腹中线小切口胆总管结扎术,致肝外胆管阻塞,成功构建了胆汁淤积性肝硬化动物模型。当然,也有部分研究者选择胆总管较粗的大鼠作为动物模型,便于寻找及结扎胆总管;同时大鼠术后耐受能力较好,存活率高。但大鼠无胆囊结构,可能干扰到肝硬化形成时间与动态改变。肖颜玉、罗丹[11,12]的研究中早期将小鼠胆总管结扎至术后14 d,有文献指出,小鼠胆总管结扎术后14 d处于早期纤维化水平,28 d达中晚期肝硬化水平[13]。因此,本研究将造模最长时间定为术后4周,以便研究小鼠中晚期胆汁淤积性肝硬化的病理改变,其中小鼠术后21 d平均存活率91.67%,术后28 d平均存活率为75%。小鼠胆总管位于腹中线稍右方,由左右肝管汇合而成,采用腹中线竖切口,可减少损伤腹壁血管引起的出血,也便于找寻胆总管[14]。长度1 cm的小切口可充分减轻手术损伤,同时暴露胆总管时无需翻动胃肠道,减少了肠系膜血管破裂、出血的风险,也降低术后发生腹腔粘连的可能性;显微镜的使用可进一步减轻门静脉损伤。为保证模型的重现性,所有小鼠结扎点均选在左右肝管汇合处稍下方。
胆总管结扎术后,随时间延长,实验组小鼠逐渐出现一系列与胆汁淤积性肝硬化患者相似的症状、体征。取材可见小鼠腹膜呈黄色,胆汁淤积至胆囊肿大、胆总管扩张,肝脏质地变硬;术后21 d肝脏表面可见颗粒状结节,以上为胆总管结扎手术成功的直接证据。TBIL、DBIL为胆汁淤积的血清生化指标,与对照组相比,实验组小鼠TBIL、DBIL在术后14 d达到高峰,随后逐渐降低,直至28 d总体趋于平稳,证实胆总管结扎引起了进行性的肝脏损害[7,15]。ALT、AST是评估肝脏损伤的常用临床指标,术后1 d,二者在实验组小鼠中均达高峰,分析原因可能是手术的急性损伤导致肝细胞应激;随后稍有下降,术后7 d再次升高,14 d至28 d逐渐下降进入相对平稳状态,其原因可能是肝细胞经过自我调节和修复后仍不能代偿至正常水平。有学者对SD大鼠行胆总管结扎术,发现ALT、AST水平在术后第3天达高峰,其结果与本实验稍有差别,可能上述指标的定量结果受不同胆总管结扎部位影响,或大小鼠对手术的应激反应和耐受程度不同。术后不同时间点HE染色结果直接显示了小鼠肝脏组织结构的动态改变[6],实验组小鼠可见肝细胞坏死、胆管样结构增生、假小叶形成,符合胆汁淤积性肝硬化患者肝脏组织HE染色结果;而对照组小鼠肝小叶结构完整,肝细胞由中央静脉向外周呈辐射状排列,由此也为该动物模型的成功构建提供了有力证据。本组前期实验发现,将患有胆汁淤积性肝硬化的患者肝脏组织切片进行HE染色,胆小管结构内可见黄棕色胆汁,而小鼠结扎胆总管模型中,术后28 d小鼠肝脏组织仍没有在增生的胆总管中发现胆汁,其原因可能是人和小鼠存在物种差异,或构建模型时间尚未达到形成胆汁所需的时间,具体原因有待进一步探索。Masson染色中,实验组小鼠术后28 d肝脏组织可见正常结构遭到破坏,胶原纤维增生明显,纤维化逐步形成。同时通过免疫组织化学染色检测了术后28 d 两组小鼠肝脏组织中a-SMA和CK-19的表达情况,a-SMA为肌成纤维细胞特异性标志物,其在肝脏组织中表达量增加提示存在肝星状细胞活化[6,7,16-18]。活化的肝星状细胞可导致细胞因子增多,细胞外基质合成增加,逐渐发展为肝硬化。本研究实验组可见a-SMA表达量明显增加,且主要集中于汇管区,说明汇管区可能是肝硬化形成的起始部位。CK-19为胆管上皮细胞特异性标志物[7,19],可形成胆管结构,选用表皮生成素可选择性诱导CK-19表达上调[20]。与对照组相比,实验组汇管区CK-19表达量明显增多且具有统计学意义,证明经胆总管结扎术的小鼠肝脏组织有明显的胆管上皮细胞增生,胆小管形成,符合胆汁淤积性肝硬化患者肝脏组织结构。通过对比实验组和对照组小鼠的一般情况、血清学变化、组织学改变,证实了腹中线小切口胆总管结扎术是一种简单、重复性强的胆汁淤积性肝硬化动物模型。
虽然本研究基本达到了预期的研究目的,但我们的实验仍存在一些不足,如暂未检测到术后小鼠血清GGT的改变;小鼠胆总管结扎后更长时间引起的肝脏病理改变也有待于进一步研究。当然,在所有肝病研究中,采用胆总管结扎的方式进行建模仍然存在一定局限性,虽然其可模拟肝外胆道梗阻引起的胆汁淤积性肝硬化,但不能模拟胆道感染或自身免疫性肝炎等导致的肝内外胆道病变。
