甘西鼠尾草总酚酸提取物对辐射损伤大鼠的保护作用
2020-02-27骆晓梅王路路周忠海
杨 阳,骆晓梅,王 冬,王路路,周忠海,朱 斌
二十一世纪核科学与核技术迅猛发展并持续进步,在工农业生产与国防建设、生命科学与医学生物学等诸多领域发挥着不可替代的重要作用。一方面,日常工作生活中,人们与放射线接触的概率逐渐增多,遭受辐射损伤的概率也随之增多。另一方面,当前国内恶性肿瘤发病率居高不下,放射治疗技术已成为恶性肿瘤常规疗法之一;但放疗缺乏特异性,既能杀死肿瘤细胞,也可损伤正常细胞。因此,亟待科研工作者寻找开发高效低毒、使用方便的抗辐射药物。当前研发的抗辐射药物普遍存在治疗窗窄、不良反应多、选择性不高等安全性问题[1]。例如,氨磷汀具有良好的辐射防护作用,但不良反应较大[2];洛伐他汀低剂量时为细胞辐射保护剂,但高剂量时可能成为辐射增敏剂,使用剂量难以控制[3];富勒烯及其衍生物具有很强的自由基清除能力,但水溶性极低,生物毒性较大,严重限制了其在生物领域的应用[4];碘化钾能保护受到辐射损害的甲状腺组织,但起效时间要求高,须在6 h内使用[5]。天然药物及民族药物具有疗效确切、不良反应小、资源丰富等优点[6],在抗辐射方面因其独特的治疗效果与作用机制受到科研人员的广泛关注,目前已成为国内辐射防治药物研究的主要方向。
甘西鼠尾草为唇形科鼠尾草属植物甘西鼠尾草的干燥根和根茎,为区域性药材,具有调经、活血、散瘀、镇静止痛的功效[7-8]。甘西鼠尾草与其同属植物丹参具有相似的丹参酮类、酚酸类化学成分,因而药理作用相似,常常被作为丹参的替代品[9-10]。现代医药学研究表明,甘西鼠尾草主要含有挥发油、脂溶性二萜醌类和水溶性酚酸类等化学成分[11-12],主要活性成分丹参酮ⅡA、迷迭香酸的含量均高于丹参[13-14];具有保护缺氧/复氧损伤心肌细胞、醛糖还原酶抑制活性、抗氧化、抗菌等多种药理作用[15-18]。本课题组长期致力于甘西鼠尾草研究,采用大孔吸附树脂柱色谱的固定工艺技术,制备了质量可控的甘西鼠尾草总酚酸提取物(Salviaprzewalskiitotal phenolic acid extract, SPE)[19],主要含有迷迭香酸和丹酚酸B等水溶性酚酸类成分[14,20]。本研究通过低剂量辐射动物模型实验,证实了SPE对大鼠辐射损伤具有保护作用。现报告如下。
1 材料与方法
1.1仪器与试剂 Quintix 224-1CN型电子分析天平(最大载荷220 g,分度值0.1 mg),德国Sartorius公司产品。UTP-313型电子天平(最大载荷2000 g,分度值0.01 g),上海花潮电器公司产品。Minispin 5452型高速离心机,德国Eppendorf公司产品。BC-5390CRP型全自动细胞计数仪,迈瑞医疗国际公司产品。2300C/D SN416型直线加速器治疗机(精度99.8%),美国Varian公司产品,陆军第七十一集团军医院放疗科装机使用。羧甲基纤维素钠(安徽山河药用辅料公司生产,批号:130906)。肝素钠注射液(江苏万邦生化医药集团生产,批号:20120913)。生理盐水(安徽省五环药业公司生产,批号:130617701)。水为双蒸水,乙醇为医用级(提取用),其他试剂为分析纯。
1.2实验药物 SPE本课题组自制(1 g SPE相当于原药材55.6 g),批号:200909-b15,经高效液相法含量测定(校正曲线法),迷迭香酸的含量为31.58%、丹酚酸B的含量为5.52%[14]。使用前将SPE与1% 羟甲基纤维素钠(CMC-Na)水溶液混悬均匀,配制成浓度为5、10、20 mg/ml的溶液,现配现用。空白对照溶液为1% CMC-Na水溶液。
1.3实验动物 雄性SD大鼠,2~3周龄,体质量190~220 g,40只,清洁级,徐州医科大学实验动物中心提供,实验动物生产许可证号:SCXK(苏)2015-0009、SYXK(苏)2015-0030。饲养于陆军第七十一集团军医院实验中心动物房,饲养温度24~28℃,相对湿度60%~80%,通风良好。
1.4分组及辐射实验 取SD大鼠40只,自由进食饮水,适应性饲养,2/d。随机分为正常对照组(N组),辐射模型组(M组)和SPE低剂量组(SPE1组)、SPE中剂量组(SPE2组)、SPE高剂量组(SPE3组),每组8只。除N组不予辐射外,其余各组大鼠均接受直线加速器X射线源6 MV一次全身均匀辐射,源皮距100 cm,辐射面积30 cm×30 cm,辐射剂量率为300 cGy/min。辐射剂量根据参考文献确定为6 Gy[21]。辐射时,使用本课题组研制的实验鼠批量均匀辐射的固定装置;该固定装置能一次性对多只大鼠进行均匀辐射,可保证辐射剂量一致并提高了辐射效率[22]。辐射后,按照10 ml/kg的给药体积,SPE1组、SPE2组、SPE3组大鼠分别灌胃给予SPE溶液5、10、20 mg/ml,N组和M组大鼠分别灌胃给予空白对照溶液,1/d,连续给药34 d。
1.5观察指标及测定方法
1.5.1大鼠体征及体质量测定:于辐射前1 d及辐射后1、4、7、14、21、28、35 d给药前观察各组大鼠体征变化,并使用电子天平称定大鼠体质量。
1.5.2外周血常规测定:于辐射前1 d及辐射后1、4、7、14、21、28、35 d给药前取各组大鼠眼内眦静脉血20 μl,肝素抗凝,使用全自动细胞计数仪测定其红细胞、血红蛋白、白细胞、血小板等指标。采血时注意消毒,防止感染。
1.5.3脏器系数测定:辐射后35 d给药前采血完毕后,颈椎脱臼处死大鼠,立即解剖,分离心脏、肺脏、肾脏、肝脏、脾脏、胸腺、睾丸,使用电子分析天平分别精密称定各组大鼠以上脏器质量,计算各组大鼠的各脏器系数。脏器系数计算方法为:脏器系数=大鼠脏器质量/大鼠体质量。

2 结果
2.1大鼠体征变化情况 辐射后1、4、7、14、21、28、35 d,N组大鼠活动活跃,毛色显光泽、无黏滞,食欲无明显下降,无松毛、脱毛。M组大鼠辐射后1、4、7 d 及SPE各组大鼠辐射后1、4 d 活动迟缓,毛色无光泽、显黏滞,食欲不振,松毛脱毛,便稀。辐射后7 d,SPE各组大鼠体征略有恢复。辐射后14 d,M组略有恢复,SPE各组大鼠持续好转。辐射21 d后,M组、SPE各组大鼠均持续好转,以SPE各组大鼠好转更为明显。
2.2大鼠体质量比较 辐射前1 d、辐射后1 d各组大鼠体质量比较差异均无统计学意义(P>0.05)。辐射后4 、7、14、21、28、35 d,N组大鼠体质量不同程度升高,且高于其他各组(P<0.05,P<0.01)。辐射后4 d,M组和SPE各组大鼠体质量均不同程度下降;辐射后7 d,M组大鼠体质量继续下降,SPE各组大鼠体质量不同程度恢复,SPE1组、SPE2组、SPE3组大鼠体质量高于M组(P<0.05),且SPE3组与M组具有极显著差异性(P<0.01)。表明:辐射后4 d起严重影响大鼠体质量,体质量持续下降且以7 d为最低;口服1周的SPE能够抑制辐射大鼠体质量下降,仅高剂量SPE作用明显。
辐射后14、21、35 d,M组和SPE各组大鼠体质量不同程度恢复。辐射后21、28、35 d,SPE2组、SPE3组大鼠体质量显著高于M组(P<0.05),且SPE3组与M组具有极显著性差异(P<0.01)。表明:口服SPE 2周以上,可明显促进辐射大鼠体质量恢复,并呈现出量效正相关性;口服5周的SPE能使辐射大鼠体质量恢复至正常水平,且高剂量SPE作用更显著。以上结果见图1。
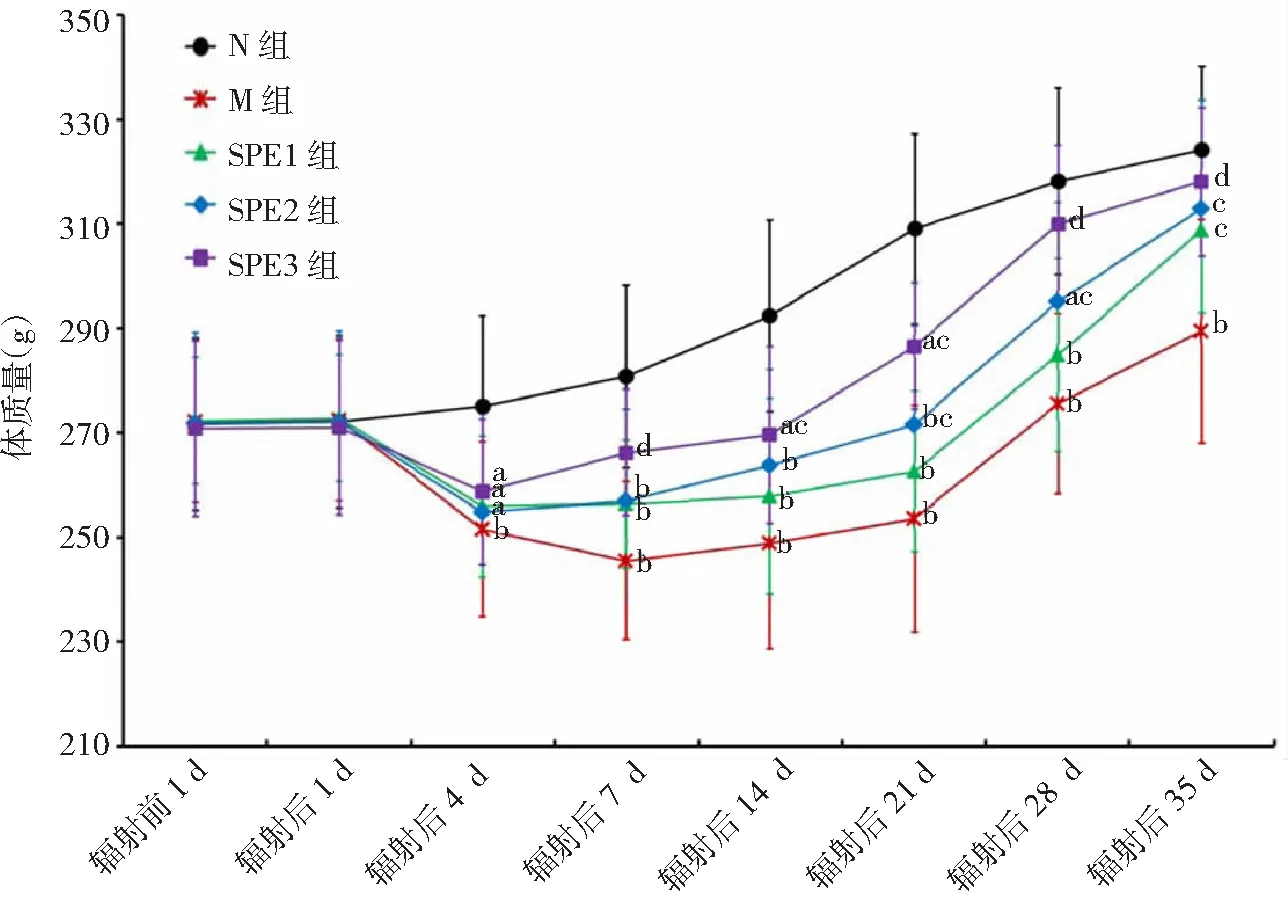
图1 5组大鼠辐射前后体质量比较
N组为正常对照,M组为辐射模型,SPE1组为甘西鼠尾草总酚酸提取物(SPE)50 mg/kg,SPE2组为SPE 100 mg/kg,SPE3组为SPE 200 mg/kg;与N组比较,aP<0.05,bP<0.01;与M组比较,cP<0.05,dP<0.01
2.3大鼠外周血常规指标比较
2.3.1红细胞计数比较:辐射前1 d、辐射后1、4 d,各组大鼠红细胞计数比较差异均无统计学意义(P>0.05)。辐射后1、4 、7、14 d,N组大鼠红细胞有所增多,其余各组大鼠红细胞均不同程度减少。辐射后7、14 d,N组大鼠红细胞显著高于M组、SPE各剂量组(P<0.05,P<0.01)。表明:辐射后4 d内大鼠红细胞无明显影响;辐射后1周起大鼠红细胞损伤严重,红细胞持续减少且以14 d为最低。
辐射后21~28 d,N组大鼠红细胞持续增多,其余各组大鼠红细胞略有恢复。N组大鼠红细胞显著高于M组、SPE各剂量组(P<0.01,P<0.05),SPE2组、SPE3组大鼠红细胞高于M组(P<0.05)。辐射后35 d,N组大鼠红细胞高于M组(P<0.01),但与SPE各剂量组比较差异无统计学意义(P>0.05);SPE各剂量组大鼠红细胞高于M组(P<0.05)。表明:口服3周以上的SPE对辐射大鼠红细胞损伤具有明显保护作用;口服5周的SPE能够使辐射大鼠红细胞损伤恢复至正常水平。以上结果见表1。
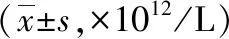
表1 5组大鼠外周血红细胞比较
注:N组为正常对照,M组为辐射模型,SPE1组为甘西鼠尾草总酚酸提取物(SPE)50 mg/kg,SPE2组为SPE 100 mg/kg,SPE3组为SPE 200 mg/kg;与N组比较,aP<0.05,bP<0.01;与M组比较,cP<0.05
2.3.2血红蛋白比较: 辐射前1 d、辐射后1 d,各组大鼠血红蛋白之间的差异均无统计学意义(P>0.05)。辐射后4 ~14 d,N组大鼠血红蛋白持续略有升高,M组和SPE各剂量组血红蛋白均呈不同程度下降。辐射后4 d,N组大鼠血红蛋白显著高于M组(P<0.01)。辐射后7、14 d,N组大鼠血红蛋白显著高于M组、SPE各剂量组(P<0.01)。表明:辐射后4 d起严重影响大鼠血红蛋白,血红蛋白持续下降且以14 d为最低。
辐射后21~35 d,N组大鼠血红蛋白持续升高,其余各组血红蛋白均呈不同程度恢复。辐射后21、28 d,N组大鼠血红蛋白显著高于M组、SPE各剂量组(P<0.01);而辐射后35 d,N组大鼠血红蛋白仅高于M组、SPE1组(P<0.01)。辐射后21~35 d,SPE2组、SPE3组大鼠血红蛋白显著高于M组(P<0.01)。表明:口服3周以上的SPE对辐射大鼠血红蛋白损伤具有明显保护作用,并呈现出量效正相关性;口服5周的中高剂量SPE能够使辐射大鼠血红蛋白损伤恢复至正常水平。以上结果见表2。
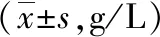
表2 5组大鼠外周血血红蛋白比较
注:N组为正常对照,M组为辐射模型,SPE1组为甘西鼠尾草总酚酸提取物(SPE)50 mg/kg,SPE2组为SPE 100 mg/kg,SPE3组为SPE 200 mg/kg;与N组比较,bP<0.01;与M组比较,dP<0.01,cP<0.05
2.3.3白细胞比较:辐射前1 d,各组大鼠白细胞比较差异均无统计学意义(P>0.05)。辐射后1、4 d,N组大鼠白细胞增多,其余各组大鼠白细胞均呈不同程度减少。辐射后1、4 d,N组大鼠白细胞显著高于M组、SPE各剂量组(P<0.01)。表明:大鼠白细胞对辐射损伤较为敏感,辐射后1 d即发生大鼠白细胞严重损伤,白细胞持续减少且以4 d为最低。
辐射后7~35 d,N组大鼠白细胞继续增多,其余各组白细胞略有恢复。N组大鼠白细胞仍显著高于M组、SPE各剂量组(P<0.01)。表明:口服5周的SPE对辐射大鼠白细胞损伤无保护作用。以上结果见表3。
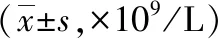
表3 5组大鼠外周血白细胞比较
注:N组为正常对照,M组为辐射模型,SPE1组为甘西鼠尾草总酚酸提取物(SPE)50 mg/kg,SPE2组为SPE 100 mg/kg,SPE3组为SPE 200 mg/kg;与N组比较,bP<0.01
2.3.4血小板比较 :辐射前1 d各组大鼠血小板比较差异均无统计学意义(P>0.05)。辐射后1~7 d,N组大鼠血小板无明显变化,其余各组大鼠血小板均不同程度减少。辐射后4、7 d,N组大鼠血小板显著高于M组、SPE各剂量组(P<0.01)。表明:辐射后4 d起发生大鼠血小板严重损伤,血小板持续减少且以7 d为最低。
辐射后14~35 d,N组大鼠血小板无明显变化,其余各组大鼠血小板均不同程度恢复。辐射后14 d,N组大鼠血小板显著高于M组、SPE各剂量组(P<0.01)。辐射后21~35 d,N组大鼠血小板仍显著高于M组(P<0.01),但N组大鼠与SPE各剂量组之间的差异无统计学意义(P>0.05)。辐射后21 d,SPE各剂量组大鼠血小板显著高于M组(P<0.05)。表明:口服3周SPE对辐射大鼠血小板损伤具有明显保护作用,并呈现出量效正相关性;口服3周以上SPE能使辐射大鼠血小板损伤恢复正常水平。以上结果见表4。
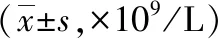
表4 5组大鼠外周血血小板数值比较
注:N组为正常对照,M组为辐射模型,SPE1组为甘西鼠尾草总酚酸提取物(SPE)50 mg/kg,SPE2组为SPE 100 mg/kg,SPE3组为SPE 200 mg/kg;与N组比较,bP<0.01;与M组比较,cP<0.05
2.4脏器系数比较 辐射后35 d,各组大鼠心脏系数、肺脏系数、肾脏系数、胸腺系数之间的差异均无统计学意义(P>0.05)。N组大鼠睾丸系数显著高于M组、SPE各剂量组(P<0.01);SPE各组大鼠睾丸系数与M组比较差异无统计学意义(P>0.05)。表明:辐射对大鼠心脏、肺脏、肾脏、胸腺无明显损伤;辐射对大鼠睾丸的损伤影响较为严重,口服5周的SPE对辐射大鼠睾丸损伤无保护作用。
辐射后35 d,M组大鼠肝脏系数、脾脏系数均显著低于N组(P<0.01);SPE2组、SPE3组大鼠脾脏系数与N组比较差异无统计学意义(P>0.05),SPE3组大鼠肝脏系数显著高于M组(P<0.05);SPE2组、SPE3组大鼠脾脏系数显著高于M组(P<0.05)。表明:辐射对大鼠肝脏、脾脏损伤较为严重;口服5周的中高剂量SPE对辐射大鼠肝、脾损伤具有明显保护作用,能够使其恢复至正常水平。以上结果见图2。
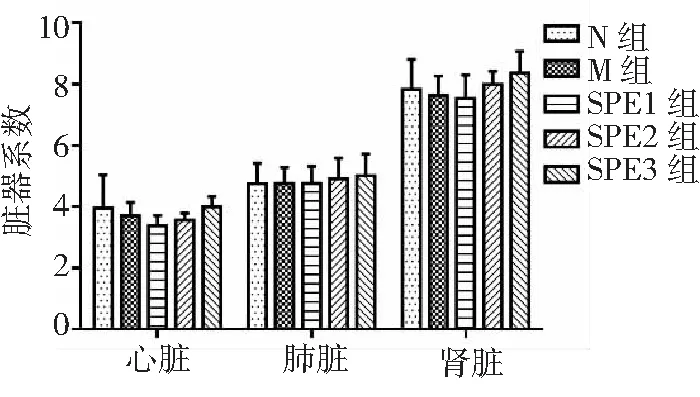
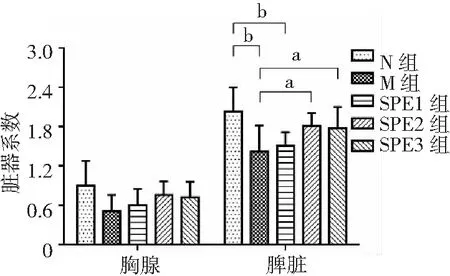
图2 5组大鼠脏器系数比较
N组为正常对照,M组为辐射模型,SPE1组为甘西鼠尾草总酚酸提取物(SPE)50 mg/kg,SPE2组为SPE 100 mg/kg,SPE3组为SPE 200 mg/kg;与N组比较,bP<0.01;与M组比较,aP<0.05
3 讨论
文献报道,大剂量单次电离辐射能引起皮肤灼伤、毛发脱落、骨髓抑制、DNA损伤等严重的辐射反应,致使辐射患者短期内死亡[23]。电离辐射损伤的主要机制是辐射致使机体生成过多的氧自由基[24-25]。过多的氧自由基能引起脂质过氧化反应,产生的代谢产物可直接攻击生物大分子物质,造成细胞结构破坏及功能的紊乱,从而对机体造成严重的损伤[26]。甘西鼠尾草能降低脂质过氧化物丙二醛的含量,显著抑制羟自由基的产生,并抑制脂质过氧化反应[27]。本课题组制备的SPE中,迷迭香酸及丹酚酸B的含量较高,且为主要活性化合物。迷迭香酸为咖啡酸与3,4-二羟基苯基乳酸缩合而成的酯,分子结构中含有较多的酚羟基;具有较强的抗氧化、抗炎、抗过敏[28-30]等生理活性。迷迭香酸是一种抵御紫外线及其他电离辐射优良的防护剂,其防护作用与抑制炎症反应、消除活性氧自由基的机制相关[31]。迷迭香酸还可减轻X射线诱导的人真皮微血管内皮细胞增殖抑制和凋亡,提高细胞内抗氧化能力、清除活性氧以改善细胞内的氧化胁迫[32]。丹酚酸B是咖啡酸的四聚体化合物,是有效的自由基清除剂和抗氧化剂[33]。本实验结果表明,SPE具有提高辐射损伤大鼠体质量,增加红细胞、血红蛋白、血小板数量,改善肝脏损伤、脾脏损伤等抗辐射损伤作用。迷迭香酸、丹酚酸B等结构中含有多酚羟基的酚酸类化合物是SPE具有辐射损伤保护作用的物质基础,其作用机制主要是抗氧化作用及清除氧自由基作用。
辐射作用机体后,血液系统及造血系统最早发生改变,主要是抑制或破坏造血干细胞和增殖池细胞的增殖能力,造成造血功能低下或衰竭,诱发感染、贫血、出血等并发症[34]。实验鼠遭受X射线辐射后,鼠体短期内会出现代谢失常、造血功能破坏等症状,引起红细胞、白细胞、血小板等血细胞数量下降,然后会逐渐恢复[35]。本实验亦证实了以上损伤及恢复过程,大鼠在遭受非致命辐射损伤后,其体质量、红细胞、血红蛋白、白细胞、血小板等指标短期内均显著下降,但同时,由于大鼠自身适应与调节机制,以上损伤经过一段时间后能够在一定程度上自我修复。本实验结果显示,SPE能显著缩短大鼠体质量、红细胞、血红蛋白、血小板等损伤的恢复时间,并显著提高损伤恢复的程度和效果,但对白细胞损伤无明显保护作用。表明,SPE促进了辐射大鼠体征持续好转,强壮体质,能够显著提高体质量,口服5周SPE,其体质量可恢复至正常水平。
大鼠遭受急性辐射时,骨髓造血功能受损,即发生血小板生成障碍,致血小板急剧减少,影响凝血和止血功能。同时,脾脏在病态及大失血后能应激产生各种血细胞。辐射1周后,大鼠造血功能开始修复,新生成的血小板主要通过脾脏贮存,再进入循环系统,以维持血液中的正常量。本实验证实,SPE对辐射大鼠脾脏具有一定的保护作用,可能通过强化脾脏造血功能生成、增加脾脏内新生成血小板与循环系统血小板交换的生理功能,促进辐射大鼠血小板损伤的恢复。本课题组前期研究表明SPE能够明显降低大鼠全血黏度、改善血液循环状态[36]。迷迭香酸具有抗血栓和抗血小板聚集作用,体内可阻抑胶原诱导的血小板聚集,促进纤维蛋白溶解活性[37];丹酚酸B对家兔血浆黏度、红细胞压积和聚集指数具有明显的降低作用,可导致家兔血液黏度降低[38]。因此,SPE能够保护损伤的血小板,可能与其迷迭香酸、丹酚酸B含量较高,且具有降低全血黏度的药理作用有一定的关联。
文献报道,迷迭香酸能抑制羟自由基致小鼠肝脏线粒体氧化损伤,提高线粒体膜流动性,增强琥珀酸脱氢酶活性[39],且对四氯化碳致小鼠急性肝损伤具有保护作用,能降低小鼠血清谷丙转氨酶、天冬氨酸转氨酶活性、甘油三酯含量,减轻肝脏炎症反应,改善肝纤维化[40-41]。迷迭香酸具有免疫调节功能[30,42],能增强脾脏造血功能,有效保护脾脏等免疫器官[43]。本实验证实了SPE对辐射大鼠肝、脾损伤具有保护作用,对于辐射损伤后促进肝脏新陈代谢、脾脏细胞和体液免疫的功能恢复,维持机体正常的生理功能,防止严发生重感染具有积极的意义。本课题组前期研究表明SPE具有温和的利尿作用[36]。因此,SPE可加速损伤代谢物及毒素经尿排出体外,有利于辐射后机体紊乱内环境的快速修复。已有研究证实,丹参水溶性有效活性部位丹参多酚酸盐对辐射造成的血管内皮细胞损伤具有明显的保护作用,能够增加辐射损伤细胞中的超氧化物歧化酶活性,降低丙二醛含量,减少细胞凋亡[44];丹参水溶性提取成分丹参素也具有极强的抗氧化及清除自由基的活性[45]。此外,迷迭香酸的毒性较低,小鼠静脉注射给药的半数致死量仅为561 mg/kg[46]。
综上所述,甘西鼠尾草作为丹参的同属植物,其总酚酸提取物对于大鼠辐射损伤具有良好的保护作用,疗效明确且安全,临床应用前景良好。下一步,应继续进行深入研究,有望将其开发成为一种低毒高效、价廉质优、服用方便的抗辐射天然药物。
