低温胁迫下香梨优斑螟内参筛选及HSP70、HSP90基因表达分析
2020-02-25王德钢贺鹏鹏马光皇肖海兵熊仁次杨明禄
王德钢,贺鹏鹏,马光皇,肖海兵,3,熊仁次,2,3*,韩 旭,3, 杨明禄,2,3*
(1.塔里木大学植物科学学院,新疆 阿拉尔 843300;2.南疆特色果树高效优质栽培与深加工技术国家地方联合工程实验室,新疆 阿拉尔 843300;3.农业农村部阿拉尔作物有害生物科学观测实验站,新疆 阿拉尔 843300)
【研究意义】香梨优斑螟(Euzopherapyriella)属鳞翅目螟蛾科,在新疆广泛分布,可为害香梨、苹果、枣、杨树等果树与林木,蛀食香梨与苹果的果肉、果心、果皮和种子,在香梨、枣和杨树上会蛀食韧皮部,导致腐烂病发生,使树势衰弱,严重时会造成枝干死亡,对新疆梨、枣、苹果等产业健康发展影响较大。香梨优斑螟在南疆每年发生3~4代,后期有世代重叠现象,该虫以老熟幼虫越冬,10月份幼虫逐渐进入越冬状态,越冬代幼虫翌年3月下旬开始化蛹,4月上中旬进行化蛹盛期,羽化盛期在4月下旬,第1、2代成虫羽化高峰分别在6月上中旬和7月中下旬[1-3]。关于香梨优斑螟分子生物学方面的研究较少,仅限于利用COI基因和ND5基因分析香梨优斑螟遗传结构、分子鉴定[4-6]及不同虫态内参基因筛选[7]等研究。香梨优斑螟作为幼虫越冬的害虫,研究幼虫热激蛋白(Heat shock protein,HSP)基因表达对低温响应特征有助于了解其低温滞育机理。【前人研究进展】热激蛋白是一种保守的抗逆蛋白[8],在昆虫体内普遍存在,作为分子伴侣参与一些重要的细胞生理活动,协助细胞内其他蛋白折叠,避免蛋白聚集或错误折叠而降解,已发现的HSPs、HSP40、HSP60、HSP70、HSP90等多种类型[9]。HSPs对外界环境变化响应迅速,逆境胁迫下高表达的HSPs可能对细胞起到保护作用[10],促进维持细胞正常生理功能,提高机体响应的适应能力,从而增强抗逆性。1962年在黑腹果蝇(Drosophilamelanogaster)中首次发现一个基因与高温诱导其唾腺的多线染色体产生膨突有关[11],后证实果蝇染色体出现的膨突由高温激发基因转录合成一种特殊的蛋白引起[12],直到1982年在美国召开HSPs国际会议后HSPs才开始广泛研究。HSPs对环境变化反应迅速,高温和低温的胁迫下都会诱导昆虫表达不同的HSPs,助其度过不良的环境[13],低温和高温处理沙葱萤叶甲(Galerucadaurica)1 h及恢复室温30 min后均能诱导HSP20.6基因表达上调[14],-5 和0 ℃低温处理的药材甲(Stegobiumpaniceum)成虫体内HSP60的表达量均显著高于对照组[15],HSP70在高低温胁迫下西花蓟马(Frankliniellaoccidentalis)能够被诱导并且显著表达[16],沙棘木蠹蛾(Eogystiahippophaecolus)在低温胁迫后HSP70基因表达上调,冷休克恢复处理后的1 h内,HSP70的表达显著增加,然后减少,冷休克促进了HSP70的表达[17],沙棘木蠹蛾在不同的低温处理下,Hsp90基因的表达也会上调,呈先升后下降的趋势[18]。【本研究切入点】HSPs家族基因对温度变化诱导高水平表达很多在昆虫中都被证实,从对6和12月香梨优斑螟幼虫转录组数据库的研究发现HSP70和HSP90基因的表达差异较大。【拟解决的关键问题】本文筛选香梨优斑螟幼虫低温胁迫下的内参基因,进而选择对温度较敏感的HSP70和HSP90基因为目标,研究HSP70和HSP90基因对低温胁迫的响应规律。
1 材料与方法
1.1 虫源
香梨优斑螟5龄幼虫,6月中旬采集自阿拉尔市塔里木大学校内梨园。
1.2 主要试剂与仪器
TRIzon Reagent(康为世纪生物科技有限公司);SGExcel UltraSYBR Master(上海生工生物有限公司);PrimeScript RT Reagent Kit with gDNA Eraser(宝日医生物技术有限公司)。超微量分光光度计(NanoDrop 2000,赛默飞世尔科技公司);荧光定量PCR仪(Eprealplex4 S,Eppendorf)。
1.3 试验方法
1.3.1 处理方法 香梨优斑螟幼虫分别于4 ℃低温胁迫下处理0(CK)、0.25、1、3、8、12、18、24 h,每处理3头幼虫,重复3次,实时荧光PCR 4 个技术重复。处理后幼虫立即放入液氮中冷冻,后置于-80 ℃冰箱备用。
1.3.2 总RNA提取与cDNA合成 将样品匀浆后,按照TRIzon Reagent说明书提取总RNA,超微量分光光度计检测RNA样品质量和浓度。按照PrimeScript RT Reagent Kit with gDNA Erase说明去除总RNA中基因组DNA,并以1.0 μg总RNA为模板合成cDNA,稀释10倍于-20 ℃保存备用。
1.3.3 内参及HSP基因引物设计 从实验室香梨优斑螟转录组数据库获得目标基因序列,分别是β-肌动蛋白基因(β-Actin,Actin)、β-微管蛋白基因(TUBulinbeta,TUB)、甘油醛-3-磷酸脱氢酶基因(glyceraldehyde-3-phos-phat dehydrogenase,GAPDH)、18s核糖体RNA(18s ribosomal RNA, 18s)、多聚泛素基因(ubiquitin,UBQ),热激蛋白基因HSP70和HSP90,利用Primer Premier 5.0软件设计荧光定量PCR引物(表1)。
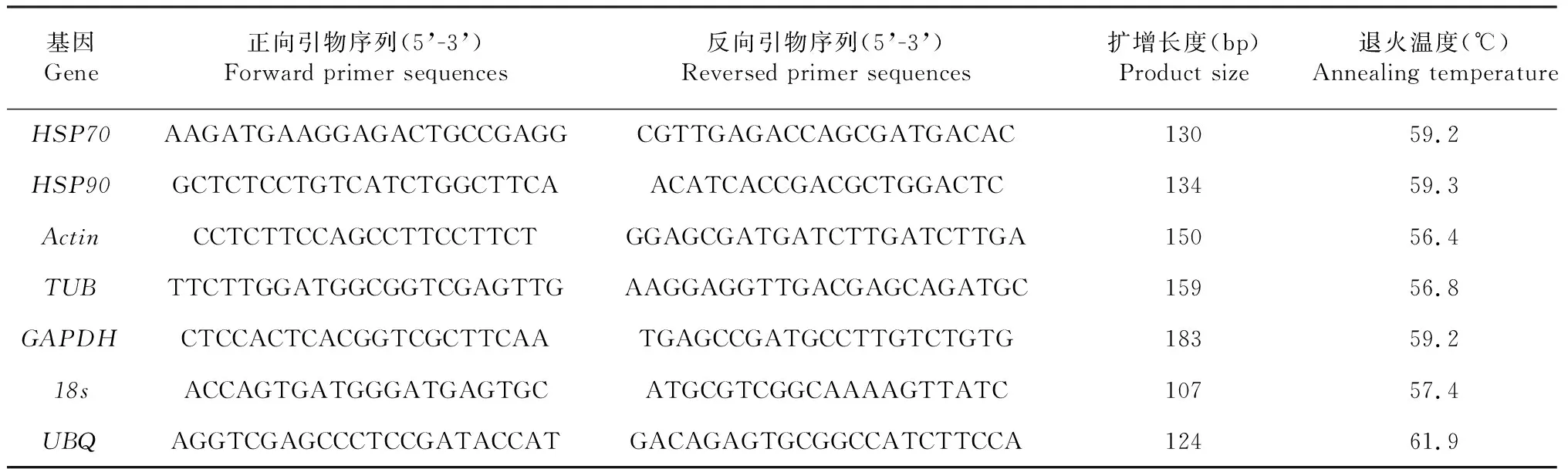
表1 RT-qPCR引物序列
1.3.4 实时荧光PCR及扩增效率 扩增体系(20 μl):荧光mix 12.5 μl,上下游引物各0.4 μl (终浓度0.2 μM),cDNA模板1 μl,加ddH2O至20 μl。
扩增条件:95℃ 3 min(预变性),95 ℃变性15 s,56 ℃退火20 s,72 ℃延伸25 s, 40个循环;熔解曲线:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。
通过设置10倍梯度稀释,即cDNA 依次稀释10、102、103、104、105倍作为模板进行扩增,绘制标准曲线,计算引物的扩增效率[19]。
1.4 数据分析
采用ΔCt法[20]、GeNorm[21]、NormFinder[22]、BestKeeper[23]和RefFinder[24]软件分析内参基因稳定性。利用所筛选的稳定内参计算热激蛋白基因相对表达量,公式为相对表达量=2-(ΔΔCt)[25],利用DPS的Duncan法进行显著性分析。
2 结果与分析
2.1 总RNA提取及引物扩增效率分析
香梨优斑螟幼虫总RNA的OD260/280比值在1.9~2.1,利用试剂盒转录为cDNA备用。所设计引物的扩增产物溶解曲线为单一峰,均具有较好的特异性,扩增线性相关系数R2为0.9817~0.9958,扩增效率也在93.08 %~100.97 %(表2),设计引物符合相对定量检测需要。
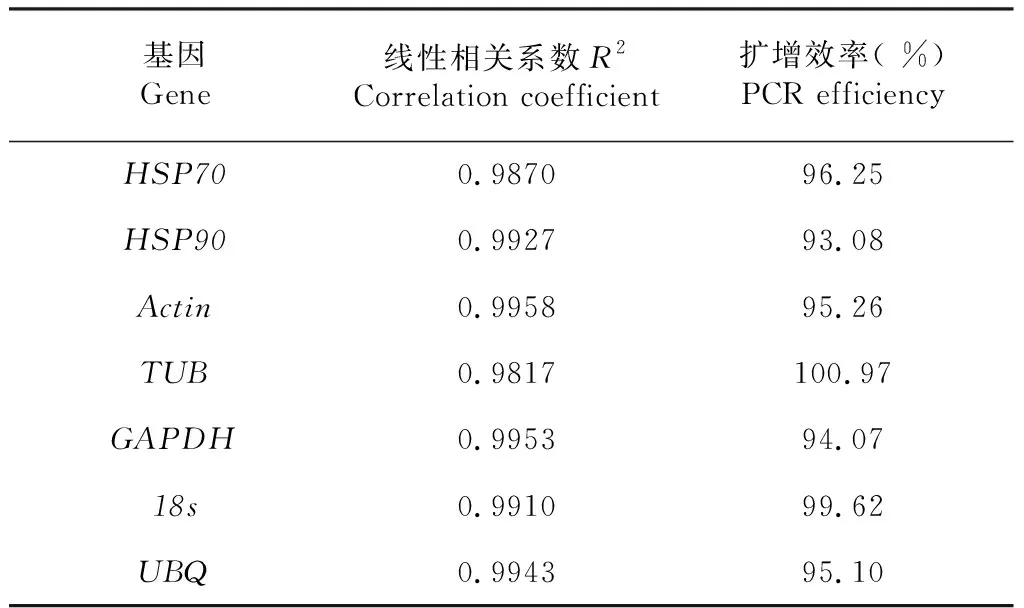
表2 引物扩增效率
2.2 候选内参基因Ct值变化
候选的香梨优斑螟5个内参基因低温胁迫下Ct值较为稳定,变化趋势较为一致。18s内参基因表达丰度最高,Ct值5.38~9.58,GAPDH,TUB和UBQ基因表达丰度相对较低,Ct值15.16~24.58, 在低温处理24 h时内参基因表达都有一定的下降趋势(图1)。
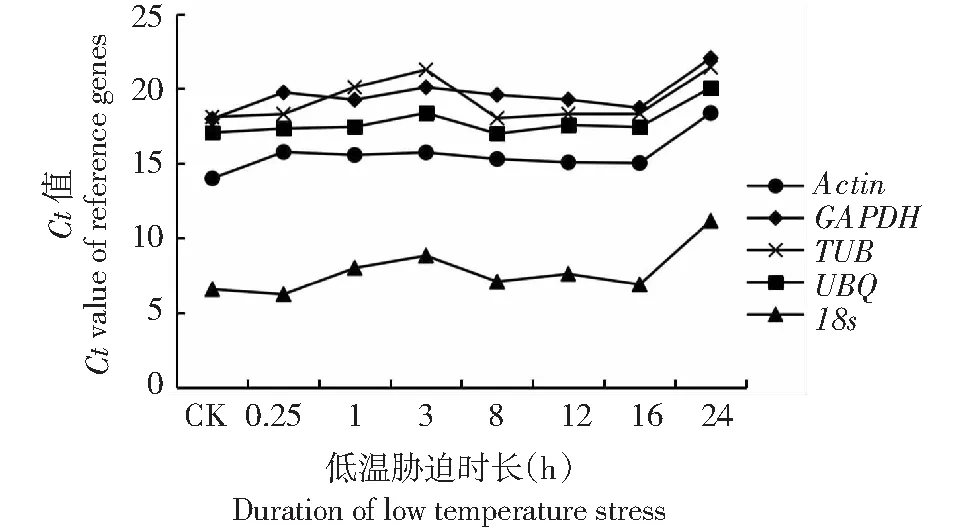
图1 内参基因Ct值变化趋势Fig.1 Variation trend of Ct value of reference genes
2.3 低温胁迫候选内参基因稳定性
△Ct法计算结果UBQ分值最小,其次为GAPDH,TUB基因的分值最高、稳定性最差(图2-A)。NormFinder软件分析的稳定性为UBQ>GAPDH>Actin>18s>TUB(图2-B)。GeNorm以参数M=1.5为阈值来判断基因的稳定性,小于1.5时表明该基因稳定性良好,并且根据M值的大小来判断基因稳定性高低,M值越大则基因稳定性越差,M值越小则基因的稳定性越好[22],所选内参基因M值大小为0.563~1.446,说明候选内参基因稳定性都较好,依次为Actin=GAPDH>UBQ>18s>TUB(图2-C)。BestKeeper分析的为18s>UBQ>Actin>GAPDH>TUB,最稳定的基因为18s,这与其他软件的结果有所不同(表3)。经RefFinder软件综合分析发现其稳定性依次为UBQ>GAPDH>Actin>18s>TUB(图2-D),UBQ和GAPDH基因综合稳定性最好,Actin稳定性相对UBQ和GAPDH稍差,仍是较为稳定的内参基因,TUB稳定性最差,对18s基因的稳定性评价上存在一定分歧。
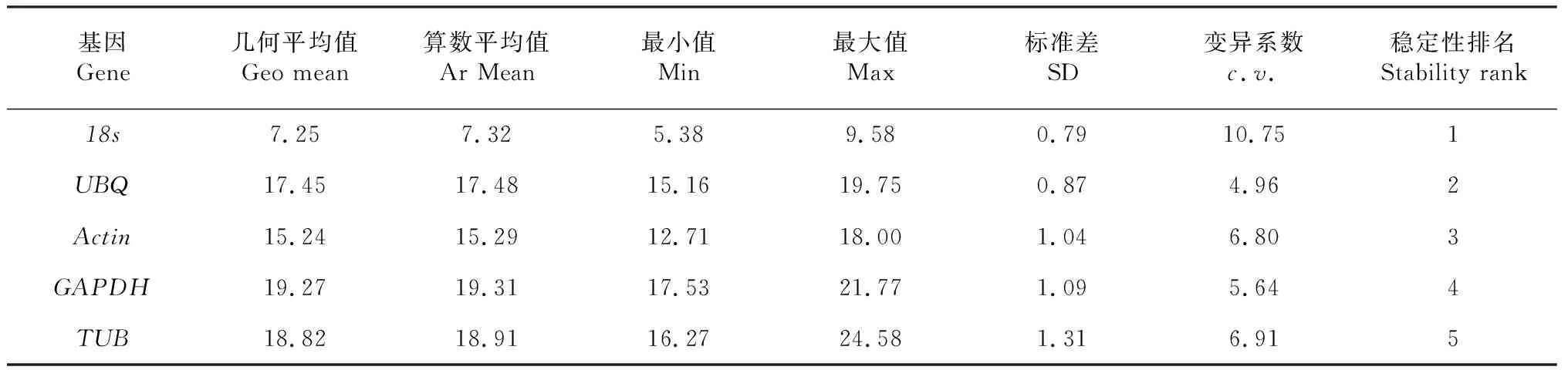
表3 BestKeeper 软件分析内参基因稳定性

a.△Ct法评价结果,B.Normfinder软件评价结果,C.Genorm软件评价结果,D.RefFinder软件评价结果A:Evaluation results of △Ct,B:Evaluation results of Normfinder,C:Evaluation results of Genorm,D:Evaluation results of RefFinder
2.4 低温处理下HSP70和HSP90基因表达特征
HSP70基因经过低温胁迫处理后,其相对表达
量分别是对照组的5.08、8.79、2.52、4.09、1.50、6.50、3.76倍,并于1 h处理时达到峰值,HSP70基因相对表达量明显高于对照,初期及24 h末期显著高于对照(图3)。HSP90基因分别是对照组的4.01、12.80、7.00、2.60、1.70、4.48、4.48倍,于1 h处理时达到峰值,表达特征也与HSP70基因相似,在18 h后相对表达量趋于稳定(图4)。
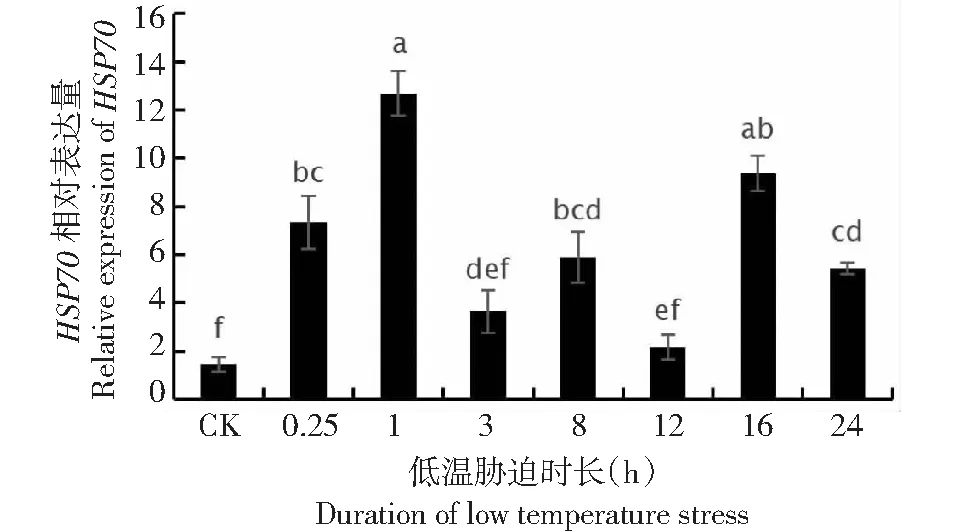
图3 HSP70基因的相对表达量Fig.3 Relative expression of HSP70 gene
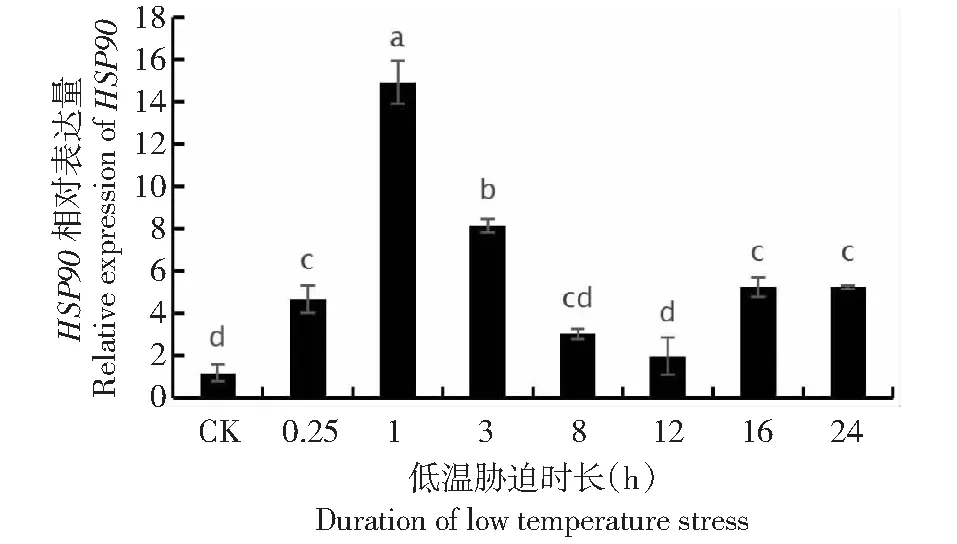
图4 HSP90基因的相对表达量Fig.4 Relative expression of HSP90 gene
3 讨 论
实时荧光定量PCR是生物基因表达研究最广泛的手段之一,而基因相对表达研究中内参基因的选择对结果影响很大[26]。曾在很长时间内认为维持细胞正常生命代谢所必需的管家基因非常稳定[27],但随着研究深入发现管家基因表达并非完全恒定的[28],在不同处理条件下各管家基因的表达稳定性存在一定差异,因此选择适合的内参基因显得十分重要[29]。研究香梨优斑螟在受低温胁迫下热激蛋白家族中HSP70和HSP90基因表达特征,首先需要筛选稳定的管家基因作为内参,借助软件评价内参基因的稳定性,但不同软件的评价结果存在一定差异,这种差异的出现是不同软件的算法引起的[30],在内参基因筛选的研究中普遍存在,最终的稳定性排名需要综合分析[31-32],昆虫内参筛选研究中Actin常被认为是理想的内参,即使作为温度胁迫时也较为稳定[33-34],在本研究中发现香梨优斑螟老熟幼虫在低温胁迫处理后Actin基因也比较稳定性,其稳定性比UBQ和GAPDH基因要差些,这点与水稻害虫褐飞虱(Nilaparvatalugens)和白背飞虱(Sogatellafurcifera)的研究结果相同[35]。GAPDH基因稳定性相对较好,在斜纹夜蛾(Ctenopseustisobliquana)温度胁迫时被认为GAPDH是最佳内参[28],而在对瓜实蝇(Bactroceracucurbitae)的温度胁迫研究中GAPDH基因稳定性并不好[36],昆虫种类甚至虫态不同内参稳定性都会存在差异,如二化螟(Chilosuppressalis)和褐飞虱(Nilaparvatalugens) 温度胁迫的研究中以TUB基因作为内参[37-38],而本研究中发现TUB是5个候选内参基因中最不稳定的。
HSPs基因对外界环境的迅速响应可能与细胞保护作用有关[10],香梨优斑螟幼虫低温胁迫下HSP70和HSP90在30 min显著高表达,约1 h后达到峰值,推测HSPs受到外界低温刺激后被大量诱导表达,以避免受到低温伤害;在之后的处理时间内表达量有所下降,应该是受到相应HSPs积累量调控所致,这种调控还表现在18 h时基因表达有所回升的现象,这与三叶草斑潜蝇(Liriomyzatrifolii)和B型烟粉虱(BemisiatabaciB-biotype)研究结论相似[39-40]。
4 结 论
5种内参基因在香梨优斑螟幼虫低温胁迫处理后表达有一定差异,除了TUB基因外,表现比较稳定,其中UBQ基因稳定性最好。在低温胁迫下,HSP70和HSP90基因相对表达量都呈现先上升后下降的趋势,并在18 h后有小幅度上升,并维持在较高的水平,这可能有助于提升幼虫对低温的耐受力。
