外源硫化氢对盐胁迫下棉花幼苗生长及渗透调节系统的影响
2020-02-25王红燕张淑英
王红燕,张淑英
(石河子大学农学院,新疆 石河子 832000)
【研究意义】棉花(GossypiumhirsutumL.)是我国重要的战略物资和经济作物,关乎国计民生。我国棉花的生产量、消费量和进口额都位居世界前列[1-2]。新疆是全国最大的产棉区,产量占全国棉花总产量的60 %以上,棉花生产在新疆经济发展中占有非常重要的地位[3]。植物的正常生长发育需要一个适度的盐分环境,盐渍化的土壤导致植物器官中Na+浓度升高,而Na+过量积累会降低细胞的水势造成潜在的渗透胁迫,抑制植物生长发育[4]。盐分胁迫能够显著抑制棉花苗期的生长、养分吸收和生物量积累,导致盐胁迫下棉花苗期光合速率下降[5]。据统计,新疆盐渍化总面积达8.48×106hm2,现有耕地中31.1 %的面积受到盐渍化的危害[6],严重制约着农作物生长和产量,提高棉花耐盐性是新疆棉花生产的迫切需要。【前人研究进展】硫化氢(H2S)是继CO、NO之后的又一重要气体信号分子,可调节植物气孔运动、根的发生、参与光合作用及非生物胁迫耐受性等过程[7-9]。研究表明,低浓度NaHS(即H2S供体)能缓解盐胁迫下对加工番茄种子萌发的抑制作用,增强抗氧化酶活性,降低丙二醛(MDA)积累等,并且H2S对耐盐性弱的加工番茄品种KT-63缓解效应表现得更强[10]。在盐胁迫处理下,0.1 mmol·L-1H2S喷施处理显著增强了茶树叶片抗氧化酶活性和抗氧化物含量,提高叶绿素、游离脯氨酸(Pro)和可溶性蛋白(SP)含量,从而提高茶树对盐胁迫的适应能力[11]。【本研究切入点】已有学者就H2S对盐胁迫下种子萌发、叶片光合色素含量、相对含水量、根系活力、抗氧化酶活性和活性氧(ROS)积累特征的影响已进行大量研究[11-14],但外源H2S对盐胁迫下棉花幼苗渗透调节系统影响报道较少,其作用机理还尚不清楚。【拟解决的关键问题】本文研究外源H2S对不同程度盐胁迫下棉花幼苗生长、渗透调节系统及MDA含量的影响,初步探讨施用外源H2S后棉花幼苗渗透调节系统对盐胁迫的生理响应机制,为新疆盐渍土壤地区棉花高产栽培提供可借鉴的苗期调控技术。
1 材料与方法
1.1 试验设计
试验于2018年5-7月,在石河子大学试验站进行,以棉花品种新陆早48号为供试材料。试验设置盐分(NaCl分析纯,0、100、200 mmol/L)、H2S(NaHS分析纯,0、20、50、100和500 μmol/L)2因素随机组合,共11个处理(表1),每处理重复3次。
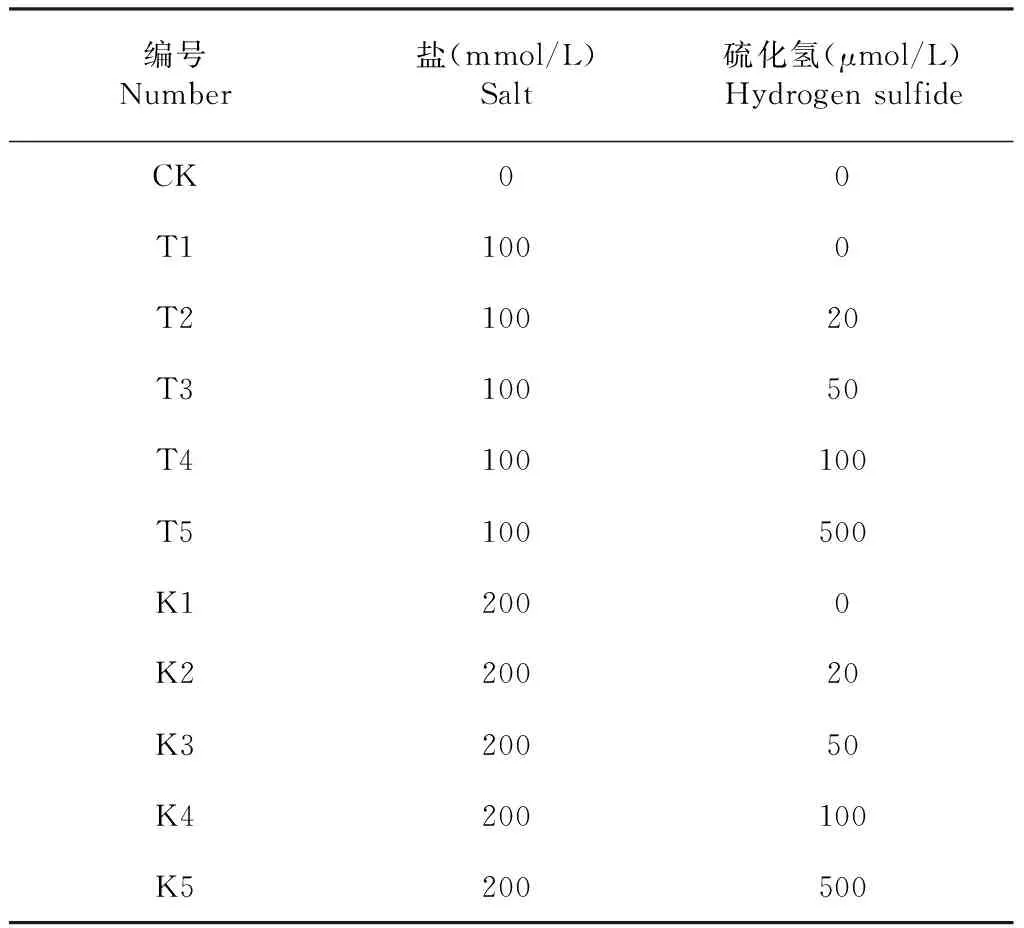
表1 实验处理及对应编号
播种前,选择均匀、饱满的种子晒种2 d,用10%过氧化氢消毒10 min后,蒸馏水冲洗干净备用。将蛭石装于塑料营养钵(规格:12 cm×11 cm)中,播种时,每营养钵播种3粒,用蛭石覆盖2~3 cm,铺平压紧。将营养钵放置于周转箱内营养液栽培,每个周装箱放置12钵。棉花出苗后用去离子水进行浇灌,当幼苗两片子叶完全展开后浇施Hoagland营养液。出苗12 d后,开始进行盐分(将对应浓度的NaCl用量加入营养液中)处理。出苗后第18~60天进行外源H2S处理,将NaCl溶于营养液中,其混合液浇于棉花基部,避免碰触到棉花叶片。同时配施不同浓度的H2S溶液,喷施在相应处理棉花叶片上。出苗60 d后,取样测定生物量、游离脯氨酸、游离氨基酸、有机酸含量等。
1.2 测定项目及方法
将棉花幼苗按器官分取、冲洗干净,擦干称其鲜重,再置于105 ℃干燥箱中杀青30 min,80 ℃烘干至恒重测定干物质量。
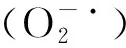
1.3 数据处理
数据以“平均值±标准差”表示,采用Microsoft Office Excel 2010软件处理数据和SigmaPlot软件绘图,采用SPSS 19.0软件进行数据统计分析,采用邓肯法(Duncan)进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 外源H2S对盐胁迫下棉花幼苗生长的影响
由表2可以看出,盐胁迫对棉花幼苗叶鲜重、叶干重、茎鲜重、茎干重和根干重都产生了抑制作用,且不同浓度盐(NaCl,0、100和200 mmol/ L)胁迫对棉花幼苗生物量产生了不同程度抑制作用。不添加H2S处理棉花幼苗生物量随NaCl浓度的增加而减少,如T1、K1处理与CK相比,棉花叶片鲜重分别下降了37.53 %、51.21 %;叶片干重分别下降了48.24 %、56.47 %;茎鲜重分别下降了36.71 %、41.06 %;茎干重分别下降了39.53 %、39.53 %;根系干重分别下降了29.63 %、37.04 %。相同盐胁迫条件下,采用不同浓度H2S溶液对棉花幼苗叶面喷施后,棉苗生物量都有不同程度的增加,整体呈现出随H2S浓度增加棉苗生物量先上升后下降的趋势。如T2、T3、T4、T5与T1相比,棉苗叶片鲜重分别增加了2.15 %、17.17 %、45.49 %、28.33 %。说明棉花幼苗生长在盐胁迫下受到抑制,而外源H2S能缓解盐分逆境对棉花幼苗生长的抑制作用,其中H2S浓度为100 μmol·L-1时缓解效应最佳。
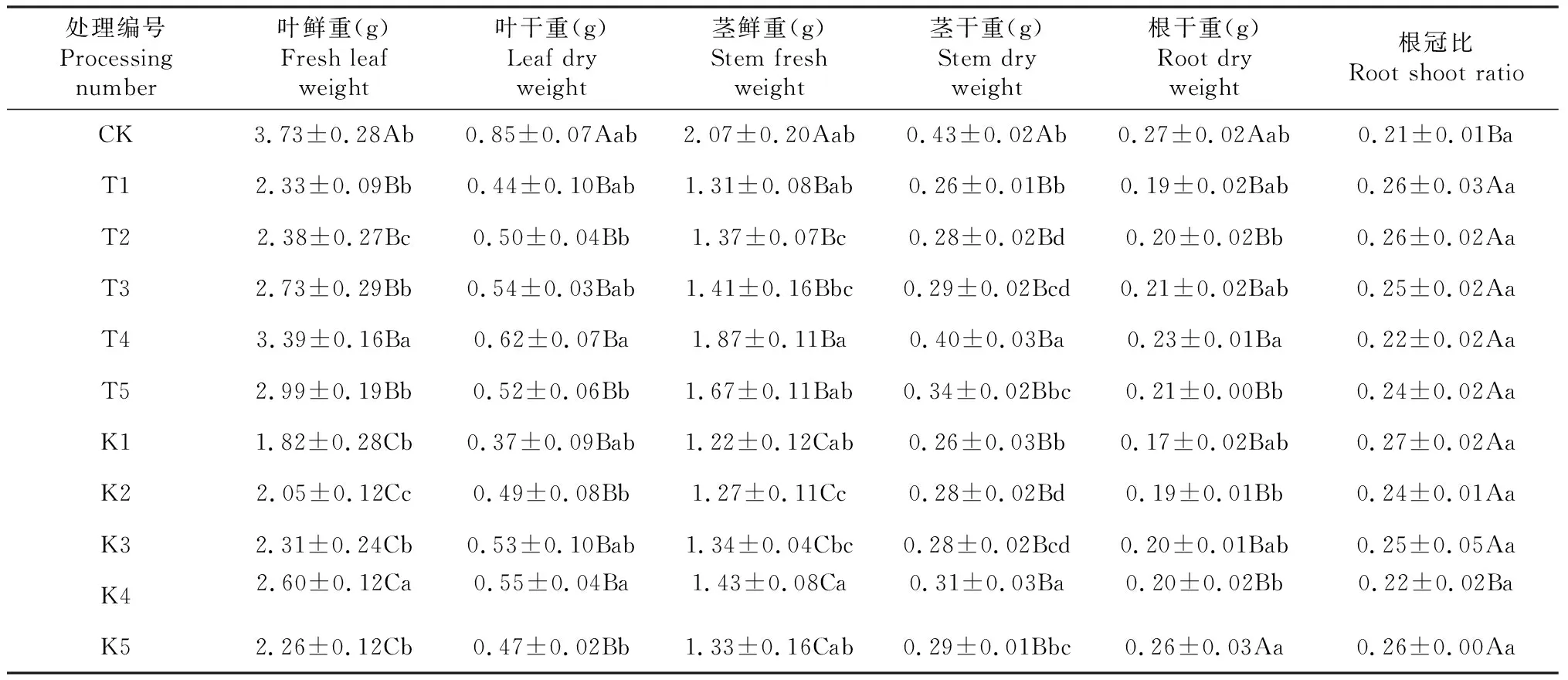
表2 外源H2S对盐胁迫下棉花幼苗生物量的影响
方差分析表明,棉花幼苗叶片鲜重、叶片干重、茎鲜重、茎干重和根干重随盐分浓度升高而显著下降(P<0.01)。相同盐胁迫条件下棉花幼苗叶片鲜重、叶片干重、茎鲜重、茎干重和根干重随外源H2S浓度升高而显著升高(P<0.01)。盐分与H2S交互作用,棉花幼苗叶片鲜重、叶片干重、茎鲜重、茎干重和根干重和各处理与CK差异不显著(P>0.05),棉苗根冠比各处理与CK差异显著(P<0.05)。
2.2 外源H2S对盐胁迫下棉花幼苗电解质渗出率和MDA含量的影响
盐胁迫会引起植物细胞膜透性的变化,电解质渗透率是反映逆境胁迫下植物细胞膜损伤程度的重要指标之一。由图1-A可以看出,各处理棉花幼苗电解质渗出率与对照(CK)相比均明显升高。同一盐分不同H2S处理间比较,电解质渗出率随H2S浓度增加呈现先降低后升高的趋势,如T2、T3、T4、T5与T1相比,棉苗电解质渗出率分别降低了4.17 %、11.38 %、11.55 %和9.25 %。相同H2S浓度不同盐分处理间,电解质渗出率随盐分浓度的增加而增大。如:T1、K1与CK处理相比,棉苗电导率渗出率分别升高了20.90 %、34.30 %,说明在盐胁迫下,Na+过多导致棉苗细胞膜受损,膜透性增大,棉叶电解质渗出率增大,一定浓度的外源H2S使电解质渗出率降低,缓解了盐胁迫对棉花幼苗生长的胁迫,其中H2S浓度为100 μmol·L-1时缓解效应最佳。
方差分析表明,外源H2S浓度相同处理间棉花幼苗电解质渗出率随盐分浓度升高而显著升高(P<0.01),相同盐胁迫条件下棉花幼苗电解质渗出率随外源H2S浓度升高而显著升高(P<0.01),盐分与H2S交互作用,各处理棉花幼苗电解质渗出率与CK差异显著(P<0.01)。
植物细胞遭受逆境胁迫时,细胞膜中脂肪酸会进行过氧化作用,MDA是膜质过氧化的代谢产物,因此MDA含量大小可反映细胞膜损伤程度[20]。由图1-B可知,未添加H2S处理,MDA含量随着盐浓度增大显著增加(P<0.01),如T1、K1与CK处理相比,棉苗丙二醛含量分别升高了18.48 %、20.27 %。在相同盐胁迫处理中,MDA含量随着盐浓度的增大呈现先减小再增大的变化趋势,如T2、T3、T4、T5与T1相比,棉苗MDA含量分别减少了3.89 %、8.95 %、12.23 %、8.12 %,棉花幼苗MDA含量各处理间差异显著(P<0.01)。盐胁迫增加了MDA含量,加剧了细胞膜损伤,一定浓度H2S处理能缓解盐胁迫对棉苗细胞膜的伤害,其中H2S浓度为100 μmol·L-1时缓解效应最佳。
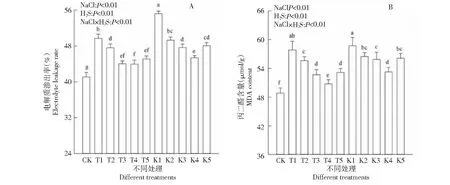
不同字母表示NaCl与H2S交互作用不同处理间差异显著( P<0. 05) ,下同Different letters indicate that the interaction between NaCl and H2S has significant difference among different treatments (P < 0.05). The same as below
2.3 外源H2S对盐胁迫下棉花幼苗渗透调节系统的影响
2.3.1 游离氨基酸含量 游离氨基酸是一种重要的渗透调节物质,它的积累与代谢与盐胁迫密切相关[21]。由图2可以看出,各处理棉花幼苗游离氨基酸与CK相比均表现出上升趋势。相同盐胁迫不同H2S处理间比较,棉花幼苗叶片游离氨基酸含量随H2S浓度增加呈现先降低后升高的趋势。如T2、T3、T4、T5与T1相比,棉苗游离氨基酸分别降低了0.53 %、5.28 %、15.22 %、13.87 %。相同H2S浓度不同盐胁迫处理间,游离氨基酸含量随盐分浓度的增加而增大。如:T1、K1与CK相比,棉苗游离氨基酸含量分别升高了20.40 %、38.30 %。说明盐胁迫加剧,棉叶内积累游离氨基酸,而外源H2S降低了游离氨基酸含量。
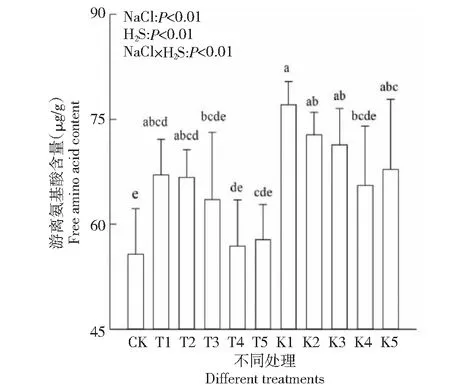
图2 外源H2S对盐胁迫下棉花幼苗游离氨基酸含量的影响Fig.2 Effects of exogenous H2S on free amino acid content of cotton seedlings under salt stress
方差分析表明,外源H2S浓度相同处理间棉花幼苗游离氨基酸含量随盐分浓度升高而显著升高(P<0.01),相同盐胁迫条件下棉花幼苗游离氨基酸含量随外源H2S浓度升高而显著下降P<0.01),盐分与H2S交互作用,各处理棉花幼苗游离氨基酸含量与CK差异显著(P<0.01)。
2.3.2 Pro含量 Pro是最重要的渗透调节物质,可缓解盐胁迫逆境、维持细胞结构的完整性, 可作为盐胁迫的敏感指标[22]。由图3可知,棉花幼苗在受到盐胁迫时,体内Pro含量表现出明显上升趋势,T1、K1与CK相比,Pro含量分别增加了54.02 %、75.62 %。K1处理棉苗Pro含量最大,各处理Pro含量水平均相应CK显著升高(P<0.01),整体Pro含量处在30~60 μg/g之间。同一盐分不同H2S处理,Pro含量随H2S浓度的增加呈先增大后减小趋势,如T2、T3、T4、T5与T1相比,分别降低了6.91 %、22.89 %、31.35 %、25.84 %,棉花幼苗Pro含量各处理间差异显著(P<0.01)。由此说明盐胁迫使棉花体内Pro含量增大,外源H2S降低了Pro的积累量,增加了消耗量,缓解了盐胁迫对棉花幼苗渗透调节系统的影响,其中H2S浓度为100 μmol·L-1时缓解效应最佳。方差分析表明,盐分与H2S交互作用,各处理棉花幼苗Pro含量与CK差异显著(P<0.01)。
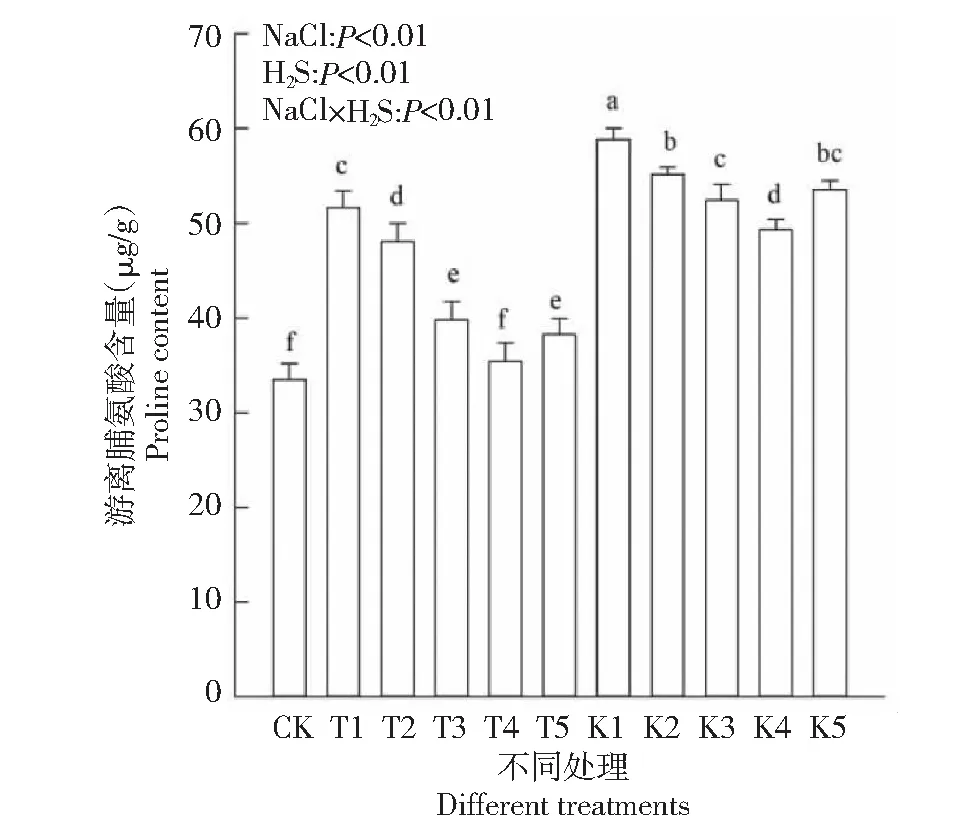
图3 外源H2S对盐胁迫下棉花幼苗游离脯氨酸含量的影响Fig.3 Effects of exogenous H2S on free proline content of cotton seedlings under salt stress
2.3.3 SS含量 SS是调节渗透胁迫的小分子物质,也是合成有机溶质的碳架和能量来源,在植物对盐胁迫的适应性调节中,是增加渗透性溶质的重要组成成分[23]。图4表明,Na+显著抑制了棉花幼苗SS含量(P<0.01),未添加H2S(如T1、K1)与CK相比,SS含量随盐分浓度增加而减小,分别降低了24.27 %、36.18 %。相同盐胁迫处理添加外源H2S后可显著提高SS含量(P<0.05),如T2、T3、T4与T1相比,分别升高了1.82 %、9.94 %和20.65 %。
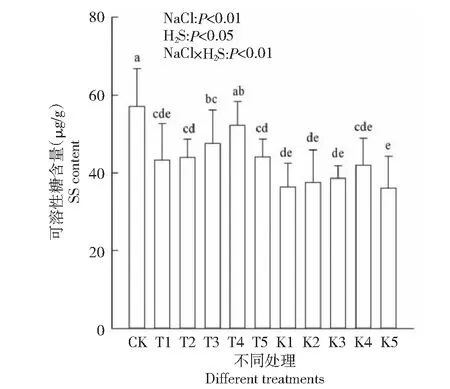
图4 外源H2S对盐胁迫下棉花幼苗可溶性糖含量的影响Fig.4 Effects of exogenous H2S on soluble sugar content of cotton seedlings under salt stress
2.3.4 苹果酸和柠檬酸含量 图5显示了不同处理棉花幼苗苹果酸(图5-A)和柠檬酸(图5-B)含量变化情况。在无外源H2S条件下,随盐分浓度增加棉花幼苗苹果酸和柠檬酸含量均显著升高(P<0.01),与CK相比,T2、K2处理苹果酸含量分别升高了16.15 %、20.85 %;T1、K1处理棉苗柠檬酸含量分别升高了22.97 %、26.14 %。
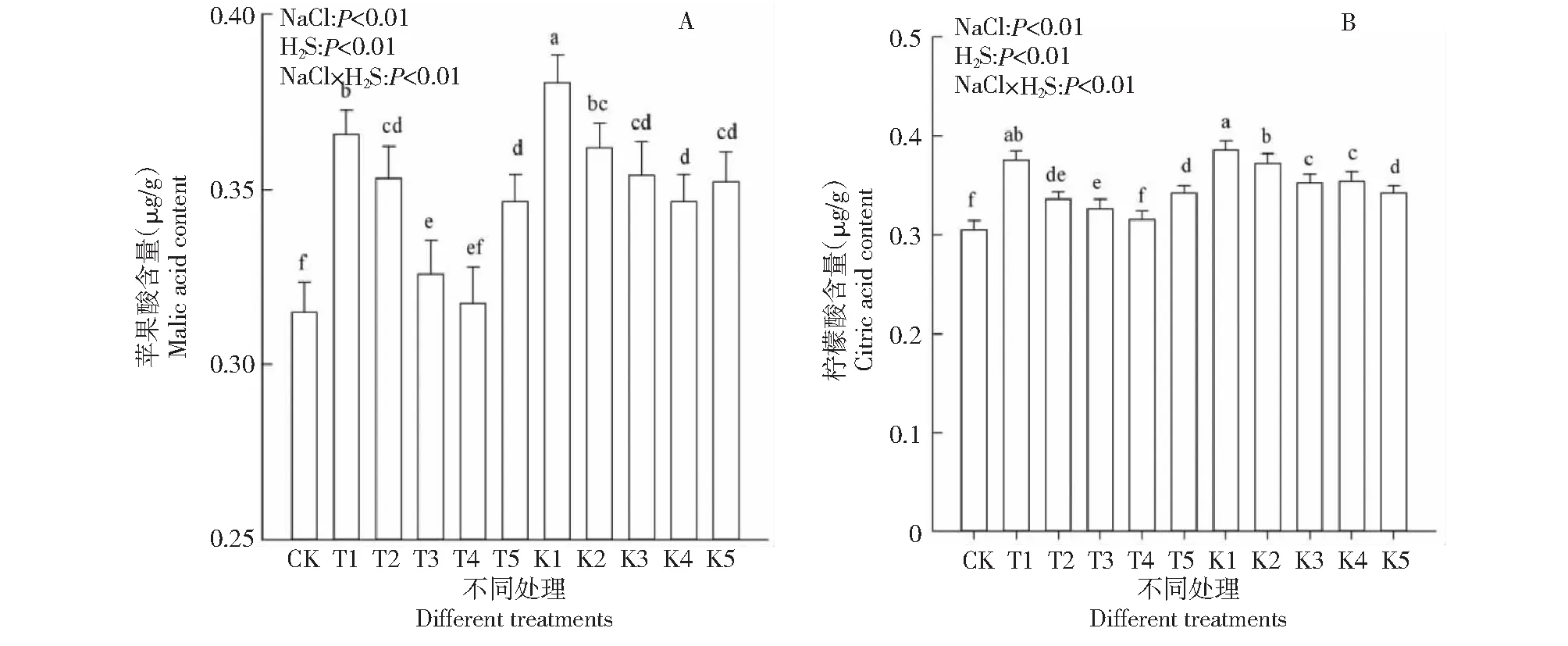
图5 外源H2S对盐胁迫下棉花幼苗柠檬酸和苹果酸含量的影响Fig.5 Effects of exogenous H2S on citric acid and malic acid content in cotton seedlings under salt stress
在相同盐胁迫条件下,随外源H2S浓度的增加,苹果酸和柠檬酸含量均显著降低(P<0.01),如T2、T3、T4、T5与T1相比,苹果酸含量分别减少了3.41 %、10.87 %、13.19 %和5.25 %;棉苗柠檬酸含量分别减少了10.57 %、13.08 %、16.05 %和8.94 %。说明外源H2S降低了苹果酸和柠檬酸的积累含量,增加了消耗量,缓解了盐胁迫对棉苗渗透调节平衡的破坏,保障棉花幼苗正常的生理代谢。方差分析表明,盐分与H2S交互作用,各处理棉花幼苗苹果酸和柠檬酸含量与CK差异显著(P<0.01)。
2.4 外源H2S对盐胁迫下棉花幼苗活性氧的影响
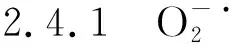
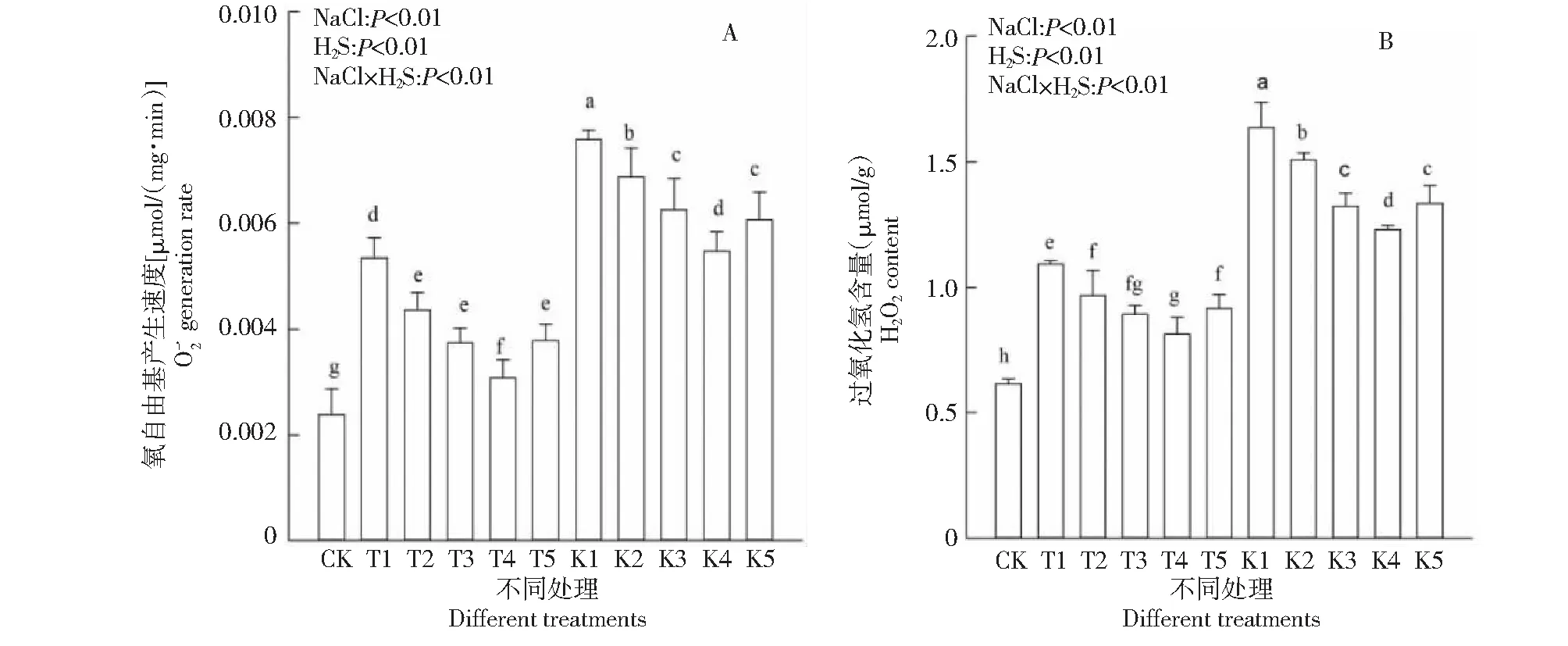
图6 外源H2S对盐胁迫下棉花幼苗产生速率和H2O2含量的影响Fig.6 Effects of exogenous H2S on hydrogen peroxide content and oxygen free radical production rate of cotton seedlings under salt stress

3 讨 论
郑州元等[24]研究表明NaCl胁迫会显著抑制加工番茄幼苗的生长,而叶面喷施H2S不同程度增加了植株生物量,缓解NaCl胁迫对加工番茄幼苗生长的抑制作用。本试验表明外源H2S能显著提高棉苗生物量(P<0.01),降低根冠比,这与郑州元等研究结果一致。说明盐胁迫会导致植物发育迟缓,抑制棉苗组织和器官的生长、分化,而外源H2S通过增加光合面积而提高棉苗碳同化量,从而促进棉苗生长发育,缓解盐胁迫造成的损伤。
张倩等[25]研究表明,盐胁迫下小麦幼苗电解液渗出率显著升高,并且盐胁迫诱导MDA积累。本试验中盐胁迫使棉苗电解质渗出率和MDA含量显著增加(P<0.01),叶面喷施H2S使棉花幼苗叶片电解质渗出率和MDA含量显著降低(P<0.01),这与蔺亚平等[26]加工番茄的研究结论基本一致。因而,可以认为信号分子H2S通过降低细胞膜脂质过氧化损伤,减少植物体内电解质外渗,维持细胞内离子平衡,缓解盐胁迫造成的伤害。
渗透调节是植物在逆境条件下,通过代谢活动增加细胞内溶质浓度,降低其渗透势而保持继续吸水,维持较正常的代谢活动。高荣嵘等[27]研究表明,单一盐处理条件下,花生幼苗游离氨基酸、Pro含量均显著增加。从本试验研究结果看,盐胁迫下棉花幼苗叶片游离氨基酸、Pro、有机酸(主要包括苹果酸和柠檬酸)均显著增加(P<0.01),外源H2S处理显著增加了渗透调节物质的消耗,以至于减少了渗透调节物质的积累。说明外源H2S通过调节棉苗渗透调节物质含量,维持细胞内渗透势,缓解盐胁迫导致的代谢失衡,保证了棉苗生理活动的正常进行,增强植株逆境适应能力。施用外源H2S降低了棉苗苹果酸、柠檬酸含量,可能与外源H2S增强棉苗离子吸收能力及H2S对棉苗pH调节机制有关。SS是植物体内主要的能量贮藏物质,是植物生长发育的营养基础,对逆境条件下的植物细胞起渗透调节作用。本试验发现盐胁迫能够显著抑制棉苗叶片SS积累(P<0.01),而添加外源H2S通过提升棉苗SS含量,增强了棉苗碳素营养代谢,有效提高了棉花幼苗抗盐性,这与董靖[28]对草木犀的研究结果相同。

4 结 论

