小桐子JcMAPK3基因的克隆及低温表达分析
2020-02-25陈永坤孔春艳
杨 宇,陈永坤,孔春艳,龚 明
(云南师范大学 生命科学学院/生物能源持续开发利用教育部工程研究中心/云南省生物质能与环境生物技术重点实验室,云南 昆明 650500)
【研究意义】小桐子(Jatrophacurcas)又名膏桐、麻疯树、假花生、臭油桐等,广泛分布于热带和亚热带地区,为大戟科(Euphorbiaceae)麻风树属植物,其种仁含油量高达40 %~60 %,桐油流动性较好,是一种极具开发价值的能源植物[1]。但由于小桐子起源于热带,属于冷敏(chilling-sensitive)植物,低温严重影响着小桐子植株的生长发育、种子形成及桐油产量,限制着小桐子产业发展和地域分布[2]。因此,对小桐子抗冷性的分子机理研究和遗传育种就显得迫切和重要。【前人研究进展】促分裂原激活蛋白激酶(Mitogen-activated protein kinase,MAPK)级联途径由促分裂原激活蛋白激酶的激酶之激酶(MAPK kinase kinase,MAP3K或MAPKKK、MEKK)、促分裂原激活蛋白激酶的激酶(MAPK kinase, MAPKK或MAP2Ks、MKKs、MEKs)、促分裂原激活蛋白激酶(MAPK或MPK、MMK)3个组分组成,通过MAPKKK-MAPKK-MAPK依次磷酸化[3]。MAPK被磷酸化后继续激活信号通路中下游特定的转录因子或蛋白激酶,引发相应的生理生化反应,对各类刺激做出应答[4]。研究发现,MAPK含有11个保守的蛋白激酶域,在激酶域VII和VIII之间具有TEY(丝氨酸-谷氨酸-酪氨酸;Thr-Glu-Tyr)或TDY(丝氨酸-天冬氨酸-酪氨酸;Thr-Asp-Tyr)磷酸化的基序,提供激活MAPK的蛋白质结合域。研究者们基于-TxY-结构域(Thr-x-Tyr),并根据保守区域的特点将MAPK(MPK/MMK)家族进行分类,含TEY结构域的亚家族可以分为A、B、C三类,含TDY结构域的则归为D类[5]。研究发现,MAPK基因在响应与适应各种生物和非生物胁迫中起着重要作用[6]。在含TEY结构的亚家族中,A类亚家族中MPK3/MPK6广泛参与各种逆境(极端温度、盐、重金属、氧化胁迫、紫外、虫害等)响应[7-8];B类成员参与调控非生物胁迫、激素信号途径、细胞分裂等,如AtMPK4在水杨酸信号途径中起负调控作用[9-10];C类亚家族中AtMAP3K17/18-AtMKK3-AtMPK1/2/7/14途径参与对ABA的响应[11],PsMPK7参与抗氧化和抵御病原菌侵染[12]。目前,已在多种植物中鉴定到多个MAPK基因,烟草(Nicotianatabacum)中发现17个MAPK成员[13],木薯(ManihotesculentaCrantz)中鉴定到21个[14],鹰嘴豆(Cicerarietinum)中有19个[15];通过前期研究发现,小桐子(Jatrophacurcas)有12个MAPK基因[16]。此外,在玉米[17]、葡萄[18]等植物中也鉴定到许多MAPK基因。【本研究切入点】前期研究发现,小桐子幼苗经过12 ℃低温锻炼后,其在1 ℃低温胁迫下的抗冷性显著提高[19-20];基于高通量测序,得到了小桐子低温锻炼条件下的转录组数据,发现MAPK3为差异表达基因[21]。研究克隆了小桐子MAPK3基因,进行该基因的生物信息学分析,通过实时荧光定量PCR(qRT-PCR)技术研究JcMAPK3在小桐子不同器官中,以及在12 ℃低温锻炼和1 ℃低温胁迫下的表达变化模式。【拟解决的关键问题】探究JcMAPK3基因在12 ℃低温锻炼和1 ℃低温胁迫过程中的表达模式,为小桐子低温关键基因挖掘和功能研究打下基础,为小桐子提高抗冷性的分子育种提供理论依据。
1 材料与方法
1.1 试验材料
研究中使用的小桐子种子来源于云南省楚雄州元谋县,采用前期的方法进行种子消毒和萌发[22],挑选萌发状态一致的小桐子种子种于花盆中,放置在人工气候箱中[设置相对湿度(RH)75 %、光周期为(光照/黑暗)16/ 8 h、昼/夜温度为26/20 ℃],当小桐子幼苗培养28 d后,将长至第3片真叶的小桐子幼苗进行低温处理和取样。首先,分别取正常生长的小桐子幼苗的根茎叶样品;其次,进行材料低温处理,将长势一致的小桐子幼苗在12和1 ℃培养箱中(RH和光周期条件同上)低温处理3 d,分别取低温处理6、12、24、48、72 h的样品,液氮速冻后冻存于-80 ℃冰箱,未处理的小桐子幼苗作为对照,每个处理进行3次生物学重复。
1.2 小桐子RNA提取和反转录
小桐子幼苗根茎叶和不同低温处理样品的RNA提取使用Omega生物公司的OMEGA HP plant RNA Kit试剂盒,并对提取的RNA进行浓度测定和琼脂糖凝胶电泳检测,反转录使用宝日医生物的反转录试剂盒(TaKaRa PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit),得到的小桐子cDNA置于-20 ℃冰箱保存备用。
1.3 JcMAPK3全长cDNA的克隆
根据JcMAPK3基因mRNA序列(GenBank登录号:XM 012209518.2),利用DNAMAN8软件设计MAPK3基因扩增引物JcMAPK3-F/R(表1)。PCR扩增以小桐子cDNA为模板,按照高保真酶(TaKaRa PrimeSTAR®GXL DNA Polymerase)说明书进行PCR扩增。PCR产物通过琼脂糖凝胶电泳分离后,进行目的DNA片段的回收和纯化,再连接pGEM-T Easy载体、转化,放置在37 ℃培养箱中过夜培养,挑取白色单菌落进行PCR验证,送至擎科生物技术公司进行测序。
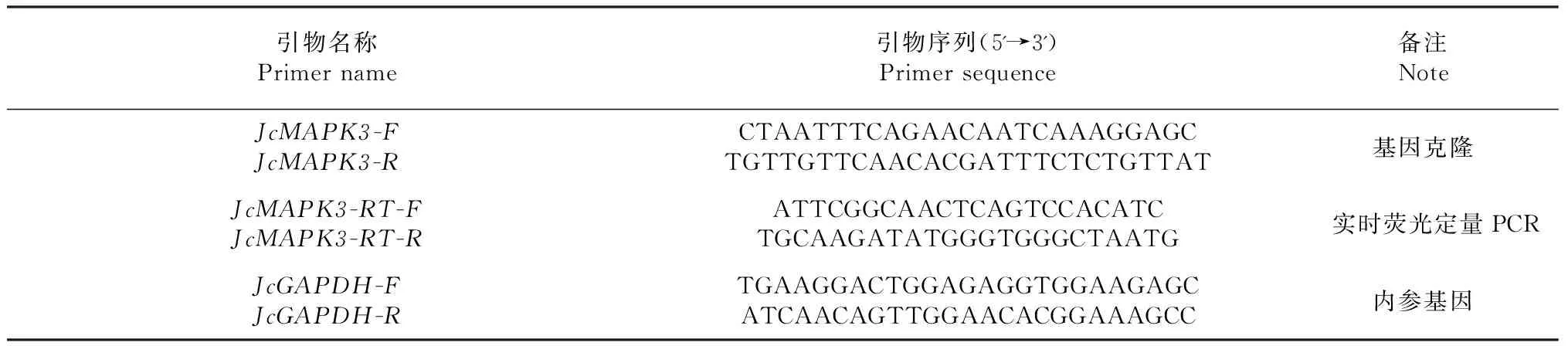
表1 JcMAPK3基因克隆及qRT-PCR引物
1.4 生物信息学分析
通过NCBI中的ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)找出JcMAPK3的开放阅读框,利用ProtParam(https://web.expasy.org/protparam/)分析JcMAPK3蛋白的基本性质等参数,小桐子JcMAPK3蛋白的二级结构使用SOPMA软件预测,JcMAPK3的三维结构预测则通过Phyre2软件进行。JcMAPK3跨膜结构分析通过在线软件TMHMM2.0(http://www.cbs.dtu.dk/services/TMHMM/)进行;JcMAPK3亚细胞定位使用ProtComp在线软件(http://linux1.softberry.com/);JcMAPK3蛋白保守结构域分析使用NCBI中的CDD数据库;JcMAPK3序列磷酸化位点预测利用NetPhos3.1进行。在DNAMAN8软件中将小桐子JcMAPK3序列与多种植物的MAPK3序列进行比对,利用MEGA X[23]进行MAPK3蛋白的亲缘关系分析,构建JcMAPK3蛋白进化树。
1.5 基因的表达分析
使用1.3测序正确后获得的小桐子JcMAPK3序列,在IDT DNA在线网站(www.idtdna.com/)中设计JcMAPK3基因的qPCR引物JcMAPK3-RT-F和JcMAPK3-RT-R(表1),以JcGAPDH为内参。使用Roche Lightcycler 96(Roche Diagnostics Ltd.)仪器进行小桐子JcMAPK3基因的qRT-PCR,配置qPCR反应体系20 μl,分别加入12 μl TB Green Premix Ex Taq II、上下游引物(JcMAPK3-RT-F/R)各0.9 μl,以及1.2 μl的小桐子cDNA模板,加ddH2O 5μl。qRT-PCR反应程序为:95 ℃预变性30 s,95 ℃ 5 s,60 ℃ 30 s,进行45个循环,3次生物学重复。使用2-ΔΔCT法[24]计算JcMAPK3基因的相对表达量,显著性分析(P<0.05)使用SPSS软件。
2 结果与分析
2.1 克隆得到小桐子JcMAPK3基因
以小桐子cDNA为模板,进行JcMAPK3基因编码序列(Coding sequence, CDS)的PCR扩增,电泳检测后得到一条为1500 bp左右的清晰条带(图1),长度与预期大小相符。对该目的条带进行切胶回收、载体连接、转化和测序后,结果表明其包含一个1119 bp的完整开放阅读框(Open Reading Frame, ORF),编码372个氨基酸(图2)。

1: DNA Marker DL5000;2: JcMAPK3基因1: DNA Marker DL5000; 2: JcMAPK3 gene

图2 小桐子JcMAPK3基因CDS序列及编码氨基酸序列Fig.2 CDS sequence and amino acid sequence of JcMAPK3 gene in J. curcas
2.2 JcMAPK3蛋白理化性质和疏水性分析
通过理化性质分析发现,JcMAPK3蛋白分子式为C1920H2985N521O551S20,总原子数为5997个,其相对分子量为42.82 kD,理论等电点pI为5.6;JcMAPK3蛋白编码372个氨基酸,其中亮氨酸(Leu)含量最高,为10.8 %,谷氨酸(Glu)为7.3 %、异亮氨酸(Ile)为7.3 %、脯氨酸(Pro)为7.0 %、丙氨酸(Ala)为6.7 %、精氨酸(Arg)为6.5 %、天冬氨酸(Asp)为6.2 %,负电荷氨基酸残基数为50个,正电荷氨基酸残基数为37个;其脂肪系数为91.77;不稳定指数Ⅱ为39.25(<40),被认定为稳定性蛋白。该蛋白的总平均疏水指数为-0.264,预测JcMAPK3为亲水蛋白。
2.3 JcMAPK3蛋白二级、三级结构预测分析
通过SOPMA预测JcMAPK3蛋白的二级结构(图3),结果表明JcMAPK3具有大量的α-螺旋(Alpha helix),占氨基酸残基总数的44.35 %(含有氨基酸165个);其次,无规则卷曲(Random coil)占氨基酸残基总数的36.29 %(135个);延伸链(Extended strand)占氨基酸残基总数的13.44 %(50个);β-折叠(Beta turn)占氨基酸残基总数的5.91 %(22个)。三级结构预测也表明小桐子JcMAPK3蛋白包含大量α-螺旋和无规则卷曲(图4)。

竖线由长及短分别为α-螺旋、延伸链、β-转角、无规则卷曲Vertical lines from long to short are Alpha helix, Extended chain, Beta turn and Random coil, respectively

图4 小桐子JcMAPK3蛋白的三级结构Fig.4 Tertiary structure of JcMAPK3 protein in J. curcas
2.4 蛋白质亚细胞定位、保守结构域、跨膜结构预测分析
亚细胞定位预测结果显示小桐子JcMAPK3蛋
白定位于细胞核和细胞质中。其保守结构预测结果表明(图5),JcMAPK3含有高度保守的STKc_TEY_MAPK结构域(含TEY基序的促分裂活化蛋白激酶_丝氨酸/苏氨酸激酶催化结构域)。磷酸化位点分析表明JcMAPK3含有8个Ser位点,9个Thr位点,7个Tyr位点。小桐子JcMAPK3蛋白跨膜结构预测结果表明该蛋白不具有跨膜结构域,也不包含跨膜螺旋。

图5 JcMAPK3蛋白保守结构域分析Fig.5 Protein conserved domain analysis of JcMAPK3
2.5 JcMAPK3基因同源性及进化树分析
通过NCBI Blast后发现MAPK3基因在多个物种中存在,利用DNAMAN8软件序列比对后发现(图6),小桐子MAPK3氨基酸序列与大戟科橡胶树(Heveabrasiliensis)XP_021655692.1、木薯(ManihotesculentaCrantz)XP_021610630.1序列一致性分别为94.20 %、92.47 %;与锦葵科陆地棉(Gossypiumhirsutum)NP_001314498.1序列一致性为92.47 %,与蔷薇科桃(Prunuspersica)XP_007205387、甜樱桃(Prunusavium)XP_021809182.1、月季(Rosachinensis)XP_024157102.1序列一致性分别为91.71 %、90.32 %、88.44 %,与木棉科榴莲(Duriozibethinus)XP_022729325.1序列一致性为91.42 %,与梧桐科可可(Theobromacacao)EOY34273.1序列一致性为91.58 %,与番木瓜科番木瓜(Caricapapaya)XP_021889758.1序列一致性为89.78 %,与桦木科白桦(Betulaplatyphylla)AHY02158.1序列一致性为88.83 %,与葡萄科葡萄(Vitisvinifera)RVW56822.1序列一致性为88.62 %,与葫芦科南瓜(Cucurbitamoschata)XP_022948699.1、黄瓜(Cucumissativus)NP_001267653.1序列一致性分别为87.63 %、90.33 %、与十字花科甘蓝型油菜(Brassicanapus)NP_001303218.1、高山离子芥(Chorisporabungeana)AAV68711.1、拟南芥(Arabidopsisthaliana)XP_002875737.1序列一致性分别为87.53 %、86.14 %、85.09 %,与杨柳科毛果杨(Populustrichocarpa)XP_002298450.1序列一致性为88.95 %,与豆科蔓花生(Arachisduranensis)XP_015952347.1序列一致性为87.37 %、与茄科烟草(Nicotianaattenuata)XP_019226861.1序列一致性为84.80 %。由此可见,JcMAPK3氨基酸序列与其他物种的同源性较高,且均含有TEY结构域,这表明该基因在进化过程中高度保守(图6)。

红色框表示JcMAPK3含有的TEY结构域The red box indicates the TEY domain contained in JcMAPK3
利用MEGA X软件构建进化树,将小桐子MAPK3氨基酸序列和其它20种植物MAPK3序列进行亲缘关系分析,结果(图7)显示,小桐子的MAPK3与大戟科的橡胶树和木薯聚在同一分支上,亲缘关系较近;与拟南芥、高山离子芥、欧洲油菜、烟草、大豆距离较远,其亲缘关系也较远。
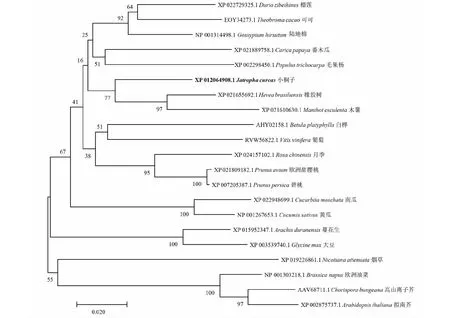
标尺表示遗传距离;数值表示从1000次重复计算得到的Bootstrap百分比值The scale bar represents genetic distance;Numbers represent the bootstrap percentage values calculated from 1000 replicates
2.6 小桐子不同器官中JcMAPK3基因的表达模式
JcMAPK3基因在小桐子中不同器官表达分析结果(图8)显示,JcMAPK3基因在根、茎和叶中均有表达,但JcMAPK3基因在根中表达量最高,茎中次之,叶中表达量最低,根中的表达量为叶片中的17.03倍,是茎中的3.39倍,这表明JcMAPK3基因在小桐子中的表达存在显著的器官特异性(P<0.05)。
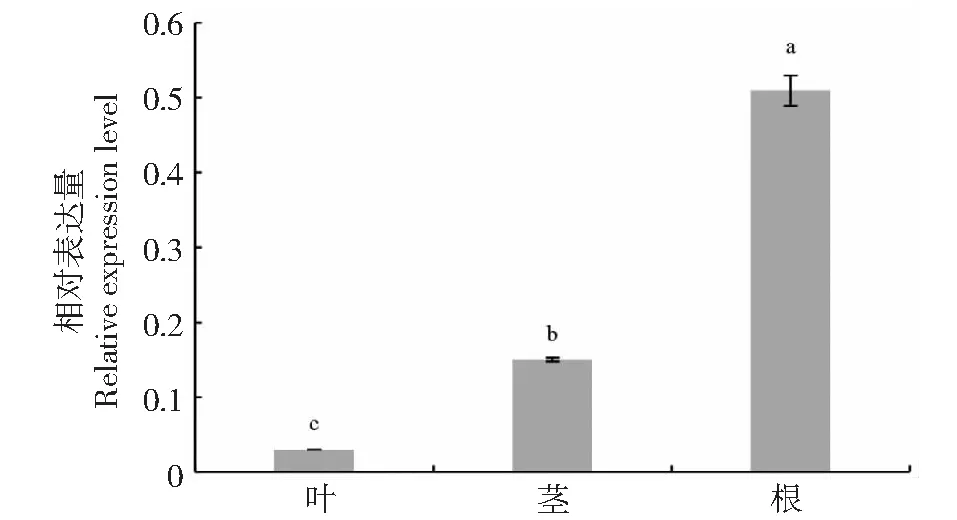
不同英文小写字母表示处理间水平存在差异显著性(P<0.05)There are significant differences level between different lower-case letters (P<0.05)
2.7 低温处理下JcMAPK3基因的表达模式
前期的研究发现,小桐子幼苗经过12 ℃低温锻炼后,其在1 ℃低温胁迫下的抗冷性大幅提高[19-20]。在1 ℃低温胁迫和12 ℃低温锻炼处理0、6、12、24、48、72 h后,对小桐子幼苗叶片中JcMAPK3表达量进行qRT-PCR分析,结果(图9)显示,在1 ℃低温胁迫后,JcMAPK3基因出现明显的上调表达,在72 h表达量最高,为对照(0 h)的13.5倍;在12 ℃低温锻炼期间,JcMAPK3基因表达量以48 h最高,为对照(0 h)的5.58倍。这些结果表明JcMAPK3可以显著响应1 ℃低温胁迫和12 ℃低温锻炼,JcMAPK3明显受到低温诱导表达。
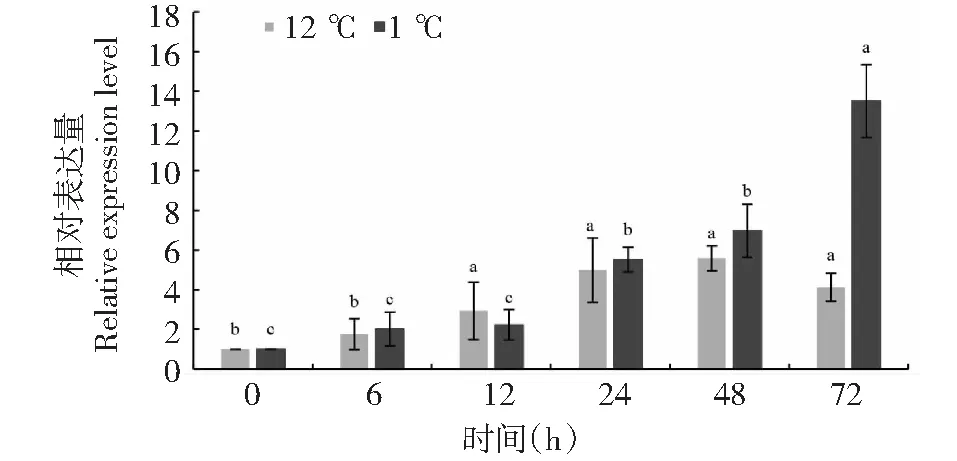
同一温度下不同英文小写字母表示处理间水平存在差异显著性(P<0.05)There are significant differences level between different lower-case letters at the same temperature (P<0.05)
3 讨 论
MAPK级联途径在长期的进化过程中高度保守,MAPK连接着上游级联反应与下游信号转导,是细胞信号传导过程中的关键蛋白激酶。通过从小桐子中克隆到JcMAPK3基因,生物信息学分析显示JcMAPK3基因编码372个氨基酸,相对分子量为42.82 kD,JcMAPK3蛋白在激活环上含有保守的TEY结构域,与MAPK家族的典型特征一致,说明克隆到的JcMAPK3基因属于MAPK家族。小桐子JcMAPK3蛋白的序列与其它植物的同源性较高,进化树分析表明小桐子JcMAPK3蛋白与橡胶树和木薯聚在同一分支上,亲缘关系较近。
低温影响植物的生理生化代谢和生长发育过程,是限制植物生长的环境因子之一[25-26]。已有许多研究证实MAPK基因的表达受环境诱导,甘薯[Ipomoeabatatas(L.) Lam]IbMPK3和IbMPK6的激酶活性被NaCl、SA、H2O2和ABA诱导,IbMPK3/6在烟草中的瞬时表达增强了病原体的耐受性[27]。在干旱胁迫下甲基环丙烯处理后,甘蔗(SaccharumofficinarumL.)通过调控SoMAPK4的表达来维持细胞内生理生化平衡,最终抵御干旱胁迫[28]。水稻(OryzasativaL.)中OsMPK3和OsMPK6在12 ℃低温下被激活,在转基因植株中过表达后抗冷性增强,表明OsMPK3和OsMPK6参与调控水稻的抗寒性[29]。吴绍华等在橡胶树中发现HbMAPK1受低温诱导表达,与橡胶树抵御低温逆境有关[30]。有研究显示,CsMAPK3参与茶树(Camelliasinensis)的抗寒、耐盐响应,茶树在ABA处理、寒冷和盐胁迫下,CsMAPK3的表达均显著上调[31]。在前期对小桐子低温响应的转录组测序结果的基础上[21],研究发现JcMAPK3的表达在小桐子中存在器官特异性,且JcMAPK3基因可以显著响应12 ℃低温锻炼和1 ℃低温胁迫。在1 ℃低温胁迫72 h,小桐子JcMAPK3基因表达量最高,为对照(0 h)的13.5倍;在12 ℃处理48 h时JcMAPK3表达量最高,为对照(0 h)的5.58倍,表明JcMAPK3表达显著,受到低温诱导表达。研究发现,12 ℃处理下72 h时表达量下调,而1 ℃处理下48、72 h时MAPK3表达量仍然上调,1 ℃低温胁迫72 h的JcMAPK3基因表达量是12 ℃低温锻炼下的3.28倍,12 ℃属于临界生长温度,1 ℃对小桐子有致命的伤害,JcMAPK3对1 ℃胁迫响应更强烈,在短期内快速引发一系列的信号系统来响应和抵御低温。
4 结 论
通过研究克隆到小桐子的MAPK家族基因,命名为JcMAPK3,其开放阅读框为1119 bp,小桐子JcMAPK3基因在12 ℃低温锻炼和1 ℃低温胁迫下受到低温诱导表达显著,推测JcMAPK3基因参与小桐子对低温的响应与适应过程,在小桐子低温信号转导及耐冷性提高中起重要作用,这为后续的小桐子抗冷性的分子育种提供了一个重要的基因资源和理论依据。
