基于SSR分子标记的柚资源遗传多样性分析
2020-02-25陈林杨董蓉娇刘梦雨赵东兴杨永智赵志昆
陈林杨,刘 萍,董蓉娇,刘梦雨,赵东兴,杨永智,赵志昆*
(1.云南省红河热带农业科学研究所,云南 河口 661300;2.云南农业大学农学与生物技术学院,云南 昆明 650201;3.西南大学柑桔研究所/中国农业科学院柑桔研究所,重庆 北碚 400712)
【研究意义】柚[Citrusmaxima(Burm) Merr.]为芸香科(Rutaceae)柑橘属(CitrusreticulataBlanco)乔木,在柑橘产业中占有越来越重要的地位,而中国作为柚的主要起源和遗传变异中心之一,虽然拥有丰富的柚类种质资源,但由于有些地方老品种面临着分布零散并且被砍伐等严重的问题,导致中国柚类种质资源遗传多样性降低。柚作为芸香科柑橘属的一员,在不同的地方有内紫、雷柚等别称。【前人研究进展】SSR分子标记技术已被用于绿豆[1]、金沙柚[2]的遗传多样性研究、南丰柑橘[3]种质资源亲缘关系的研究、浙江地区柚[4]种类资源遗传关系的分析,且取得良好的结果,但将其直接用于柚类资源的遗传多样性的研究相对较少,因此利用SSR分子标记技术对柚类资源进行遗传多样性分析对充分保护和利用柚资源具有重要意义。其中王炯根据前人所设计的COS引物,对柑橘近缘、远缘属植物进行试验,结果表明,目标引物对柑橘属及其近缘、远缘属均可以进行有效扩增及区分[5-6]。【本研究切入点】柚类虽属于柑橘属,但利用SSR分子标记技术直接对柚类资源进遗传多样性分析的研究相对较少且不够全面。【拟解决的关键问题】通过SSR-PCR分子标记技术,筛选出扩增效果好、多态性较高的引物用于系谱分析,其次对SSR分子标记的多态性条带进行统计,构建遗传距离矩阵,获得亲缘关系聚类图,最后对柚资源遗传多样性进行分析,以期为充分利用及保护云南及其他地区的柚资源提供理论依据。
1 材料与方法
1.1 供试材料
供试柚[Citrusmaxima(Burm) Merr.]材料共35份,红热青柚1号、红热青柚1号亲本、红热青柚2号、红热青柚2号亲本、红热青柚5号、红热青柚6号、红热青柚7号取自云南省红河热带农业科学研究所,其余28份取自中国农业科学院柑桔研究所,以上材料均由云南省红河热带农业科学研究所的赵志昆老师提供(表1)。
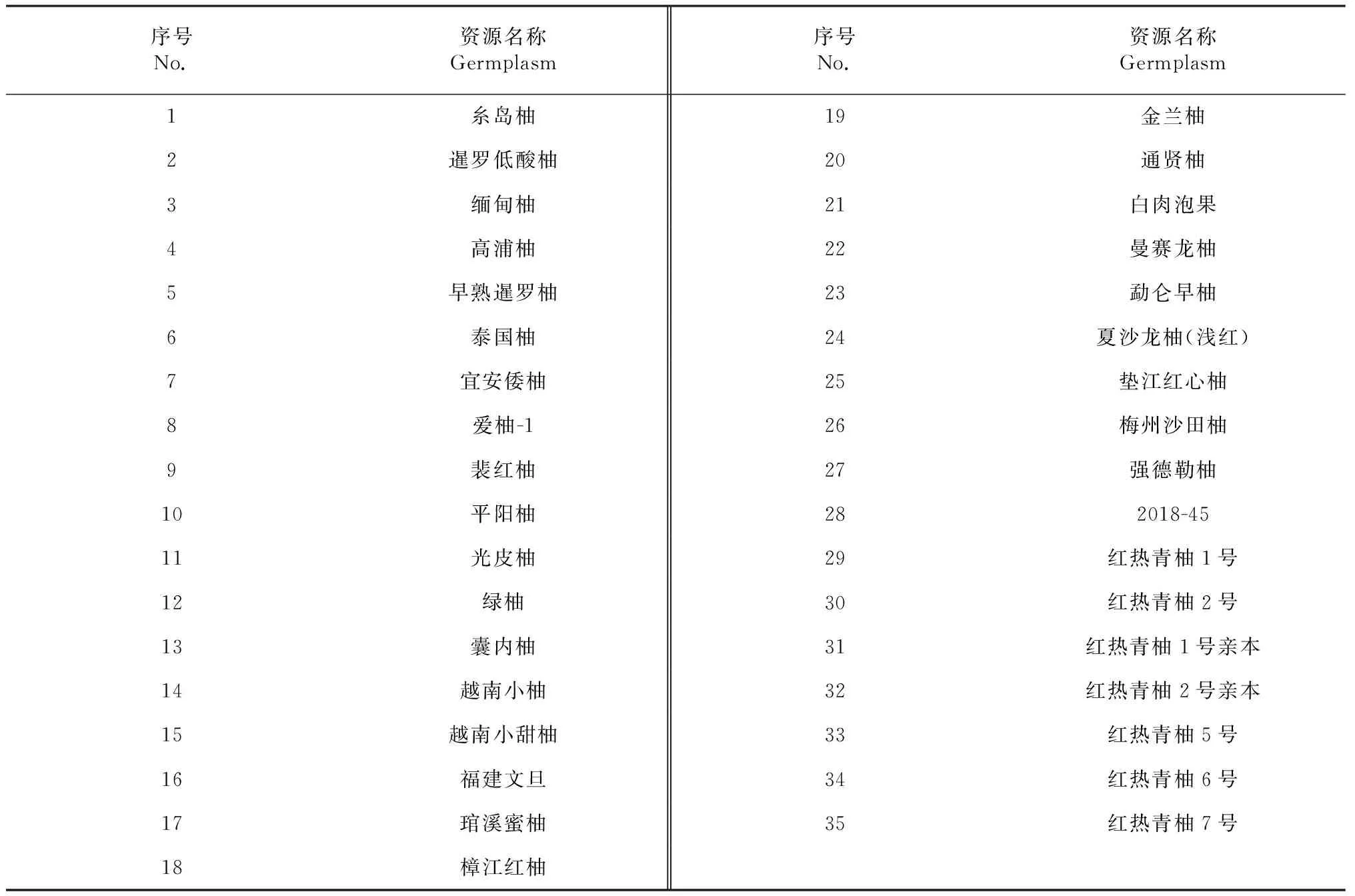
表1 用于SSR标记分析的材料
主要的试剂药品及来源见表2。

表2 主要试剂及药品
SSR引物来源为柑桔研究所资源与育种研究室用于柑桔品种鉴定所用的分子标记[5-9],所用引物由深圳华大基因公司合成。
主要的仪器设备及来源见表3。

表3 主要仪器及设备
主要的溶液配制见表4。

表4 主要溶液的配制
1.2 基因组DNA的提取
采用改良的CTAB法提取35份供试材料的DNA,提取步骤严格按照说明书进行,其中用到的试剂及使用时的注意事项见表5,最终提取产物于-20 ℃保存。

表5 提取DNA所用试剂及注意事项
(1)编号:将供试柚按照不同品种编号,并在相应的离心管上写上编号。
(2)称量、研磨:称取植物新组织100 mg(或干重组织30 mg)放入对应的试管中,加入液氮充分研磨,用移液枪吸取PL 600 μl,在组织回绿前加入材料中,利用振荡器实现二者充分混合。
(3)65 ℃的水浴条件下加热30 min,在此过程中离心管每隔10 min就需要颠倒1次,使样品混匀并放气。
(4)用移液枪吸取提前配制好的氯仿/异戊醇/无水乙醇700 μl,加入上一步得到的混合溶液中,持续颠倒10 min,使样品混合均匀,13 000 r/min离心5 min,目的在于除去溶液中的多糖多酚。
(5)用移液枪吸取550 μl上清液至另一个全新的1.5 mL 离心管中,再次进行上一步骤。
(6)再次用移液枪分别吸取上清液550 μl和PQ 720 μl,在离心前用手甩2~3次,目的在于让溶液混和均匀,保证实验质量(此步骤有可能出现沉淀)。
(7)将上一步获得的混合物加入另一个全新的吸附柱AC中。在离心速度不变的情况下离心30 s,结束后倒掉废液。
(8)吸取IR500 μl,在12 000 r/min 的条件下离心30 s,结束后倒掉收集管中的废液。
(9)加入WB 600 μl,离心条件与操作步骤与上一步相同。
(10)再重复操作上一步骤1次。
(11)将吸附柱AC放至另一个全新的空收集管中,在12 000 r/min的条件下再次离心2 min,离心结束后倒掉废液,此步骤的目的在于除去WB中的乙醇。
(12)再次把AC放入到一个干净的离心管中,加入EB 100 μl,静置5 min,在离心速度不变的情况下离心1 min。
(13)在保证离心条件不变的情况下将收集管中的液体重新加入到另一个全新的、干净的AC中,静置2 min后进行离心,收集DNA。
(14)检测:称取琼脂糖0.4 g及量取1×TBE 50 mL,两者充分混合,配制成0.8 %的琼脂糖胶,吸取DNA 3 μl检测提取的DNA质量,在凝胶成像系统中观察并拍照保存。
1.3 SSR引物合成与PCR扩增
1.3.1 引物合成: SSR为柑桔研究所资源与育种研究室用于柑桔品种鉴定所用的分子标记[5-9],所用引物由深圳华大基因公司合成。SSR引物及其对应序列的相关信息见表6。

表6 SSR引物序列信息
1.3.2 PCR扩增体系的构建 以35份柚基因为模板,在Biometra TAdvanced PCR仪上利用51对SSR引物对其进行SSR-PCR扩增,在参考相关文献和反复试验后,建立了良好的SSR-PCR反应体系。
PCR扩增采用20 μl反应体系:由5 ng/μl样品DNA、0.5UTaq(TaKaRa)DNA聚合酶、25 mmol/L的MgCl2和0.33 nmol/L的上下游引物组成,混匀后加ddH2O至20 μl。
经多次实验后,最终确定了引物筛选实验统一的反应条件,PCR反应条件如下:94 ℃ 5 min.94 ℃ 30 s;55 ℃ 30 s;72 ℃ 30 s; 72 ℃ 10 min;35cycles。
筛选出合适引物后,进行引物温度梯度实验,确定每个引物最适合的退火温度,PCR扩增产物用8 %的Native-PAGE进行检测,于4 ℃条件下保存。
1.3.3 8 %的Native-PAGE PCR产物用8 %的Native-PAGE检测结束后用银染法检测被扩增的DNA谱带,具体步骤如下。
(1)玻璃板、胶垫、梳子在使用前用ddH2O清洗干净并用75 %的C2H6O擦拭;安装电泳槽。
(2)配胶、灌胶、插梳子:灌胶速度要迅速,插梳子时避免气泡产生,约40 min,待胶凝固后再轻拔梳子。
(3)预电泳:恒压200V、15 min。
(4)点样:用微量取样器取混合物1 μl(指示剂与扩增产物)注入地点样孔。
(5)电泳:升高电压至250V,待溴酚蓝扩散到凝胶底部时停止电泳,时间一般为1.7 h。
(6)电泳结束后,用硝酸银进行染色。
(7)用凝胶成像系统中白光透射观察凝胶,并拍照保存。
1.3.4 银染色的步骤 电泳结束后,将凝胶剥下用ddH2O冲洗几次,彻底去除凝胶表面的缓冲液。将洗干净的凝胶放入400 mL染色液中,立刻盖上盖子,置于水平摇床上匀速摇10 min。用ddH2O冲洗凝胶,彻底去除残留的染色液。倒入400 mL显色液,水平摇床匀速摇晃直至条带清晰。回收显色液,自来水清洗凝胶。
1.4 数据统计与分析
用人工读带的方法对电泳图的结果进行解读,根据SSR电泳条带的有无记录供试柚基因型。1表示有条带(包括弱带), 0表示无条带, 构建 (0, 1) 矩阵[10]。利用Genetic Distance,Coefficient = NEI 72计算35份供试材料之间的遗传距离,通过NTsys 2.10e软件以及遗传距离NEI重建系统发生树且用UPGMA算法进行聚类分析[11]。
2 结果与分析
2.1 SSR引物筛选结果
从51对SSR引物中筛选出31对扩增效果及重复性较好、条带清晰、多态性较高的引物用于系谱分析,31对SSR引物见表6。引物COSC4-9和引物P74的扩增效果见图1~2。

图1 SSR引物COSC4-9对24份(部分)实验材料的扩增结果 Fig.1 Amplified result of 24 (partial) experimental materials by SSR primer COSC4-9
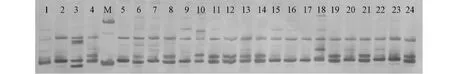
图2 SSR引物P47对24份(部分)实验材料的扩增结果Fig.2 Amplified result of 24 (partial) experimental materials by SSR primer P47
2.2 SSR标记的聚类分析
从图3中可以看出,31对引物能将35份材料区分开,在相似系数为0.214时,35份植物材料被分为3大组,第1组在遗传距离为0.25处将强德勒柚和平阳柚视为一类。第3组在遗传距离为0.178处又分为2个亚组,其中糸岛柚、高浦柚和红热青柚6号聚为1个小组,红热青柚1号、红热青柚1号亲本、红热青柚2号、红热青柚2号亲本、红热青柚5号聚为1个小组。剩余材料均聚在第2组,第2组在0.166处又分为2个亚组,其中红热青柚7号与勐仑早柚、越南小甜柚、金兰柚归为1个小组。从聚类分析结果可以看出,红热青柚1号、红热青柚1号亲本、红热青柚2号、红热青柚2号亲本、红热青柚5号之间亲缘关系较近,其中红热青柚1号、红热青柚2号亲本与红热青柚1号、红热青柚2号的亲缘关系更为接近,红热青柚1号、红热青柚2号之间的遗传差异非常小。
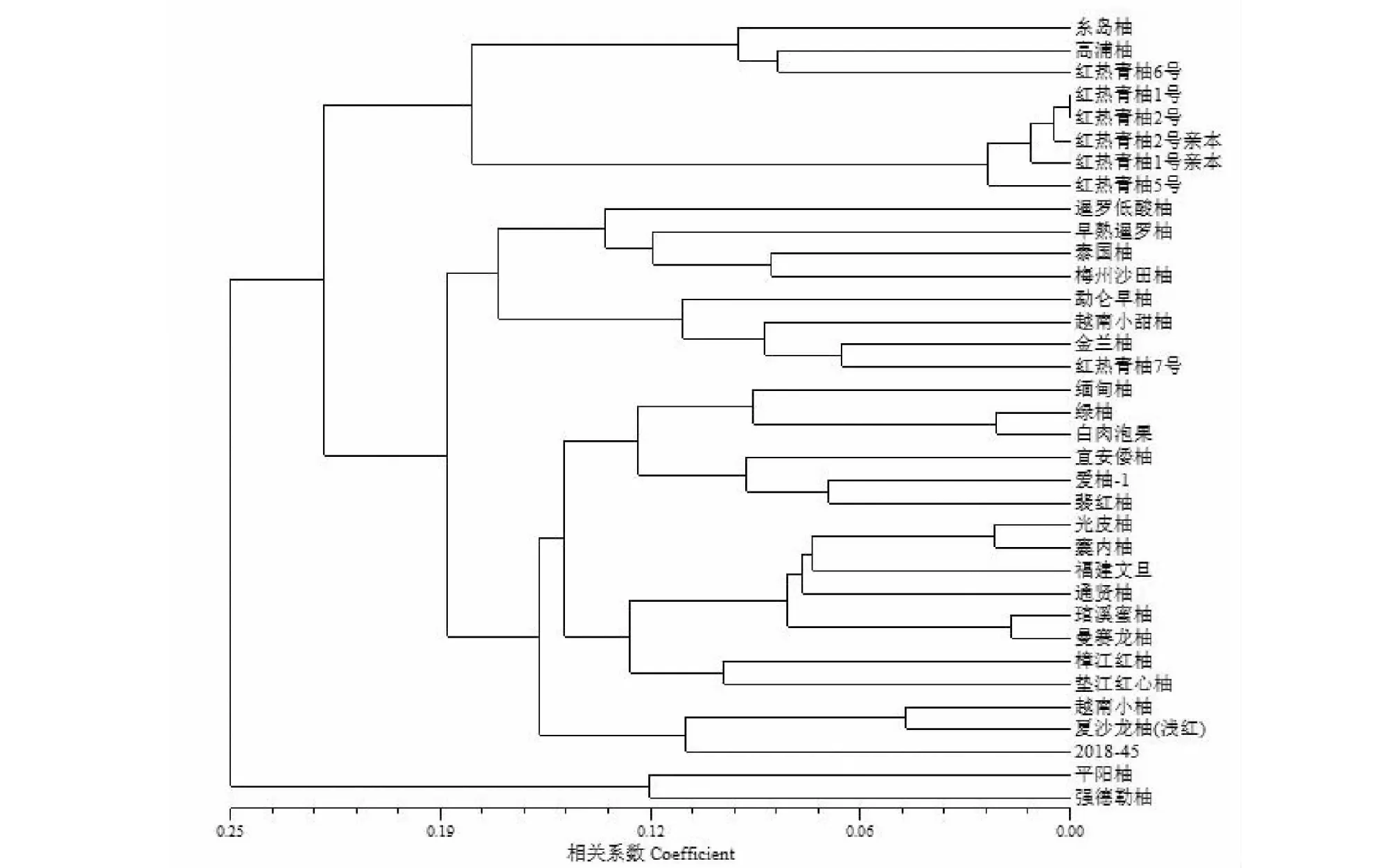
图3 35份植物材料SSR标记UPGMA聚类图Fig.3 UPGMA cluster map of 35 plant materials with SSR markers
3 讨 论
3.1 SSR对柚资源的研究
SSR由于具有可快速鉴别品种真实性和纯度且其不受环境对植物形态的影响,可以从分子水平上区分不同品种间的遗传距离,十分稳定可靠,被认为是一种理想的遗传多样性分析技术[12-13]。李益[7]等人对柑橘属的8个主要栽培种进行SSR分子标记,筛选出21对SSR核心引物,成功建立了柑橘品种SSR分子标记鉴定体系;刘冬峰[4]等人利用23对SSR引物对浙江地方柚类进行分析,表明该地区种质资源有丰富的遗传多样性,并构建了浙江地方柚类资源的种质鉴定图;以上均表明SSR分子标记已被广泛用于柑橘属遗传多样性的研究,虽然柚属于柑橘属,但基于SSR分子标记技术直接对柚类资源进遗传多样性分析的研究相对较少,且用其对柑橘属所进行的遗传多样性的分析具有一定的地域限制以及品种单一等缺点[4],因此利用SSR分子标记技术对柚类资源进行遗传多样性分析对于柚类资源的保护和充分利用具有重要意义。
3.2 供试柚之间的亲缘关系
利用NTsys 2.10e软件对35份供试材料进行聚类分析,对其遗传多样性水平作出一定的评价,聚类结果与系谱来源具有较高的关联,在相似系数为0.214时35份植物材料被分为3大组。35份供试柚的遗传相似系数矩阵和聚类结果最终结果表明,35份供试品种之间的遗传相似系数的变化在0.00~0.25,平均为0.125,遗传相似系数偏低,表明35份供试材料之间的遗传水平较宽。此外,在第3组中,红热青柚1号和红热青柚2号亲缘关系很近,用引物无法将其区分开;在第2组中,泰国柚和梅州沙田柚、金兰柚和红热青柚7号、绿柚和白肉泡果、翡红柚和爱柚-1、光皮柚和囊内柚、琯溪蜜柚和曼赛龙柚、樟江红柚和垫江红心柚、越南小柚和夏沙龙柚(浅红)能够较好的聚在一起。
35份供试柚的遗传相似系数矩阵和聚类结果表明,供试柚之间遗传多样性水平较高,说明品种之间遗传背景差异大,遗传基础相对较宽,总体上遗传多样性比较丰富。
4 结 论
以35份来自不同地方的柚为材料,从51对SSR候选引物中共挑选出31对多态性高、稳定性好、条带清晰的引物。这些SSR核心引物对35份供试柚具有良好的区分能力,通过31对多态性引物组合将35份供试柚聚为3大组,遗传多样性较宽。通过对其遗传多样性的分析,可为今后柚资源保护和品种鉴定奠定理论依据。
